На органном уровне первое нарушение эмбриональной симметрии начинается с искривления сердца вправо. Эмбриональное петлеобразование сердца начинается после слияния левого и правого эпителиального компартментов, чтобы сформировать прямую, однокамерную, трубчатую структуру. Причиной бразования петли сердца впаво скорее всего является асимметричная экспрессия ВКМ в левой части поля сердца по сравнению с правой. Сложность феномена петлеобразования иллюстрируется несколькими уровнями регуляции, нарушение которых ведет к нарушению направления петлеобразования. Нарушения разных вышестоящих регуляторных генов, специфицирующих L/R ось, молекул ВКМ, flexure эмбриона или молекул цитоскелета, всё это нарушает нормальное направление петлеобразования.
Флектин сначала экспрессируется в левой половине поля сердца кур на ст.3-5 сомитов, затем постепенно начинает экспрессироваться справа. Эта лево-правосторонняя задержка во времени экспрессии флексина создаёт обнаружимую физическую асимметрию сердечной трубки до петлеобразования (Рис. 9).
На ст. 10-11 эмбриогенеза после того как две билатеральные кардиальные области сливаются по срединной линии, флектин экспрессируется асимметрично в дорсальных мезкардиальных складках, спланхнической мезодерме, соседней со срединной линией вентральрного дна передней кишки и внутри миокарда. Если взаимодействия белка флектина нарушены с помощью антител, то направленность петлеобразования составляет 30% влево, 35% вправо, в отсальных случаях петлеобразования не происходит. Другая молекула ВКМ hLAMP-1, которая также присутствует на ст. петлеобразвоания, обнаруживает др. паттерн экспрессии по сравнению с флектином в сердце, хотя в некоторых областях они ко-локализуются. Экспрессия hLAMP-1 не меняется в сердце с аномальным пелеобразованием влево, указывая тем самым, что флектин играет иную роль, чем hLAMP-1 в петелобразовании сердца. Когда сердце изгибается вправо на ст. 12, то флексин остаётся локализованным асимметрично в дорсальных мезокардиальных складеах и спланхнической мезодерме, соседствующей с вентральным дном передней кишки, а также в миокарде. Спланхническая мезодерма вблизи стенки переденей кишки на ст. 12 обозначается как
вторичное поле сердца и флексин продолжает постоянно экспрессироваться на высоком уровне в левой стороне этого поля и в левой части дорсального мезокардия.
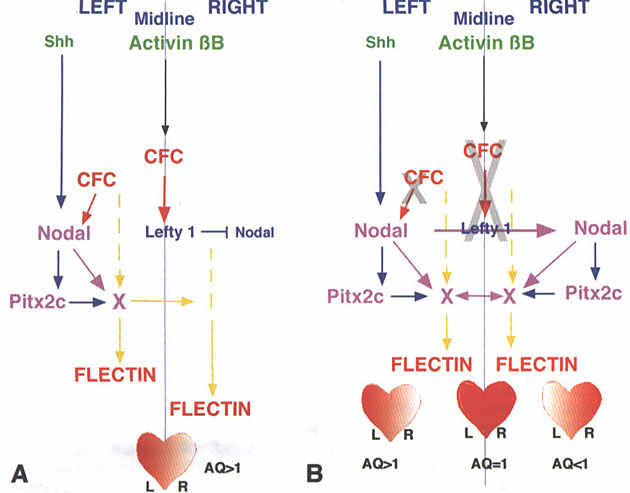
Наиболее заметным результатом вышестоящей модуляции CFC? также как и неправильной экспрессии Pitx2 у эмбрионов кур являются нижестоящие пертурбации нормального паттерна асиметрии флектина во ВКМ в развивающемся сердце и особенно в дорсальных мезокардиальных складках/спланхнической мезодерме. Нарушение асимметрии флектина проявляется в виде непосредственно наступающей рандомизации петлеобразования сердца. Т.к. мутации RIEG/Pitx2 у людей вызывают гаплонедостаточность, наш анализ позоляет предположить, что эти эффекты зависят от пороговых концентраций Pitx2 примерно на ст. 7-8 в левой части поля сердца, это м. нарушать параллельный путь, который ведёт к экспрессии нижестоящего флектина в сердце (Рис. 9). Если Pitx2 билатерально экспрессируется неправильно, то
timing флексина предопределяется относительными концентрациями Pitx2 в билатеральных полях. Возникающие в результате лево-правостороннеи пороговые концнентрации флектина и м. предопределять направление петлеоразования сердца. Как показывают результаты даже минорные различия в матричной асимметрии м. оказать большое влияние на нормальный морфогенетический процесс и приводить к аномалиям на уровне органа. Пока неясно, как матричная асимметрия в дорсальном мезокардии/спланхничекой мезодерме, а не кардиальный гель/миокард, оказываю.т влияние на направление изгиба сердечной трубки.
CFC модуляция Nodal/Pitx2 экспрессии и ее участие в предоминировании флектина на одной из сторон сердечной трубки указывает на то. что Nodal/Pitx2 косвенно посредством фактора "Х", как показано на Рис. 9, модулируют путь, который регулирует экспрессию флектина. Косвенное влияние подтверждается, т.к. флексин экспрессирутеся нормально и в левой и правой пластинке латеральной мезодермы, тогда как Nodal/Pitx2 экспрессируется только слева. Однако он влияет на время синтеза белка флектина в левой латеральной мезодерме, что и обусловливает его асимметрию. Это регулирование во времени со стороны Pitx2 связано или с акивированием промежуточных молекул или дерепрессией репрессирующих молекул в левой латеральной мезодерме. Этот сигнал м. постепенно пересекать каим-то образом средирнную линию в правую половину поля сердца. Участие xленов семейства TGF-β, таких как Lefty-1, в этом пересечении вполне возможно. Lefty-1 в срединной линии действует в первую очередь midline ингибитор, продиводействующий билатеральной экспрессии Nodal. Антагонизм Nodsl является, по-видимому, главным эффектом, обеспечивающим паттерн билатеральной экспрессии Pitx2. Участие Lefty-1 также м. иметь отношение к распространению экспрессии флектина через срединную линию, однако это слишком необпределенно из-за большого количества членов семейства TGF-β, регулирующих синтез белков ВКМ.
Модулирование экспрессии флектина разными экспериментальными подходами подтвержает, что кардиальное петлеобразование регулируется множественными сигналами и параллельными путями, которые взаимодействуют.
An Importance for the Midline of the Ventral Floor of Pharinx and Secondary Heart Field
Это подтверждается биомеханикой, а также экспериментами по деградации галуронидазы кардиального гелшя у эмбрионов кур. У обработанных гиалуронидазой эмбрионов кур петлеобразование сердца протекает нормально и флектин продолжает обнаруживать нормальную асимметрию с предоминированием в левом дорсальном мезокардии, в соседней спланхнической мезодерме и миокарде. Молекулы внутри дорсальной мезокардиальной области и структурах кардиальной срединной линии, включая расположение вентрального дна передней кишки, обнаруживают морфорегуляторное значение не только для петелеобразования сердца, но также и для последующего развития сердца. Как было нами показано, внутри этой срединной области вентральной энтодермы м.б. определен компартмент клеток на базе их межклеточных ассоциаций, обеспечиваемых плакоглобином. Plakoglobin и β-катенин являются разными молекулами с очень сходной структурой и функцией, которые ассоциируют с кадхеринами на клеточной мембране. β- Катенин/плакоглобин в целом ассоциированы с образованием компартментов эмбрионов. ранее было показано, что N-cadherin/β-catenin вычленяют кардиальные компартменты билатерально. Такие компартменты детерминируются у эмбрионов для координации клеточной функции или в результате индуктивных событий или в результате формирования ткани. На ст. 14 эта дорсальная область начинает экспрессировать Gata-4, Nkx 2.5 и FGF-8, они возможно участвуют в индукции миокардиализации спланхнической мезодермы вторичного поля сердца, т.к. оно включается в сердечную трубку. Недавно было подтверждено, что такой центр сигналов в энтодерме переденей кишки д. существовать и что он д.б. связан с развитием сердца (Lickert et al., 2002).
Итак, вентральное дно переденей кишки играет, по-видимому, не только важную сигнальную роль во время пре- и раннего петлеобразования, но и после петелеобразования, начиная со ст. 12 с образованием вторичного поля сердца. Вторичное кардиальное поле соответствует дорсальным мезокардиальным складкам и распространяется на спланхническую мезодерму, соседнюю с вентральным дном переденей кишки. Эти области продолжают обнаруживають асимметричую экспрессию флектина со ст. 12 и далее. На ранней ст. 9 это передняя область, которая предопределяет направление петлеобразования, которое наиболее выражено на ст. 11. Спустя 5-8 ч (ст. 12-13) эта область, обозначается как вторичное кардиальное поле на базе экспериментов с дополнительными кардиальными сегментами, добавляемыми к инициальной вентрикулярной области прямой сердечной трубки. На ст. 14 передача сигналов внутри вторичного кардиального поля облегчаются возможно с помощью ВМР-2 и FGF-8 в спланхнической мезодерме, соседствующей со стенкой передней кишки и с помощью GATA-4 в компартменте вентральной энтодермы переденей кишки, который также экспрессировал GATA-4 и раньше, т.е. в билатеральной передней энтодерме, лежащей поверх спланхнической прекардиальной мезодермы. Т.о., обусловленные индуктивными сигналами в этой области, новые сегменты, добавляемые к прямой сердечной трубке формируют тракт оттока миокарда. Это указывает на то, что при добавлении новых кардиальных сегментов этот процесс позволяет изгибанию сердца сделаться глубже. Кроме того, этот вновь сформированный миокард продолжает обнаруживать лево-правосторонюю асимметрию по флектину, т.к. флектин продолжает экспрессироваться асимметрично во вторичном сердечном поле в течение всей стадии петелобразования.
Становится ясным, почему петлеобразование рассматривается как ключевой момент морфогенеза сердца и почему минорные пертурбации этого процесса м. вызывать серьёзные врожденные уродства. Учитывая сложность состава матрикса и молекулярные взаимодействия и что некоторые из матричных молекул м. выступать в качестве сигнальных молеклу, необходимо начинать разбираться, как молеклуярная ассиметрия м. регулировать не только биохимические параметры органа, но и биофизические. Аномальное петлеобразование м. приводить к неправильному расположению и последующему развитию кардиальных камер, клапанов и перегородок, а также кровеносных сосудов, вступающих в сердце, всё это м. приводить к целому спектуру врожденных аномалий.
Сайт создан в системе
uCoz