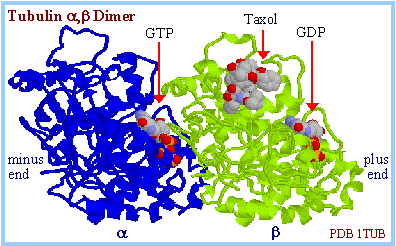
| a,b-tubulin гетеродимер является основной структурной единицей микротрубочек. a и b тубулины, каждый из которых примерно 55 kDa MW, являются гомологичными, но не идентичными. Каждый имеет сайт связывания нуклеотидов. | 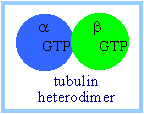 |
- a-Tubulin связывает молекулу ГТФ, которая не гидролизуется.
- b-Tubulin м. связывать ГТФ или ГДФ. При определенных условиях b-tubulin м. гидролизовать свой связанный ГТФ до ГДФ плюс Pi, высвобождать Pi, и обменивать связь ГДФ на ГТФ.
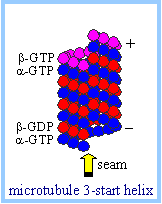
| Микрорубочка является полым цилиндром примерно 24 nm в диаметре. Вдоль оси микротрубочки тубулиновые гетердимерысоединяются конец-в-конец, образуя протофиламенты, с перемежающимися a & b субъединицами. Закручивающаяся сборка 13 протофиламент дает спиральное расположение тубулиновых гетердимеров в стенке цилиндра.
Электронномикроскопически микротрубочки декорированы головками моторных белков, показывающими "3 стартовые спирали" в которых каждый оборот (turn) спирали распространяется на 3 тубулиновых мономера (напр., a, b, a). Это дает в результате стенку микротрубочки, имеющую "шов" ("seam"), где, вместо преобладания aa и bb латеральных контактов, a субъединица латерально соседствует с b субъединицей. |
 |
ГТФ (GTP) д.б. связан как с a так и с b субъединицами, чтобы тубулиновый гетеродимер ассоциировал с др. гетеродимером, формируя протофиламенту или микротрубочку. Во время сборки микротрубочек in vitroгетеродимеры соединяются конец-в-конец, образуя протофиламенты, которые ассоциируют латерально, чтобы сформировать листок , и в конечном счете микротрубочку. In vitro гетеродимеры м. добавляться или диссоциировать на любом конце микротрубочки, но имеется очень высокая тенденция присоединения субъединиц к плюс концу, где экспозирован b-тубулин.
| Добавление субъединиц ведет к тому, что b-тубулин, который свободен (exposed) на плюс конце вступает в контакт с a-тубулином. Это обеспечивает гидролиз ГТФ, связанного теперь с нижним b-тубулином.
Pi диссоциирует, ноb-тубулин внутри микротрубочки не может обменивать свою связь с ГДФ на ГТФ. ГТФ на a-тубулине не гидролизуется.
Минус конец a-тубулина м. вносить существенный остаток в каталитический сайт b-тубулина. Т.о., минус конец a субъединицы м. служить как GAP (GTPase activating protein) для b-тубулина соседнего димера в протофиламенте. |
 |
| Сайт, связывающий нуклеотид у тубулинов структурно сходен с нуклеотид связывающим сайтом ГТФ-связывающих белков Ras сверхсемейства. Нуклеотид связывается по соседству с b-листком (цвет magenta справа). Сайты связывания нуклеотида у моторных белков и кинезина также структурно сходны с таковым у Ras.
Нуклеотид связывающий домен тубулинов включает высоко законсервированные последовательности GGGTG(T/S)G. Эти последовательности, показаны черным справа, они являются частью петли, которая простирается от одной из b-нитей (окрашена magenta) и проходит вблизи nucleotide phosphates. |
 |
|
Посмотрите справа структуру a,b-тубулинового гетеродимера. А акже посмотрите анимацию, объясняющую сборку микротрубочек. |
 a,b-Tubulin |
 |
| В дублетах и триплетах микрротрубочек стенка одной микротрубочки частично состоит из стенки присоединенной микротрубочки. |
|
| Рис. справа показывает singlet, doublet, and triplet микрорубочек на поперечном срезе. Трубочка A дублета или триплета является полным цилиндром, состоящим из 13 протофиламент. "Нестандратные" B или C трубочки состоят менее, чем из 13 протофиламент, обычно 10. . | 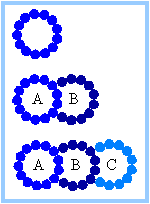 |
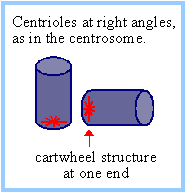
| Центриоли являются цилиндрическими структурами, обычно парными, ориентированными др к др под прямым углом. Стенка каждого цилиндра центриоли образуется 9 взаимосвязанными триплетами микротрубочек организованными в виде вертушки (pinwheel). Нижняя часть каждой центриоли выглядит пустой, за исключением "cartwheel" (колесо со спицами) структуры на одном конце.
Микротрубочки центриолей относительно стабильны. a,b тубулиновые гетеродимеры, присутствующие центриолярных триплетах микротрубочек, модифицированы с помощью polyglutamylation. Организмы, которые содержат центриоли, имеют дополнительны тубулины, обозначаемые d, e, z & h, это указывает на то, что они играют определенную роль в структуре или сборке центриролей. Идентифицированы и др. белки центриолей. |
 |
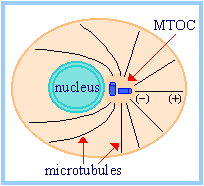
| Ценросома это масса белка, наз. также microtubule organizing center (MTOC), которая окружает центриоли в клетках животных. Белки центросом включают pericentrin и g-tubulin.
MTOC (центросома) обычно располагается вблизи ядра во время интерфазы. Микротрубочки растут из MTOC, формируя образование типа втулки и спиц (hub and spoke), даже во время интерфазы. С их минус концов, закрепленных в центросоме, микротрубочки растут и уменьшаются в основном за счет добавления и потери тубулиновых гетеродимеров на их плюс концах. |
 |
| Во время клеточного деления, дуплицированная центросома помогает организовать митотическое веретено. | 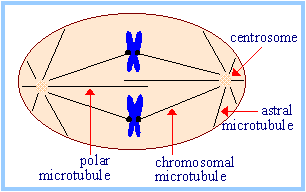 |
| Центросомный материал играет существенную роль в образовании основы (nucleating formation) ресничек и флагелл. Цилиарная аксонема (axoneme) растет из одного цилиндра центриоли, называемого базальным тельцем (basal body). | 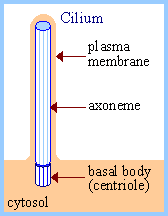 |
|
g-Tubulin, который являпется гомологом a и b тубулинов, служит основой(nucleates) для сборки микротрубочек внутри центросомы. Несколько (12-14) копий g-tubulin ассоциируют в комплекс с др. белками, называемыми "grips" (gamma ring proteins). Этот g-тубулиновый кольцевой комплекс , видимый с помощью электронногго микроскопа, имеет открытую кольце-образную структуру, напоминающую lock washer, покрыт шапочкой (capped) с одной стороны. Микротрубочки, nucleated с помощью g-тубулинового кольцевого комплекса, выглядят как покрытые шапочкой (capped) с одного конца, предположительно минус конеца. В микротрубочках, capped с помощью g-тубулинового кольцевого комплекса, полимеризация на минус концах ингибирована. Grip белки шапочки (cap) м.б. вовлечены в обеспечение связи с центросомой. Микрографы показывают покрытие шапочкой (capping) микротрубочек с помощью g-тубулинового кольцевого комплекса на micrographs и диаграммах кольцевого комплекса, представленных M. Moritz на: |
 |
| Микротрубочки обнаруживают динамическую нестабильность. Они м. расти постоянно, а затем быстро уменьшиться с плюс конца. (График справа отображает, но не дает действительного описания.) | 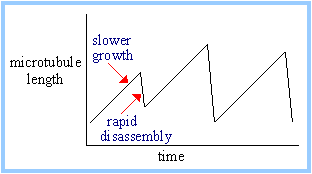 |
In vitro, тенденция расти или уменьшаться м.б. функцией концентрации тубулинов. Когда микротрубочки растут, то тубулиновые димеры изымаются. Ниже критической концентрации тубулиновых димеров микротрубочки укорачиваются. Такая нестабильность обусловливается потерей "GTP cap." Гидролиз ГТФ с помощью b-тубулина происходит как только добавленная субъединица приходит в контакт с a-тубулином. Быстрый рост микротрубочки м. вести к накоплению небольшого числа слоев tubulin-GTP на плюс конце.
| A GTP шапочка стабилизирует плюс конец микротрубочки. Если концентрация тубулиновых гетеродимеров низка, то диссоциация tubulin-GTP м. экспозировать tubulin-GDP на плюс конце, приводя к тому. что конец становится нестабильным. В результате происходит быстрое укорочение.
Изнашивание или искривление протофиламент обнаруживается на концах быстро распадающихся микротрубочек. Это м.б. обусловлено изменением конформации, если b-субъединицы гетеродимеров на плюс конце имеют связанный ГДФ вместо ГТФ. Тубулиновые гетеродимеры с присоединенным ГДФ к bсубъединице образуют кольцеобразные ансамбли in vitro. Прямые протофиламенты образуются только тогда, когда оба тубулина связаны с ГТФ. |
 |
Динамическая нестабильность
микротрубочек in vivo м. регулироваться путем взаимодействия с др. белками на плюс конце. Напр., во время профазы митоза микротрубочки вырастают из центросом. Если плюс конец микротрубочки контактирует с хромосомой, то он стабилизируется. В противном случае следует быстрая разборка на плюс конце и тубулиновые димеры используются для роста др. микротрубочек.В микротрубочках идентифицированы разрывающие и дестабилизирующие белки. Некоторые родственны моторным белкам из семейства кинезинов. Некоторые дестабилизирующие белки способствуют катострофе, разрывая микротрубоски, генерируя новые концы, которые не содержат ГТФ шапочки.Др. связываются с плюс концами микротрубочек и способствуют гидролизу ГТФ, устраняя стабилизирующу ГТФ шапочку.
MAPs (microtubule-associated proteins) являются иным классом белков, которые связаны с микротрубочками.
- Многие MAPs стабилизируют микротрубочки, ингибируя деполимеризацию.
- Они могут поперечно связывать соседние микротрубочки, предопределяя пространственное расположение микротрубочек в виде параллельных рядов. Некоторые связывают микротрубочки с мембранами или промежуточными филаментами.
Типа II MAPs (напр., MAP4 & Tau) обнаруживаются в аксонах, дендритах & не-нейральных клетках. Они имеют 3-4 повтора из последовательностей в 18 остатков, которые связывают тубулин.
От ростового фактора сигнальные каскады активируют киназы, которые катализируют phosphorylation тубулин-связывающих доменов MAPs. Фосфорилирование MAPs вызывает их отсоединение от микротрубочек.
Протеин фосфатазы , которые удаляют остатки фосфатов их MAPs, также регулируются.
В начале митоза фосфорилирование MAPs возрастает, в результате увеличивается нестабильность микротрубочек и микротрубочки начинают расспадаться (disassemble), а тубулиновые димеры формируют митотическое веретено. Активность протеин фосфатаз преобладет в конце митоза в результате снова воссаздаются интерфазные наборы микротрубочек.
Некоторые токсины и лекарства (ингибирующие митоз) затрагивают полимеризацию или деполимеризацию тубулинов.
- Taxol, противоопухолевое лекарство, стабилизирует микротрубочки.
- Colchicine связывается с тубулином и блокирует полимеризацию. Микротрубочки деполимеризуются при высоких концентрациях колхицина.
- Vinblastine обусловливает деполимеризацию и образование vinblastine-tubulin паракристаллов.
- Nocodazole вызывает деполимеризацию микротрубочек.
|
|