DIVERSE CELLULAR AND MOLECULAR MECHANISMS CONTRIBUTE TO EPITHELIAL PLASTICITY AND METASTASIS Nature Reviews Molecular Cell Biology 4, No 8, 657 -665 (2003); doi:10.1038/nrm1175 | |
 Рис.1. | Diversity of epithelial phenotypes.  Рис.2. | | Multiparameter analysis of epithelial-plasticity phenotypes in 3D collagen gel cultures.  Рис.3. | Different Ras downstream signalling pathways contribute to distinct tumour phenotypes in vivo  Рис.4. | Signalling networks regulating carcinoma progression.  Box 1. | Normal and pathological epithelial-plasticity phenotypes  Box 2. | Epithelial plasticity: cell culture systems, assay methods and cell pairs used  Box 3. | Cooperation of TGF- receptors with RTKs: diverse mechanisms
| LinksDATABASESLocus Link: α5 integrin | β4 integrin | BMPs | FGF | H-Ras | MAPK | MEK | PDGF | PI3K | Rac | Ras | Rho | Smads | TGF-β Swiss-Prot: Bcl2 | E-cadherin | EGF | ErbB2 | HGF | Lef1 | N-cadherin | PKB | Raf1 | Smad2 | Smad4 | Smad6 | Smad7 | TNF-α | transforming growth factor α | vimentin | ZO-1 |
| |
|
Seeding and Propagation of Untransformed Mouse Mammary Cells in the Lung Katrina Podsypanina, Yi-Chieh Nancy Du, Martin Jechlinger, Levi J. Beverly, Dolores Hambardzumyan, Harold Varmus SCIENCE VOL 321 26 SEPTEMBER 2008, P. 1841 The acquisition of metastatic ability by tumor cells is considered a late event in the evolution of malignant tumors. We report that untransformed mouse mammary cells that have been engineered to express the inducible oncogenic transgenes MYC and KrasD12, or polyoma middle T, and introduced into the systemic circulation of a mouse can bypass transformation at the primary site and develop into metastatic pulmonary lesions upon immediate or delayed oncogene induction. Therefore, previously untransformed mammary cells may establish residence in the lung once they have entered the bloodstream and may assume malignant growth upon oncogene activation. Mammary cells lacking oncogenic transgenes displayed a similar capacity for long-term residence in the lungs but did not form ectopic tumors. |
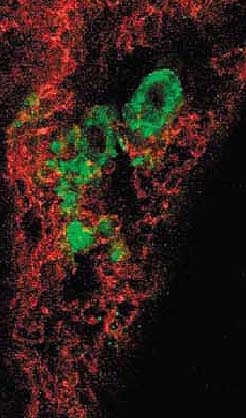 Большинство смертей при раковых опухолях у людей обусловлено метастазами, с помощью которых раковые клетки распространяются от первичной опухоли в новые места тела. Т.к. метастатические клетки д. успешно реализовать серию сложных ступеней, включая выживание в кровтоке и закрепление в окружении чужой ткани, то метастазы рассматривались как позднее событие в прогрессе раковых опухолей. Однако авт. показали, что метастатический процесс может начинаться раньше, чем об этом полагали ранее. Обычные мышиные клетки молочных желез были генетически изменены, чтобы сделать возможным экспериментальный контроль времени экспрессии онкогена, и инъецировлаи их в кровоток мышей. Неожиданно, в отсутствие экспрессии онкогена нормальные клетки молочных желез оказалисть способными путешествовать в и выживать в легких вплоть до 16 недель, хотя в них не был инициирован агрессивный рост вплоть до начала активации онкогена. Т.о., метастазы ммогут возникать в результате рассеивания нормальных (premalignant) клеток, которые остаются клинически молчащими вплоть до генетических изменений, вызывающих в них злокачественность.
Большинство смертей при раковых опухолях у людей обусловлено метастазами, с помощью которых раковые клетки распространяются от первичной опухоли в новые места тела. Т.к. метастатические клетки д. успешно реализовать серию сложных ступеней, включая выживание в кровтоке и закрепление в окружении чужой ткани, то метастазы рассматривались как позднее событие в прогрессе раковых опухолей. Однако авт. показали, что метастатический процесс может начинаться раньше, чем об этом полагали ранее. Обычные мышиные клетки молочных желез были генетически изменены, чтобы сделать возможным экспериментальный контроль времени экспрессии онкогена, и инъецировлаи их в кровоток мышей. Неожиданно, в отсутствие экспрессии онкогена нормальные клетки молочных желез оказалисть способными путешествовать в и выживать в легких вплоть до 16 недель, хотя в них не был инициирован агрессивный рост вплоть до начала активации онкогена. Т.о., метастазы ммогут возникать в результате рассеивания нормальных (premalignant) клеток, которые остаются клинически молчащими вплоть до генетических изменений, вызывающих в них злокачественность. 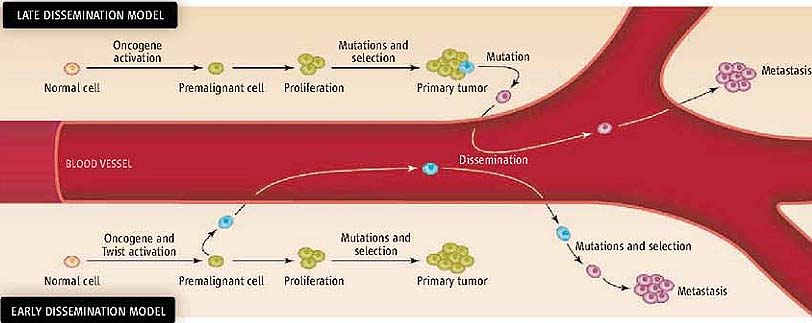
| |
| Giampieri, S. et al. Localized and reversible TGFbeta signalling switches breast cancer cells from cohesive to single cell motility. Nature Cell Biology. 11, 1287–1296 (2009) Article |
 In vivo image of mammary carcinoma cells showing cancer cells in green, the lymphatic vessel in red and collagen in blue. Image courtesy of E. Sahai, Cancer Research UK London Research Institute, London, UK.
In vivo image of mammary carcinoma cells showing cancer cells in green, the lymphatic vessel in red and collagen in blue. Image courtesy of E. Sahai, Cancer Research UK London Research Institute, London, UK.