Cardiac Neural Crest in Zebra fish Embryos
Contributes to Myocardial Cell Lineage and Early
Heart Function DEVELOPMENTAL DYNAMICS 226:540 –550,2003 | |
|
Myocardial dysfunction is evident within hours after ablation of the cardiac neural crest in chick embryos,suggesting
a role for neural crest in myocardial maturation that is separate from its role in out .ow septation.This role could be
conserved in an animal that does not have a divided systemic and pulmonary circulation,such as zebra .sh.To test
this hypothesis,we used cell marking to identify the axial level of neural crest that migrates to the heart in zebra .sh
embryos.Unlike the chick and mouse,the zebra .sh cardiac neural crest does not originate from the axial level of the
somites.The region of neural crest cranial to somite 1 was found to contribute cells to the heart.Cells from the
cardiac neural crest migrated to the myocardial wall of the heart tube,where some of them expressed a myocardial
phenotype.Laser ablation of the cardiac premigratory neural crest at the three-to four-somite stage resulted in loss
of the neural crest cells migrating to the heart as shown by the absence of AP2-and HNK1-expressing cells and failure
of the heart tube to undergo looping.Myocardial function was assessed 24 hr after the cardiac neural crest ablation
in a subpopulation of embryos with normal heart rate.Decreased stroke volume,ejection fraction,and cardiac output
were observed,indicating a more severe functional de .cit in cardiac neural crest-ablated zebra .sh embryos
compared with neural crest .ablated chick embryos.These results suggest a new role for cardiac neural crest cells
in vertebrate cardiac development and are the .rst report of a myocardial cell lineage for neural crest derivatives.
|
У эмбрионов кур удаление кардиальноого нейрального гребня вызыывает определенный паттерн уродств и миокардиальной дисфункции (Kirby and Creazzo,1995). Уродтсва включают персистенцию truncus arteriosus и аномальное преобразование паттерна билатерально симметричных артерий аортальной дуги в крупные артерии (Bockman et al.,1987,1989). Самыми ранними указаниями на аномальное развитие являются первичные нарушения миокардиальной функции, которые обнаруживаются самое раннее на ст. 14. Это происходит задолго до того, когда клетки кардиального нейрального гребня вступят в какой-либо контакт с миокардом у интактного эмбриона (Waldo et al.,1996,1998). Самыми ранними аномалиями кардиальной функции являются (1)снижение фракции ejection, (2) уменьшение тока кальция и (3) аномальное купирование excitation-contraction (Leatherbury et al., 1991;Creazzo,1990;Creazzo et al., 1997). Такой же дефицит миокардиальной функции наблюдается у эмбрионов мыши с нарушением миграции нейрального гребня (Conway et al.,1997). Во время этого периода при нормальном развитии клетки нейрального гребня заполняют каудальные глоточные (pharyngeal) дуги и взаимодействуют с эндотелиальными клетками артерий аортальной дуги, энтодермальными и эктодермальными клетками вентральной части глотки (Waldo et al.,1996). Почти спустя 48 ч клетки нейрального гребня мигрируют в тракт оттока (Waldo et al.,1998,1999).
Недавние исследованияя на эмбрионах кур показали, что миокардиальная дисфункия, вызываемая отсутствием кардиального нейрального гребня, м.б. вызывана воздействием на миокард FGF8 блокирующих антител (Farrell et al.,2001). FGF8 экспрессируется в вентро-латеральной части глотки как энтодермальными, так и эктодермальными клетками, которые первыми контактируют с клетками кардиального нейрального гребня, мигрирующими в каудальные фарингеальные дуги (Waldo et al.,1996). Т.к. дисфункция миокарда происходит задолго до миграции клеток кардиального нейрального гребня в тракт оттока, где они участвуют с разделении тракта оттока, то это полностью независимо от события подразделения. Если это так, то клетки нейрального гребня участвуют в созревании миокарда, и это законсервировано у широкого круга видов позвоночных, включая и те у которых подразделяется слабо или совсем не подразделеяется тракт оттока.
Gs,rb данио имеют полностью неподразделенный тракт оттока. Морфологически и физиологически сердечно-сосудистое развитие у рыбок данио сходно с таковым у млекопитающих и птиц (Fishman and Chien, 1997; Hu et al.,2000). Сегментные серии бранхиальных дуг формируются за счет миграции нейрального гребня и параксиальной мезодермы во время первых 72 ч. после оплодотворения (hpf;Schilling and Kimmel,1994;Kimmel et al., 1995). Мечение премиграторных клеток нейрального гребня на уровне бранхиальных дуг дает в результате клональное потомство, которое поступает в отдельные бранхиальные сегменты и, в целом, отдельные клеточные типы (Schilling and Kimmel,1994), это указывает на то, что предшественники дуг м.б. специфицированы в отношении своей судьбы еще до образования дуг. Краниальные дуги склоняются к развитию структур, родственных челюстям, тогда как каудальные дуги поддерживают развитие артерий аортальной дуги, которые будут ремоделированы в жаберные артерии (Goodrich,1958). В 48 hpf, сердце рыбок данио состоит из гладкостенной трубки, разделенной на 4 сегмента, выявляемых по наружным сужениям между сегментами. Миокард толщиной в одну клетку за исключением желудочка, который имеет 2-3 слоя клеток (Hu et al., 2000).
Т.к. кардиальный нейральный гребень не был описан для эмбрионов рыбок данио, то авт. попытались определить популяцию клеток кардиального нейрального гребня, которая мигрирует в сердце и картировать их происхождение. Было установлено, что у рыбок кардиальный нейральный гребень происходит из более ростального уровня, чем кардиальный нейральный гребень у эмбрионов кур и мышей. Клетки кардиального нейрального гребня, которые мигрируют в сердце, обнаруживаются в стенке миокарда и некоторые из них экспрессируют тяжелую цепь миозина, указывая тем самым, что они являются адаптированным клоном кардиомиоцитов. Устранение премиграторных клеток кардиального нейрального гребня с помощью лазера устраняет миграцию клеток нейрального гребня в сердце. В отсутствие кардиального нейрального гребня кардиогенез у рыбок данио изменяется морфологически и функционально, так что значительная часть эмбрионов не способна к образованию сердечной петли и все параметры функции желудочков депрессированы в популяции эмбрионов с нормальными сердцебиениями (heart rate).
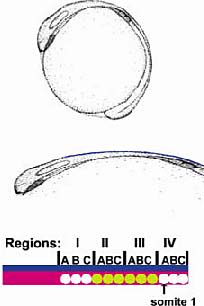 Fig.1.Diagrammatic representation of the regions of neural crest that were traced to find the axial origin of the cardiac neural crest.The top panel shows a stylized zebra fish embryo as it develops on the yolk at 10.5 - 11 hours postfertilization.The developing eye is located in the cranial end of the embryo (to the left).In the middle panel, the embryo has been removed from the yolk and flattened. Premigratory neural crest is shown by the blue line. Three somites can be seen.In the bottom panel, the neural crest has been divided into four regions that are each the length of three somites.Region IV actually encompasses somites 1 .3.Thecardiac neural crest,indicated by yellow circles,was found to arise primarily from regions II and III. Fig.1.Diagrammatic representation of the regions of neural crest that were traced to find the axial origin of the cardiac neural crest.The top panel shows a stylized zebra fish embryo as it develops on the yolk at 10.5 - 11 hours postfertilization.The developing eye is located in the cranial end of the embryo (to the left).In the middle panel, the embryo has been removed from the yolk and flattened. Premigratory neural crest is shown by the blue line. Three somites can be seen.In the bottom panel, the neural crest has been divided into four regions that are each the length of three somites.Region IV actually encompasses somites 1 .3.Thecardiac neural crest,indicated by yellow circles,was found to arise primarily from regions II and III.
DISCUSSION Полученные результаты выявили некоторые неожиданные различия. У рыбок данио клетки происходят из более рострального аксиального уровня, т.е. выше первого сомита, по сравнению с эмбрионами кур и мышей (Kirby et al.,1983; Fukiishi and Morriss-Kay,1992). У эмбрионов рыб клетки кардиального нерального гребня мигрируют в и перемешиваются с миокардом, адоптируя характеристики миокардиальных клеток. В отличие от эмбрионов кур и мышей клетки кардиального нейрального гребня в тракте оттока являются или мезенхимными или или направляются в кардиальные подушки или формируют парасимпатические кардиальные ганглии (Waldo et al.,1998,
1999;Kirby and Stewart,1983). У рыбок данио существенный вклад в миокардиальные клетки сердца со стороны клеток кардиального нейрального гребня м. объяснить, почему функция желудочка нарушена сильнее после устранния нейрального гребня, чем у кур, у которых клетки кардиального нейрального гребня не вносят вклада в миокард (Leatherbury et al.,1990; Tomita et al.,1991). Отсутствие парасимпатической иннервации такж м. влиять на heart rate; однако, т.к. парасимпатическая стимуляция вызывает негативную chronotropic реакцию у большинства изученных позвоночных, то следует ожидать усиления сердцебиений при ее отсутствии. Т.к. мало известно функциональной и морфологической иннервации сердца рыб, то остается альтернатива.
У птиц и млекопитающих клетки, происходящие из кардиального нейрального гребня, дают мезенхимные клдетки, необходимые для разделения тракта оттока (Kirby et al.,1983). Рыбки данио не имеют подразделения на системное и легочное кровообращение; поэтому клетки кардиального нейрального гребня не нужны для подразделения тракта оттока. У эмбрионов кур клетки кардиального нейрального гребня участвуют также в созревании миокарда путем регуляции доступности факторов роста в фарингеальной области (Farrell et al.,2001). В отсутствие кардиального нейрального гребня вентрикулярная функция депрессирована задолго до того, как клетки нейрального гребня проникнут в сердце (Leatherbury et al.,1990; Tomita et al.,1991). Первичный функциональный дефицит уменьшает ejection фракцию. Однако, миокард обнаружи вает также уменьшение calcium transients и L-type calcium current (Farrell et al.,2001;Creazzo et
al.,1998). Т.к. эти изменения обусловлены изменениями в передаче сигналов в глотке, то изменения миокардиальной функции скорее всего косвенный эффект. Напротив, устранение кардиального гребня у рыбок данио изменяет состав миокардиальной стенки, снижая количество доступных кардиомиоцитов. Имеется несколько отличий в аномалиях вентрикулярной функции между эмбрионорами кур и рыб, у рыбок данио обнаруживаются более тяжелые нарушения. После удаления нейрального гребня у рыбок данио и stroke объём и кардиальная производительность депрессированы в дополнение к снижению фракции ejection. У эмбрионов кур с удаленным нейральным гребнем ни stroke объем, ни кардиальная производительность не снижены, т.к. сердце компенсирует из счет растяжения желудочков (Leatherbury et al.,1990; Tomita et al.,1991). Удаление кардиального нейрального гребня у эмбрионов рыб м. уменьшать количество кардиомиоцитов, пригодных для компенсации с помощью растяжения желудочка. Возможно, что бедность кардиомиоцитов в этом случае ведет к неспособности сердца заканчивать нормально процесс образования сердченой петли. Разумно предположить, что популяция миоцитов необходима для петлеобразования, особенно когда миокардиальная стенка представлена слоем в одну две клетки толщиной, когда начинается образование петли (Kousik et al.,2001). Авт. наблюдали депрессию heart rates у эмбрионов, которые неспособны к петлеобразованию сердца. Функциональные измерения на 48 hpf, когда сердце представлено гладкостенной трубкой, разделенной на 4 сегмента. Миокард толщиной в одну клетку за исключением желудочка, который состоит из слоя в 2-3 клетки толщиной (Hu et al.,2000). На 4 неделе после оплодотворения тракт оттока, который первоначально invested в миокард, обнаруживает гладкомышечную стенку (Hu et al.,2000). Перезод миокарда в гладкую мышцу в тракте оттока происходит в результате обратного давления, производимого высокой резистентностью в жабрах. Тракт оттока затем функционирует как вспомагательный насос для желудочка, чтобы поддерживать на стабильном уровне кровоток в жабрах (Icardo et al.,1999a,b). Интересно, что клетки кардиального нейрального гребня у эмбрионов кур создают кладкие мышцы в tunica media крупных артерий; однако, они, по-видимому, адоптируют признаки клона фибробластных клеток в перегородке тракте оттока (Waldo et al.,1998).
Кардиальный тракт оттока является сложной структурой, которая у птиц и млекопитающих делит системное и легочное кровообращение, он зависит от внеклеточной мезенхимы, обеспечиваемой кардиальным нейральным гребнем. Эта часть сердца,т.е.., conotruncus, особенно склонна к врожденным уродствам у человека. Понимание роли и эволюционной истории клеток кардиального нерального гребня у позвоночных с наразделенным трактом оттока проливает новый свет на комплекс взаимодействий различных типов клеток , участвующих в подразделении тракта оттока. Дисфункции сердца, ассоциированные с аномальным развитием ведут к высокой частоте пренатальной летальности и часто к нарушениям, угрожающим жизни новорожденных.
Целиком оригинал данной статьи в формате *.pdf находтся |