Nociceptors and Neurons
Болевые Ощущения

(Рис.1.) | Dual color IHC (HLA-DR peroxidase/CD8 FITC) viewed in dark field visible light (A), incident fluorescence (B) and dark field fluorescence (C)
Типы болевых волокон
Ad - carries: ®
C - carries: ®
Referred pain
- боль от внутренних органов, которая часто ощущается в ином месте. Напр., синусная боль воспринимается как зубная; сердечная в руке; диафрагмальная в плечем.б. обусловлена нейронами, конвергирующими в один и тот же 2° neuron
dermatome rule =
Modulation of Painэндогенные аналгезирующие нейротрансмиттеры:
высвобождаются нисходящими волокнами, чтобы блокировать высвобождение Substance P афферентными волокнами в пресинаптических окончаниях
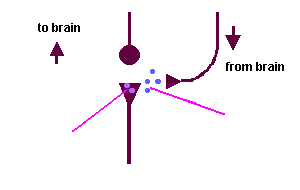
Gate theory of PainБоль модулируется с помощью (неболевых) рецепторов - напр., rubbing, itching
tonically активными промежуточными нейронами, обычно ингибируемыми восходящими в спинной мозг волокнами
болевыми стимулами, C волокна блокируют ингибирование
Типа A (неболевые) волокна также образуют синапсы с этими промежуточными нейронами, чтобы усилить ингибирование
Sung Eun Kim, Bertrand Coste, Abhishek Chadha, Boaz Cook & Ardem Patapoutian
The role of Drosophila Piezo in mechanical nociception
Nature 483, 209–212 (08 March 2012) doi:10.1038/nature10801
Трансдукция механических стимулов с помощью рецепторных клеток важна для таких чувств как, слух, касание и боль1-4. Инные каналы выполняют роль в нейрональной механотрансдукции у беспозвоночных1; однако функциональной консервации этих ионных каналов в механотрансдукции млекопитающих не наблюдается. Напр., no mechanoreceptor potential C (NOMPC), член семейства transient receptor potential (TRP) ионных каналов, действует как механотрансдуктор у Drosophila melanogaster5 и Caenorhabditis elegans6, 7; однако он не имеет ортологов у млекопитающих. Члены семейства Degenerin/epithelial sodium channel (DEG/ENaC) являются механотрансдукторами у C. elegans8 и потенциально у D. melanogaster9; однако прямая роль его гомолога у млекопитающих в восприятии механических сил не выявлена. Недавно, Piezo1 (также известный как Fam38a) и Piezo2 (также известный как Fam38b) были идентифицированы как компоненты механически активируемых каналов у млекопитающих10. Семейство Piezo эволюционно законсервировано как трансмембранные белки. Неизвестно функционируют ли они в восприятии механических стимулов in vivo и если так, то какие механосенсорные способы воздействия они обеспечивают. Изучали физиологическую роль единственного члена Piezo у D. melanogaster (Dmpiezo; также известен как CG8486). Экспрессия Dmpiezo в клетках человека вызывает механически активируемые токи, подобно его аналогу млекопитающих11. Поведенческие реакции на вредные механические стимулы были сильно снижены у нокаутных по Dmpiezo личинок, тогда как реакции на др. вредные стимулы или прикосновения не были изменены. Нокдаун Dmpiezo в сенсорных нейронах, которые обеспечивают болевые ощущения и экспрессируют DEG/ENaC ионный канал pickpocket (ppk), оказался достаточным, чтобы нарушить реакцию на вредные механические стимулы. Более того, экспрессия Dmpiezo в тех же самых нейронах устраняет фенотип конституитивного нокаута Dmpiezo личинок. Соотв., электрофизиологические записи с ppk-позитивных нейронов выявили Dmpiezo-зависимый, механически активируемый ток. Наконец, мы установили, что Dmpiezo и ppk действуют в параллельных путях в ppk-позитивных клетках и что механическое восприятие боли устраняется в отсутствие обоих каналов. Эти данные демонстрируют физиологическое знчение семейства Piezo в механотрансдукции in vivo, подтверждая роль белков Piezo в механосенсорной ноцицепции.
Рисунки к статье

(Рис.1.) | Dual color IHC (HLA-DR peroxidase/CD8 FITC) viewed in dark field visible light (A), incident fluorescence (B) and dark field fluorescence (C)
Типы болевых волокон
Ad - carries: ®
C - carries: ®
Referred pain
- боль от внутренних органов, которая часто ощущается в ином месте. Напр., синусная боль воспринимается как зубная; сердечная в руке; диафрагмальная в плече
(больше нервных волокон на периферии, чем в латеральном spinothalamic тракте)
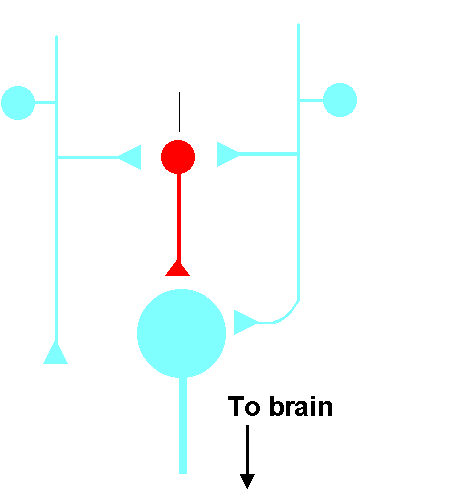
Modulation of Pain

Gate theory of Pain

Sung Eun Kim, Bertrand Coste, Abhishek Chadha, Boaz Cook & Ardem Patapoutian
The role of Drosophila Piezo in mechanical nociception
Nature 483, 209–212 (08 March 2012) doi:10.1038/nature10801
Трансдукция механических стимулов с помощью рецепторных клеток важна для таких чувств как, слух, касание и боль1-4. Инные каналы выполняют роль в нейрональной механотрансдукции у беспозвоночных1; однако функциональной консервации этих ионных каналов в механотрансдукции млекопитающих не наблюдается. Напр., no mechanoreceptor potential C (NOMPC), член семейства transient receptor potential (TRP) ионных каналов, действует как механотрансдуктор у Drosophila melanogaster5 и Caenorhabditis elegans6, 7; однако он не имеет ортологов у млекопитающих. Члены семейства Degenerin/epithelial sodium channel (DEG/ENaC) являются механотрансдукторами у C. elegans8 и потенциально у D. melanogaster9; однако прямая роль его гомолога у млекопитающих в восприятии механических сил не выявлена. Недавно, Piezo1 (также известный как Fam38a) и Piezo2 (также известный как Fam38b) были идентифицированы как компоненты механически активируемых каналов у млекопитающих10. Семейство Piezo эволюционно законсервировано как трансмембранные белки. Неизвестно функционируют ли они в восприятии механических стимулов in vivo и если так, то какие механосенсорные способы воздействия они обеспечивают. Изучали физиологическую роль единственного члена Piezo у D. melanogaster (Dmpiezo; также известен как CG8486). Экспрессия Dmpiezo в клетках человека вызывает механически активируемые токи, подобно его аналогу млекопитающих11. Поведенческие реакции на вредные механические стимулы были сильно снижены у нокаутных по Dmpiezo личинок, тогда как реакции на др. вредные стимулы или прикосновения не были изменены. Нокдаун Dmpiezo в сенсорных нейронах, которые обеспечивают болевые ощущения и экспрессируют DEG/ENaC ионный канал pickpocket (ppk), оказался достаточным, чтобы нарушить реакцию на вредные механические стимулы. Более того, экспрессия Dmpiezo в тех же самых нейронах устраняет фенотип конституитивного нокаута Dmpiezo личинок. Соотв., электрофизиологические записи с ppk-позитивных нейронов выявили Dmpiezo-зависимый, механически активируемый ток. Наконец, мы установили, что Dmpiezo и ppk действуют в параллельных путях в ppk-позитивных клетках и что механическое восприятие боли устраняется в отсутствие обоих каналов. Эти данные демонстрируют физиологическое знчение семейства Piezo в механотрансдукции in vivo, подтверждая роль белков Piezo в механосенсорной ноцицепции.
Рисунки к статье
Nociceptors and Pain
Исследуя нервную систему ученые открыли небольшие нервные окончания в коже и др. тканях, которые отвечают только на сильные стимулы, такие как щипки. Когда nociceptors активированы, то они передают сигналы в головной мозг, и они ощущаются как боль.
Исследуя нервную систему ученые открыли небольшие нервные окончания в коже и др. тканях, которые отвечают только на сильные стимулы, такие как щипки. Когда nociceptors активированы, то они передают сигналы в головной мозг, и они ощущаются как боль.
Что же является основой болевого ощущения?
Недавние исследования:
- показали, что боль является результатом активации специфических рецепторов на стимулы, повреждающие ткани.
- Выявлены специальные пути и химические вещества, обусловливающие болевые ощущения.
- Открыты пути, вызывающие острую и длительно сохраняющуюся боль.
Древние греки полагали, что боль это эмоция. Однако, позднее исследователи наблюдали, что боль м. появляться отдельно от др. ощущений и решили, что это д.б. ощущением.
Т.к. ощущения, такие как обоняние и зрение имеют уникальные чувствительные органы, то исследователи начали поиск чувствительных органов, отвечающих за боль. Они связали боль со стимулами, достаточно сильными, чтобы быть пагубными ( noxious), или вредными и предположили, что тело должно содержать уникальные рецепторы, сигнализирующие о боли. Ученые начали называть их ноцицепторами (nociceptors, noci является формой слова noxious).
В 1960s, исследователи описали нервные волокна вне головного и спинного мозга, которые отвечают и передают сигналы в головной мозг только в ответ на сильное раздражение. Было показано, что это nociceptors.
В отличие от большинства др. рецепторов, nociceptors становятся все более и более чувствительными при продолжении или повторении раздражения. Когда ткань оказывается поврежденной или воспаленной, то она высвобождает химические вещества, называемые prostaglandins и leukotrienes, которые делают nociceptors значительно более чувствительными. Сенсибилизированные nociceptors реагируют даже на довольно мягкие стимулы, такие как лёгкий ветерок или ласки, болью. Аспирин и сходные с ним лекарства взаимодействуют с продукцией простагландинов и м. снижать сенсибилизацию.
Некоторые исследователи полагают, что повреждения нервов м. менять путь ноцицепторов в ответ на нормальные уровни норадреналина, важного химического вещества, используемого нервными клетками или нейронами для коммуникаций. Эти изменения делают ноцицепторы более чувствительными после повреждения и м. приводить к некоторым типам хронической боли. Это м. привести к новым способам лечения определенных синдромальных хронических болей.
Определены химические вещества, которые затрагивают передачу и регуляцию сигналов от ноцицепторов в головной и спинной мозг. Так, capsacin, выявленный в перце, м. редуцировать боль путем стимулирования нервов, которые обеспечивают поступление substance P -- др. хим. в-ва, которое обычно усиливают передачу болевых сигналов. Опиоиды, которые включают морфин и природные субстанции в теле, такие как endorphins, блокируют передачу некоторых болевых сигналов с помощью спинальных нейронов и соединений, которые несут сигналы от головного мозга обратно в спинной мозг.
Изучение боли сейчас фокусируется на генах и молекулах, активных в поврежденных и воспаленных тканях. Агенты, которые блокируют действие leuktrienes и сходных хим. веществ используются в предварительных тестах на человеке.
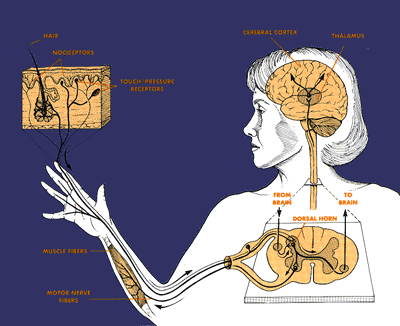 Когда специальные тонкие нервные волокна, наз. nociceptors, в коже и др. тканях тела стимулируются, то они передают сообщения в спинной и головной мозг, где болевые сигналы обрабытываются(processed). Более толстый тип волокон передает информацию о прикосновении и давлении и м. вызывать движение. Nociceptors обычно отвечают только в ответ на сильные стимулы, но в поврежденной и воспаленной ткани м. продуцироваться химические вещества, которые усиливают их чувствительность и обеспечивают передачу болевых сигналов в ответ даже на слабые стимулы. Когда специальные тонкие нервные волокна, наз. nociceptors, в коже и др. тканях тела стимулируются, то они передают сообщения в спинной и головной мозг, где болевые сигналы обрабытываются(processed). Более толстый тип волокон передает информацию о прикосновении и давлении и м. вызывать движение. Nociceptors обычно отвечают только в ответ на сильные стимулы, но в поврежденной и воспаленной ткани м. продуцироваться химические вещества, которые усиливают их чувствительность и обеспечивают передачу болевых сигналов в ответ даже на слабые стимулы.
Увеличить иллюстрацию. (70k) |
| Illustration by Lydia Kibiuk, Copyright © 1995 Lydia Kibiuk. |
| |
| S.Rebelo, C.Reguenga, C.Lopes, D.Lima. Prrx11 is Required for the Generation of a Subset of Nociceptive Glutamatergic Superficial Spinal Dorsal Horn Neurons Dev. Dyn. V. 239, P. 1684-94, 2010 |