A road map for those who don't know JAK-STAT
Aaronson D.S, Horvath C.M.
Science 296, Т 5573б Р. 1653-1655 (2002)
Science 296, Т 5573б Р. 1653-1655 (2002)
Путь JAK-STAT передает информацию, воспринимаемую от внеклеточных полипептидных сигналов, посредством трансмембранных рецепторов, непосредственно к промоторам генов-мишеней в ядре. Эволюционно законсервированная от слизистой плесни до человека передача сигналов JAK-STAT, является ранней адаптацией, облегчающей межклеточное общение вместе с мириадом других клеточных сигнальных событий. Эта ко-эволюция обеспечила высоко адаптированный, лиганд-специфичный путь передачи сигалов, контролирующих экспрессию генов. Кроме того JAK-STAT сигнальный путь регулируется с помощью цело ряда внутренних и средовых стимулов, которые могут увеличивать пластичность реакций клеток или тканей
В большинстве случаев, непосредственно отвечающие гены (те, которые подвергаются повышенной транскрипции в отсутствие нового белкового синатеза) контролируются семейством транскрипцию регулирующих сигнальных белков, называемых signal transducer and activator of transcription (STAT). Внутриклеточная передача сигналов является критической для онтогенетической регуляции, контроля роста и гомеостаза у многоклеточных ораганизмов, а путь STAT отсутствует лишь у грибов и растений. У млекопитающих имеется 7 STAT генов (STAT1, STAT2, STAT3,STAT4, STAT5A, STAT5B и STAT6). Существует значительное разнообразие аминокислотных последовательностей STAT и в их ткане-специфическом распределении. STAT белки неактивны как транскрипционные факторы в отсутствие стимуляции специфических рецепторов и локализуются в цитоплазме нестимулированных клеток-мишеней. Они активируются быстро в ответ на купирование лиганда с рцепторами и рекрутируются во внутриклеточный домен рецептора посредством специфичесекого связывания между STAT Src-homology 2 (SH2) доменов и остатками фосфотирозина рецептора. Это SH2-phosphotyrisine взаимодействие высоко специфично и является критическим для определения специфичности рецептором обусловленной активации STAT.
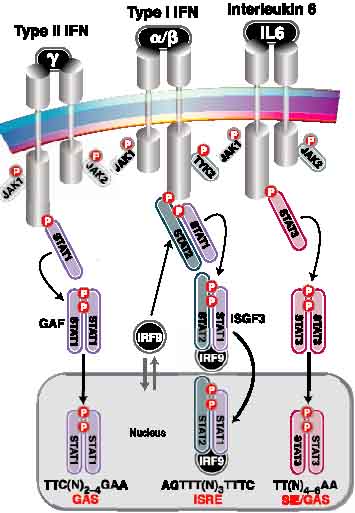 Три примера перадачи сигналов по пути JAK-STAT. Cgtwbabxtcrbt взаимодействия лиганд-рецептор генерируют активные транскрипционные комплексы, состоящие из определенных STAT белков. Слева:связывание типа II IFN (IFNγ) индуцирует фосфорилирование (Р) тирозинов рецепторов с помощью JAK1 и JAK2 белков, создавая сайт для захвата STAT1. STAT1 димеры образуют IFNγ-активированный фактор (GAF), который транслоцируется в ядро и активирует транскрипйцию с промоторов IFNγ генов-мишеней, содержащих GAS элементы. В центре: IFNs типа II(IFNα или IFNβ) стимулируют активность белков JAK1 и TYK2, это ведет к фосфорилированию тирозина в STAT2. STAT2 фосфотирозин является местом-доком для латентного STAT1. Активированный фактор ISGF3 является гетеродимером из STAT1 и STAT2 в ассоциации с IRF9, который только и может вступать в ядро, но держится в цитоплазме благодаря взаимодействию с STAT2. Справа: IL6 активирует JAK1 и JAK2, продуцируя фосфотирозиновое место-док для STAT3. STAT3 димеры транслоцируются в ядро и активируют транскрипцию с промоторов генов-мишеней , содержащих GAS-подобный элемент, иногда обозначаемый как sis-inducible element (SIE). IL6 активирует также и STAT1, это ведет к образованию гомо- и гетеродимеров из STAT1 и STAT3 (не показано).
Три примера перадачи сигналов по пути JAK-STAT. Cgtwbabxtcrbt взаимодействия лиганд-рецептор генерируют активные транскрипционные комплексы, состоящие из определенных STAT белков. Слева:связывание типа II IFN (IFNγ) индуцирует фосфорилирование (Р) тирозинов рецепторов с помощью JAK1 и JAK2 белков, создавая сайт для захвата STAT1. STAT1 димеры образуют IFNγ-активированный фактор (GAF), который транслоцируется в ядро и активирует транскрипйцию с промоторов IFNγ генов-мишеней, содержащих GAS элементы. В центре: IFNs типа II(IFNα или IFNβ) стимулируют активность белков JAK1 и TYK2, это ведет к фосфорилированию тирозина в STAT2. STAT2 фосфотирозин является местом-доком для латентного STAT1. Активированный фактор ISGF3 является гетеродимером из STAT1 и STAT2 в ассоциации с IRF9, который только и может вступать в ядро, но держится в цитоплазме благодаря взаимодействию с STAT2. Справа: IL6 активирует JAK1 и JAK2, продуцируя фосфотирозиновое место-док для STAT3. STAT3 димеры транслоцируются в ядро и активируют транскрипцию с промоторов генов-мишеней , содержащих GAS-подобный элемент, иногда обозначаемый как sis-inducible element (SIE). IL6 активирует также и STAT1, это ведет к образованию гомо- и гетеродимеров из STAT1 и STAT3 (не показано).
 Три примера перадачи сигналов по пути JAK-STAT. Cgtwbabxtcrbt взаимодействия лиганд-рецептор генерируют активные транскрипционные комплексы, состоящие из определенных STAT белков. Слева:связывание типа II IFN (IFNγ) индуцирует фосфорилирование (Р) тирозинов рецепторов с помощью JAK1 и JAK2 белков, создавая сайт для захвата STAT1. STAT1 димеры образуют IFNγ-активированный фактор (GAF), который транслоцируется в ядро и активирует транскрипйцию с промоторов IFNγ генов-мишеней, содержащих GAS элементы. В центре: IFNs типа II(IFNα или IFNβ) стимулируют активность белков JAK1 и TYK2, это ведет к фосфорилированию тирозина в STAT2. STAT2 фосфотирозин является местом-доком для латентного STAT1. Активированный фактор ISGF3 является гетеродимером из STAT1 и STAT2 в ассоциации с IRF9, который только и может вступать в ядро, но держится в цитоплазме благодаря взаимодействию с STAT2. Справа: IL6 активирует JAK1 и JAK2, продуцируя фосфотирозиновое место-док для STAT3. STAT3 димеры транслоцируются в ядро и активируют транскрипцию с промоторов генов-мишеней , содержащих GAS-подобный элемент, иногда обозначаемый как sis-inducible element (SIE). IL6 активирует также и STAT1, это ведет к образованию гомо- и гетеродимеров из STAT1 и STAT3 (не показано).
Три примера перадачи сигналов по пути JAK-STAT. Cgtwbabxtcrbt взаимодействия лиганд-рецептор генерируют активные транскрипционные комплексы, состоящие из определенных STAT белков. Слева:связывание типа II IFN (IFNγ) индуцирует фосфорилирование (Р) тирозинов рецепторов с помощью JAK1 и JAK2 белков, создавая сайт для захвата STAT1. STAT1 димеры образуют IFNγ-активированный фактор (GAF), который транслоцируется в ядро и активирует транскрипйцию с промоторов IFNγ генов-мишеней, содержащих GAS элементы. В центре: IFNs типа II(IFNα или IFNβ) стимулируют активность белков JAK1 и TYK2, это ведет к фосфорилированию тирозина в STAT2. STAT2 фосфотирозин является местом-доком для латентного STAT1. Активированный фактор ISGF3 является гетеродимером из STAT1 и STAT2 в ассоциации с IRF9, который только и может вступать в ядро, но держится в цитоплазме благодаря взаимодействию с STAT2. Справа: IL6 активирует JAK1 и JAK2, продуцируя фосфотирозиновое место-док для STAT3. STAT3 димеры транслоцируются в ядро и активируют транскрипцию с промоторов генов-мишеней , содержащих GAS-подобный элемент, иногда обозначаемый как sis-inducible element (SIE). IL6 активирует также и STAT1, это ведет к образованию гомо- и гетеродимеров из STAT1 и STAT3 (не показано). Многие рецепторы ростовых факторов обладают внутренне присущей тирозинкиназной активностью, но большинство STAT-активирующих цитокиновых рецепторов не обладают ею. Необходимая тирозинкиназаная активность предоставляется с рецепторами ассоциированными цитоплазматическими белками из семейства Janus kinase (JAK). JAKs также эволюционно законсервированы известно 4 JAK белка в клетках млекопитающих, JAK1, JAK2, JAK3 и TYK2. Фундаментальная роль JAKs в передаче сигналов цитокинов выявлена с помощью наследственных иммунодефицитов, вызываемых мутациями, блокирующими взаимодействие рецептор-JAK или киназную активность JAKs. JAKs связываются специфически с внутриклеточными доменами цитокиновых рецепторов сигнальной цепочки и катализируют лигандом индуцированное фосфорилирование самих себя и внутриклетоных тирозиновых остатков на рецепторе, создавая места для докирования STAT. Фосфорилирование STATs по активированным тирозиновым остаткам ведет к STAT гомо- и гетеродимеризации. STAT димеры быстро транспортируются из цитоплазмы в ядро и способны соединяться с ДНК. Большинство STAT димеров распознает в 8-10 п.н. инвертированный повтор элемента ДНК с консенсусными последовательностями 5э-TT(N4-6)AA-3'. Дифференциальное сродство связывания определенного активированного димера STAT к одиночной последовательности ДНК-мишени выявлено с помощью изменчиваости в точных последовательностях нуклеотидов. Этот консенсусный ДНК элемент обычно обозначается как GAS элемент, отражая его инициальную характеристику как γ-interferon activation sequence? распознаваемые STAT1 гомодимером. Сродство STAT-ДНК комплекса к естественному промотору гена-мишени также определено по кооперативным димер-димер взаимодействиям, опосредуемыми с помощью N-терминальных аминокислот.
Будучи активированным STAT димер распознает промотор-мишень в результате скорость транскрипции с этого промотора драматически возрастает. Способность индуцировать транскрипцию генов-мишеней явльяется внутренним свойством STAT димера, отражающим способность его доменов транскрипционной активации рекрутировать ядерные ко-активаторы, которые обеспечивают модификации хроматина и коммуникации со стрежнем промотора. STAT-связывающие элементы необходимы для связывания дополнительных белков, соединяющихся с промотором, они варьируют от гена к гену и необходимы для оптимальной ген-специфической регуляции. Напр., критическими активирующими компонентами STAT являются чувствительный к γ-интерферону регулятор клеточного цикла p21WAF1 и к интерлейкин 6 (IL-6)-чувствительному отвечающем на острую фазу белку α-2 макроглобулину. Эти примеры указывают на большое число STAT-зависимых кооперативных транскрипционных механизмов. Хотя STATs обычно ассоциированы с активацией транскрипции , известны и примеры STAT-зависимой репрессии транскрипции.
Пути передачи сигналов JAK-STAT обычно не функциогнируют автономно, скорее, они регулируются большим кругом внутренних и средовых стимулов. Эти комплексные средства регуляции м. добавлять пластичность в исход транскрипции в специфических клетках и тканях. Различные протеин киназы, включая некоторые МАРК, фосфорилируют STATs по остаткам серинов, делая возможными дополнительные клеточные сигнальные пути для потенциации первичных стимулов, активирующих STATs. Сходным образом, возможно, что дополнительные сайты регулируемого фосфорилирования серинов или др. посттрансляционные модификации м. регулировать ослабление STAT активности.
Негативная регуляция JAK-STAT пути сопровждается такими общими механизмами как интернализация рецепторов в эндоцитотические пузырьки и последующая деградация рецепторов. Более специфические ингибирующие сигналы исходят от протеин тирозин фосфатаз, которые м. действовать на уровне ассоциированных с мембранами рецептор-киназных комплексов, или в ядрах за счет дефосфорилирования активированных STAYT димеров и рециклинга латентных STAT мономеров в цитоплазму. JAKs имеют свои собственные ингибиторы, называемые suppressor of cytokine signaling (SOCS), которые непосредственно связываются с и инактивруют киназы. Экспрессия SOCS генов м.б. стимулирована с помощью тех же самых цитокинов, которые усиливают STAT активацию, так что SOCS белки м. действовать в виде классической петли ингибирующей с помощью обратной связи. Белковые ингибиторы активированных STATs (PIAS) связываются с флсфорилированными STA димерами , препятствуя распознаванию ДНК. Постоянные уровни и индуцированные сигналвами концентрации всех позитивных и негативных регуляторов предопределяют интенсивность и продолжительность ответа на сигналв в определенном типе клеток.
Три примера путей JAK-STAT показаны на Рис. IFNαβ путь механистически отличается от большинства STAT путей. Конечный транскрипционный фактор этого пути не является простым STAT димером, а состоит из STAT1-STAT2 димера и облигаторной ДНК-связывающей субъединицы, члена семейства интерферон регулирующих факторов, IRF9. Ассоциация STATs с IRF9 обеспечивает распознавание определенного чувствительного к ДНК элемента, ШАТ-stimulated response element (ISRE) с последовательностью 5'AGTTTTN3TTTCC-3'. Тримерный фактор ISGF3 (interferon-stimulated gene factor 3) является первичным сигнальным механизмом, ведущим к экспрессии генов-мишеней, необходимых для innate antiviral immunity у высших организмов. Важность STAT1 и STAT2 в установлении защиты передовой линии подчеркивается находкой, что эти белки являются мишенями для virus immune evasion strategies.
Путь типа II IFN (IFNγ) является парадигмой для большинства аспектов JAK-STAT передачи сигналов, который дает димерные STAT транскрипционные факторы. STAT1 гомодимеры распознают GAS элементы в промоторах генов-мишеней, связанных с innate и адаптивным иммунитетом и противоопухолевым иммунным ответом. Мутации в зародышевой линии в STAT1 ведут к нарушению антимикробного иммунитета.
Третий путь связан с регуляцией клеточного роста, воспалением и ранним эмбриональным развитием. STAT3 активируется многими цитокинами, которые используют сигнальную рецепторную субъединицу, сходную с gp130. Активация STAT3 происходит во многих солидных и гематологических опухолях и коррелирует со стимуляцией роста и антиапоптическими эффектами при озлокачествлении. Многие пути, ведут к активации STAT3 помимо цитокинов, включая ростовые факторы, такие как EGF и PDGF, которые используют тирозин киназные рецепторы. Некоторые онкогенные не-рецепторные тирозин киназы м. активировать STAT3, который необходим для их способности малигнизировать клетки в культуре. Кроме того, STAT3 активируется в ответ на гетеромерные субъединицы guanin nucleotide-binding protein (G protein) за счет активирования клеточной не-рецепторной тирозин киназы, c-Src, пример, взаимодействия между функционально и концептуально различающимися сигнальынми путями посредством клточного прото-онкогена.