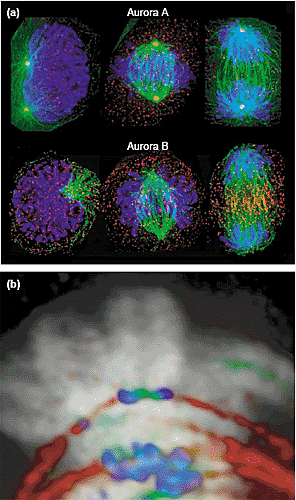
Недавно два исследования на клетках млекопитающих подтвердили, что Aurora B регулирует движения и congression хромосом путём изменения динамики микротрубочек [44,45]. Микроинъекции anti-Aurora-B антител блокировали расположение и сегрегацию хромосом и устраняли spindle-attachment checkpoint [44]. Драматическое увеличение стабильности астральных микротрубочек и снижение плотности микротрубочек веретена были отмечены после инъекции anti-Aurora-B антител; однако осталось неясным, обусловлено ли это потерей функции Aurora B, т.к. не получено доказательств, что антитела действительрно ингибируют активность Aurora B activity, и что это ведет к её делокализации. Однако, в соответствии с этими результатами избыточная экспрессия ‘kinase-dead’
Aurora B K/R мутации в NRK клетках способствует однонаправленному движению центромер и снижению скорости движения хромосом, что приводит к дефектам congression хромосом [45]. Клетки трансфицированные мутацией Aurora B K/R также ведут к удлиннению веретена с хромосомами, образующими кластеры по периферии. В таких клеткках dynein и CENP-E были истощены из кинетохор, а Mad2 не находил болльше кинетохоры. Неясно, играет ли Aurora B структурную, а также каталитическую роль на центромере, т.к. избыточная экспрессиия kinase-dead Aurora B нарушает локализацию эндогенных ферментов. Однако, эти результаты, по крайней мере, концептуально согласуются с теми, что получены на почкующихся дрожжах, подтверждая, что Aurora B комплекс взаимодействует с митотическими молекулами, которые генерируют силы посредством микротрубочек.
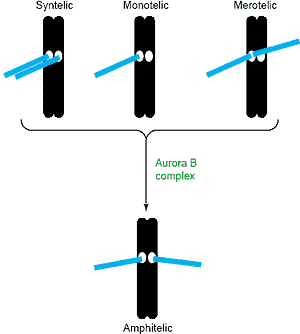
Выявлены эффекты Aurora B комплекса на динамику микротрубочек в клетках млекопитающих [46,47]. Hesperadin, первоначально идентифицированный как новый indolinone, индуцирующий анеуплоидию, вызывает дефекты митозов и цитокинеза и ингибирует Aurora B
in vitro. Однако, неясно, является ли Hesperadin строго Aurora-B-специфичным, т.к. он не был тестирован в отношении Aurora A или C [47] и было установлено, что он является эффективным ингибитором 6 различных киназ (AMPK, Lck, MKK1, MAPKAP-K2, CHK1 и PHK2) из тестированных 25. Второй ингибитор Aurora B, ZM447439, является модифицировнной версией ингибитора Aurora A и ингибирует и Aurora A и B в 100 nM пределах [46]. Оба соединения фенокопитруют Aurora B RNAi, вызывая дефекты в расположении и сегрегации хромосом и потерю фосфориляции H3 serine 10 и т.о. они кажутс пригодными для изучения ингибирования Aurora B inhibition в клетках человека. Важно, что в живых PtK1 клетках воздействие Hesperadin вызывает неспособность коррекции моно-ориентации хромосом, а в фиксированных обработанных Hesperadin клетках авт. нашли небольшое, но достоверное увеличение syntelic прикреплений и снижение monotelic прикреплений, что согласуется с дефектами би-ориентации хромосом, описанными у дрожжей [25]. Обработка Hesperadin, по-видимому, не нарушает подвижность хромосом per se, указывая тем самым, что факторы кинетохор, генерирующие силы, были всё ещё в основном интактными, т.к. они преодолевали арест checkpoint, индуцированный taxol и monastrol, но не nocodazole. Сходным образом кратковременная обработка ZM4474394, блокировала таксолом индуцированный арест клеточного цикла, но не nocodazole-индуцированный арест [46]. Интересно, что ZM4474394 не меняет локализации Aurora B или survivin
на центромерах, но вызывает существенное снижение загрузки CENP-E, Mad2 и BubR1 на кинетохоры. Кратковременное воздействие ZM4474394 ведет к снижению средних расстояний между кинетохорами, что указывает на потерю натяжения сестринских центромер. В nocodazole-арестованных клетках, обработанных Hesperadin, уровни в кинетохорах Mad2 и CENP-E не меняются, тогда как уровни BubR1 и Bub1 в кинетохорах снижаются. Сходные эффекты наблюдались, когда survivin истощался с помощью RNAi [48,49]. Это важно, т.к. и таксол, которые сталибизирует микротрубочки, и monastrol, вызывающий образование монополярного веретена с моно-ориентированными хромосомами, как полагают активирует грань КПП веретена, которая м. отслеживать натяжение между сестринскими центромерами. Напротив, nocodazole деполимеризует все микротрубочки и м. активировать разные аспекты checkpoint, которые отслеживают оккупацию микротрубочками кинетохор. Эти данные строго подтверждаеют мнение, что Aurora B играет важную роль в коррекции ошибок присоединения микротрубочекe и возможно в отслеживании checkpoint веретена натяжения плеч.
Эти новые данные о функциях metazoan Aurora B комплекса подчеркивают множественные роли комплекса в регулировании митотических событий. В отдельности эти функции нуждаются в идентификации, как мириады субстратов для комплекса Aurora B д. участвовать в генерации сил и в checkpoint ответе на кинетохорах. Одним из кандидатов является microtubule-destabilising Kin I kinesin MCAK, который, как недавно было показано, является субстратом для Aurora B в клетках человека (PD Andrews and JR Swedlow, unpublished data). Aurora B фосфорилирование 5 высоко законесервированных серинов в MCAK’s N-конце
ингибирует его активность по деполимеризации микротрубочек
in vitro. При анализе phospho-mimic мутантов MCAK было выявлено снижение активности деполимеризации микротрубочек
in vivo и существенное увеличение монопоярных хромосом с monotelic и syntelic прикреплениями. Кроме того, FRAP (fluorescence recovery after photobleaching) анализ выявил, что мутации сайтов фосфорилирования с помощью Aurora B в MCAK меняют турновер MCAK на центромерах. Истощение Aurora B с помощью RNAi или экспрессии kinase-dead Aurora B блокируют загрузку MCAK на центромеры, это подтверждает данные, что разрушение Aurora B с помощью KR мутаций ведет к потере CENP-E и dynein из кинетохор [45]. Всё это вместе с данными по Dam1 комплексу у почкующихся дрожжей [22,34], деллает возможным, что фосфорилирование с помощью Aurora B скоординированно понижает сродство ключевых игроков, участвующих в прикреплении и турновере микротрубочек на кинетохорах и центромерах, тем самым способствуя потере прикрепления. Более того, новый inner-centromere белок, названный ICIS, стимулирует активность
MCAK по деполимеризации микротрубочек
in vitro [50]. ICIS ко-иммуноперципитируется вместе с Aurora B, INCENP и Skp1, как F-box-binding белок; однако, точные взаимоотношения между Aurora-B–INCENP и ICIS–MCAK неясны, принимая во внимание тот факт, что MCAK сам по себе является субстратом для Aurora B и ингибируется фосфорилированием с помощью Aurora B
in vitro и
in vivo [50]. Взаимодействие ICIS с Skp1 интересно, учитывая присутствие F-box внутри последовальностей ICIS. Остаётся установить, является ли присутствие F-box указыанием на то, что ICIS–MCAK комплекс является объектом дальнейшего уровня регуляции с помощью фосфорилированием управляемой ubiquitination и протеолиза.
Функция Aurora B в регуляции динамики микротрубочек м.б. законсервирована в эволюции [51]. Точная природа взаимоотношений между комплексом Aurora B, прикреплением микротрубочек к кинетохорам, генерацией натяжения с помощью регулируемого оборота микротрубочек и как это всё отслеживается (‘sensed’) с помощью различных аспектов механизма надзора за веретеном остаётся неясным.
Aurora B and cytokinesis
Цитокинез начинается в анафазе с углубления борозды, которое в конечном счёте разделяет делящиеся клетки на две отдельные дочерние клетки. Цитокинез д.б. скоординирован с расхождением хромосом, чтобы гарантировать сохранение интактных геномов. Aurora B комплекс ведет себя как критический координатор событий цитокинетического пути (обзор Glotzer). INCENP участвует в регуляции цитокинеза, т.к. локализуется в кортексе во время поздней анафазы, в телофазе перед углублением борозды деления и перед рекрутированием миозина [15,52]. Комплекс Aurora B существенен для цитокинеза у поозвоночных [16,53–55,56,57], C. elegans [18,42,58–60], Drosophila [40,41] и делящихся дрожжей [38]. У C. elegans комплекс Aurora B необходим для стабильного рекрутирования CeMKLP1/ZEN-4, кинезин-подобного белка, который действует, чтобы стабилизировать и связывать в пучки перекрывающиеся антипараллельрные микротрубочки в срединной зоне [43,59–61]. Комплекс между CeMKLP1/ZEN4 и Rho-GAP CYK4/MgcRacGAP законсервирован у людей и червей и дублирует
centralspindlin [61]. MgcRacGAP является субстратом для Aurora B [62]. Фосфорилирование с помощью Aurora B усиливает его GAP активность особенно в отношении RhoA скорее, чем Cdc42 или Rac. Aurora B сайт, идентифицированный в этом иссоледовнии, не консервативен у MgcRac-GAP ортологов, так что сегодня неясно, каков генеральный механизм. Характер действия Aurora B’s распространяется за границы регулируемой динамики микротрубочек посредством kinesin-подобных белков: она также сильно фосфорилирует type-III промежуточные филаменты, такие как vimentin, GFAP и desmin [63,64]. Мутации Aurora B сайтов в этих белках промежуточных филамент ведут к дефектам формирования м сегрегации филамент и к блокированию финальной стадии цитокинеза [63,64]. Aurora B фосфорилирует также myosin II регуляторную лёгкую цепь [65]. Лекарственное ингибирование Aurora B вызывает потерю локализации myosin II нарушения организации срединной зоны [66]. Aurora B м. скоординировнано регулировать многие аспекты цитокинеза, включая выбоор плоскости деления посредством регуляции динамики кортикальных микротрубочек [67], углубления борозды с помощью регуляции генерации акто-миозиновых сил, стабильность срединной зоны веретена и возможно разделение клеток посредством регуляции активности малых GTPases и промежуточных филамент.
Aurora B and Chromatin
Многие из крупных мишеней для Aurora B киназы являются хромосомными белками. Гистон H3, один из стрежневых компоенентов нуклеосом, и специфичный для центромер H3 вариант CENP-A фосфорилируются во время митоза благодаря действию комплекса Aurora B [27,68–70]. Кроме того, продемонстрировано
in vitro Aurora B фосфорилирование двух негистоновых хромосомных белков, ДНК topoisomerase II [71] и хроматин ремоделирующего фактора ISWI [72]. Специфическое для клеточного цикла фосфорилирование H3 законесервировано у эукариот, хотя функция этой модификации вызывает споры [73]. Простое стимулирование фосфорилирования H3 за счёт ингибирования PP1, фосфатазы, которая противодействует активности Aurora B комплекса, оказывается недостаточным для управления таргетингом condensin, важного фактора конденсации хромосом, или для индукции каки-либо видимых конденсаций хромосом [69]. Фосфорилирование гистона H3 м.б. критическим в организме с длинными хромосомами: Tetrahymena, несущая гистон H3 с мутацией в митотическом сайте фосфорилирования (S10A), обнаруживат дефекты конденсации и собственно не сегрегрирует митотические хромосомы [74], та же самая мутация у почкующихся дрожжей не обнаруживет фенотипических проявлений [27]. У червей истощение Aurora B с помощью RNAi вызывает дефекты конденсации хромосом и ингибирует фосфорилирование гистона H3, возможно из-за того, что condensin не попадает на соответ. хромосомы [59,75]. До некоторой степени сбивающие с толку дефекты конденсации наблюдались [40] и объявлялись необнаружимыми [41] в клетках тканевой культуры у Drosophila после Aurora B RNAi. Дефекты в конденсации хромосом обычно вызывают ‘cut’ фенотип, при котором хромосомы не способны сегрегировать соотв. образом в митозе и затем разрываются во время цитокинеза. У почкующихся дрожжей ‘cut’ фенотипы не обнаруживаются в ipl1 или sli15 клетках [24,25,27,76]. Мутанты Aurora B комплекса у делящихся дрожжей, по-видимому. ведут себя по другому, клетки ark1 обнаруживают дефекты конденсации и дефекты цитокинеза [38], а bir1 клетки обнаруживают cut фенотип [36,39]. Хромосомы формируются правильно
in vitro в митотических экстрактах яиц Xenopus, истощенных по Aurora B комплексу [77]. Однако, если хроматин сначала реплицируется
in vitro а затем втсупает в митоз в отсутствие Aurora
B, то наблюдается частичный дефект в высвобождении cohesin (белкового комплекса, который обеспечивает ассоциацию сестринских хроматид) из хромосомных плеч. Этот эффект наиболее выражен, когда второго клеточного цикла протеин киназа Plx1, гомолог Xenopus polo киназы, также истощена [77]. Интересно, что у C. elegans мейозисные, AIR-2 (Aurora B) мутанты не способны высвобождать cohesin REC-8 из хромосом [78]. AIR-2 фосфорилирует REC-8
in vitro по нескольким сайтам. RNAi PP1/CeGLC-7 вызывает релокализацию AIR-2 и преждевременную потерю REC-8 из митотических бивалентов, подтверждая мнение, что динамика фосфорилирования и дефосфорилирования REC-8 является важной для мейоза. Незначительные различия в функции комплекса Aurora B м. указывать на то, что детали динамики хромосомной структуры отличаются в зависимости от количества и размеров хромосом, стадии развития, типа клеток и т.д.
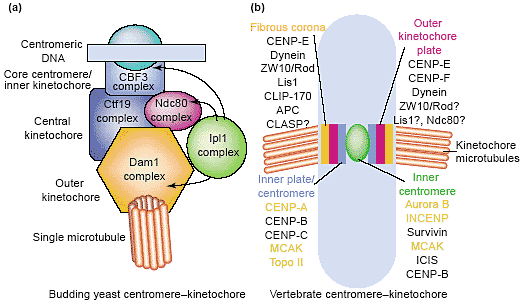
Если комплекс Aurora B локализован в центромерах, то как он м. фосфорилирровать гистон H3 и др. хромосомные белки по всей длине хромосомных плеч? Уже первые сообщения по локализации INCENP иденифицировали существенное накопление белка доль хромосомных плеч [52]. Наши собственные наблюдения подтвердили это, а иногда выявляется сама Aurora B вдоль хромосомных плеч (PD Andrews and JR Swedlow, unpublished data). Эта локализация пока ещё непонятна, но м. отражать динамичный пул Aurora B комплекса, который присутствует на низких устойчивых уровнях на хромосомных плечах. Митотические клетки, обработанные ZM447439 быстро теряют фосфорилирование гистона H3 возможно из-за того, что активность Aurora B необходима для поддержания этой модификации в её митотическом состоянии [46].
Aurora B regulation
Активность киназы в отношениит столь многих критических субстратов д. тонко регулироваться. Фактически уровни Aurora B белка регулируются во время клеточного цикла, достигая пика в G2/M. Хотя точное время деградации Aurora B белка ещё не установлено, имеется , по-видимому, существенная потеря энзима после телофазы в культивируемых клетках [79]. Эта деградация м. обеспечиваться с помощью последовательностей в N конце Aurora B, хотя роль survivin и INCENPв стабильности комплекса Aurora B ещё не изучена в деталях. Ферментативная активность Aurora B м. также регулироваться внутри комплекса. IN-box, законсервированный мотив в С конце INCENP, обеспечивает связывание INCENP с Aurora B и стимулирует активность киназы
in vitro [30].
In vitro исследования идентифицировали некоторые сайты фосфорилирования с помощью
Aurora B в INCENP, хотя их число и функция
in vivo ещё не определены [30,80,81]. Survivin также м. играть роль в регуляции активности киназы, снова возможно посредством фосфорилирования [82]. Являются ли эти модификации просто изменениями в сродстве связывания этих белков или вызываются конформационными изменениями, которые затргивают общую активность киназ, неясно. Более того, возникают ли эти модификации внутри комплекса или посредством взаимодействия отдельных молекул комплекса, ещё предстоит установить. Важным компонентом регуляции Aurora B м.б. его динамическое поведение в клетках. Aurora B покидает innercentromere домен в начале анафазы и затем ассоциирует с срединной зоной веретена в телофазе и с midbody
 Spatial control of tension: a speculative model for the role of Aurora B–MCAK–PP1 in metaphase chromosome congression. (a) A metaphase cell with
INCENP (red) at the inner centromere, PP1 (green) at the outer kinetochore and microtubules (blue) showing distinct spatial separation of the Aurora
B complex and PP1 in sister chromatids under tension. YFP-PP1-g cell line kindly provided by Laura Trinkle-Mulcahy. (b) A speculative model
postulating that the dynamic interplay between Aurora B, the microtubule destabilizing Kin I kinesin (MCAK) and PP1 could constitute a
phosphorylation-dependent tensiometer and could in part explain the dynamic oscillatory behaviour of chromosomes during congression to the
metaphase plate. The key to this model is a dynamic, metastable localization of Aurora B. In I and III, the asymmetric localisation of Aurora B on
the centromere axis results in asymmetric phosphorylation of factors that promote microtubule dynamics (MCAK?), causing asymmetric force
production and thus directional movement of the chromosome. When Aurora B localization shifts, force generation through microtubule
depolymerization shifts as well. In the model, Aurora B phosphorylation inhibits microtubule depolymerisation, so the kinetochore distal to
Aurora B generates most force. A force-balanced stationary chromosome can occur only transiently (II), unless Aurora B localization becomes
fixed between the middle of centromeres or the its kinase activity is inhibited. At anaphase, Aurora B leaves the centromere and force generation
can proceed unhindered.
Spatial control of tension: a speculative model for the role of Aurora B–MCAK–PP1 in metaphase chromosome congression. (a) A metaphase cell with
INCENP (red) at the inner centromere, PP1 (green) at the outer kinetochore and microtubules (blue) showing distinct spatial separation of the Aurora
B complex and PP1 in sister chromatids under tension. YFP-PP1-g cell line kindly provided by Laura Trinkle-Mulcahy. (b) A speculative model
postulating that the dynamic interplay between Aurora B, the microtubule destabilizing Kin I kinesin (MCAK) and PP1 could constitute a
phosphorylation-dependent tensiometer and could in part explain the dynamic oscillatory behaviour of chromosomes during congression to the
metaphase plate. The key to this model is a dynamic, metastable localization of Aurora B. In I and III, the asymmetric localisation of Aurora B on
the centromere axis results in asymmetric phosphorylation of factors that promote microtubule dynamics (MCAK?), causing asymmetric force
production and thus directional movement of the chromosome. When Aurora B localization shifts, force generation through microtubule
depolymerization shifts as well. In the model, Aurora B phosphorylation inhibits microtubule depolymerisation, so the kinetochore distal to
Aurora B generates most force. A force-balanced stationary chromosome can occur only transiently (II), unless Aurora B localization becomes
fixed between the middle of centromeres or the its kinase activity is inhibited. At anaphase, Aurora B leaves the centromere and force generation
can proceed unhindered.
во время циитокинеза [56]. Что запускает эти движения, пока неизвестнро; однако, деградация cyclin B м. играть роль в высвобождении Aurora B [83,84]. Оборот Aurora B на центромере довольно быстрый в прометафазе, но очень медленный в телофазе [57]; что управляет этим сдвигом в сродвтсе связыания, неизвестно. Наблюдаемые эффекты потери cohesin/condensin на локализацию комплекса Aurora B [36,85–87] и наблюдаемые взаимодействия между INCENP и HP1 [88] и INCENP и перицентромерным гистоном H2A.Z [89] указывают на интересное взаимодействие между Aurora B и белками хроматина, которые нуждаются в последующем изучении.
Если Aurora B комплекс дестабилизирует прикрепления микротрубочек к кинетохорам, то его активность д. каким-то образом направляться на моно-ориентировнные хромосомы. Механистическая основа для этого ещё не определена, но она м. б. связана с локальной регуляцией киназной активности. Согласно этой модели киназная активность на моно-ориетированных хромомсомах повышена, тогда как на би-ориентированных хромосомах супрессирована. Т.к. PP1 как известно. противодействует активности Aurora B [22,26–28] и ингибирует её киназную активность [69,90] а также локализуется на кинетохорах [91], то возможно, что эта локальная регуляция м. использовать коммуникации между Aurora B комплексом на внутренних частях центромер и PP1 на кинетохорах. Эта модель представлена на Рис. 4 здесь м. использоваться просто изменения в близости двух энзимов, когда формируется натяжение через кинетохоры [25], приводящие в результате к изменениям в сети фосфорилирования центромерных или кинетохорных субстратных белков или даже к перекрёстной регуляции Aurora B и PP1. Кроме того, точная локализация комплекса внутри центромер м.б. динамической, меняющей динамику микротрубочек асимметрично за счёт кратковременной концентрации ближе к одной из сестринских кинетохор. Если комплекс регулирует активность моторных белков, которые затрагивают динамику микротрубочек, то асимметричная локализация Aurora B м. генерировать асимметрию динамики микротрубочек поперек и тем самым генерировать направляющие силы. Если эта локализация осциллирует, то результатом будут осциллирующие движения хромосом. Правильность идеи нуждается в проверке.
Conclusions
The Aurora kinases represent a fascinating family of
molecules whose activities impinge on a large number
of critical cell functions. Their discovery has coincided
with the development of many new technologies (RNAi,
live cell imaging, etc.) that provide functional analyses in
many different experimental systems. Experimental progress,
especially with the Aurora B complex, has been
rapid over the past two years and, if anything, the pace in
this exciting field is increasing. These fascinating molecules
are revealing not only the intricate details of their
own activities, but also critical cellular functions that were
previously either unknown or not understood. As we look
to the horizon, we see the Auroras shining brightly and
coming into focus.
Сайт создан в системе
uCoz