Целенаправленная доставка мРНК на RER впервые была выявлена в ооцитах Xenopus [21,22]. Разные мРНК м. связываться непосредственно в разными субдоменами RER. Напр., две мРНК для мембранных белков специфически локализуются в разных частях ER в семенах риса
[23,24]. Одна мРНК кодирует prolamine, который формирует включения, происходящие из ER. Др. мРНК кодирует glutein, который первоначально транслоцируется в ER, но не обнаруживается в prolamine включениях, он транспортируется в аппарат Golgi и вакуоли, где он также формирует включения. Отдельные локализации мРНК минимизируют перемешивание двух белков и это делает возможным образование разных включений.
Может ли локализация мРНК обеспечивать поляризованное отложение или секрецию белков только в одном сегменте клетки? Это возможно в любой клетке, которая имеет множественные tER-Golgi единицы. Такого типа экзоцитический путь организации впервые был описан у дрожжей Pichia, у которых каждый tER сайт расположен тесно с Golgi mini-stack, в результате чего формируется tER-Golgi единица [25]. Сходное расположение tER и Golgi обнаружено в клетках Drosophila [9] и ооцитах Drosophila, которые являются очень крупными клетками, содержащими 1000 tER-Golgi единиц [26], что предоставляет уникальную систему для изучения локального синтеза белков.
Этот пре-трансляционный механизм является ранее неизвестным способом создания поляризованных отложений трансмембранных и/или секретируемых белков в дополнение к пост-трансляционной сортировке в trans-Golgi network
(TGN) [28] и он может быть приложим к др. секретируемым белкам у Drosophila [29].
В клетках млекопитающих локализация мРНК, кодирующих трансмембранные и секреторные белки, изучается систематически. Последние работы были сфокусированы в частности на модели грузовых белков, таких как VSVG, секретируемых модельными клетками, часто фибробластами (напр., HeLa клетками), в которых аппарат Golgi является однокопийной около-ядерной лентой (ribbon) в которой все ministacks сцеплены вместе [30]. В одном типе клеток, однако, были описаны Golgi аванпосты. Это было обнаружено в дендритах нейронов крыс, которые кроме того содержат ассоциированные RER и tER сайты [31], и эти дендриты были способны поддерживать локальный синтез и транспорт трансмембранных белков, таких как AMPA рецепторы, независимо от тела клетки [32,33]. Это скорее всего является результатом транслокации локализованных мРНК (хотя мРНК AMPA не является формально локализованной), что сопровождается транспортом в эти Golgi аванпосты эквивалентно с их появлением в tER-Golgi единицах. Сходная локальная трансляция
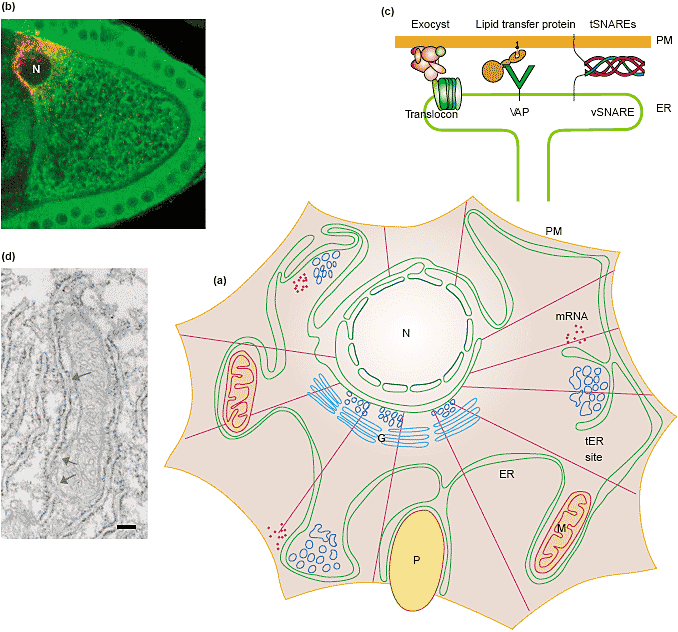 ER heterogeneity is created by extrinsic cues. (a) A diagrammatic representation of the interactions between the ER (green) and different extrinsic cues including localized mRNAs near peripheral tER sites, the plasma membrane, mitochondria (M) and a phagosome (P). Microtubules are
drawn in purple. G, Golgi apparatus. (b) A single stage-9 Drosophila oocyte surrounded by follicle cells. Within the oocyte, Gurken protein (red) is restricted to the dorsal/anterior corner near the nucleus (N) in dots representing the tER-Golgi units. The ER in all cells is green. (Courtesy of Bram Herpers, Department of Cell Biology, UMC Utrecht, The Netherlands.) (c) Diagram of three protein complexes potentially involved in ER-plasma membrane contact [44-47]. (d) Electron micrograph of a mitochondrion wrapped in ER showing zones of apposition (arrows), where
ER depleted of ribosomes comes to within 30nm of the mitochondrion. (Courtesy of Ann de Maziere, Department of Cell Biology, UMC Utrecht,
The Netherlands.) Scale bar represents 200nm.
ER heterogeneity is created by extrinsic cues. (a) A diagrammatic representation of the interactions between the ER (green) and different extrinsic cues including localized mRNAs near peripheral tER sites, the plasma membrane, mitochondria (M) and a phagosome (P). Microtubules are
drawn in purple. G, Golgi apparatus. (b) A single stage-9 Drosophila oocyte surrounded by follicle cells. Within the oocyte, Gurken protein (red) is restricted to the dorsal/anterior corner near the nucleus (N) in dots representing the tER-Golgi units. The ER in all cells is green. (Courtesy of Bram Herpers, Department of Cell Biology, UMC Utrecht, The Netherlands.) (c) Diagram of three protein complexes potentially involved in ER-plasma membrane contact [44-47]. (d) Electron micrograph of a mitochondrion wrapped in ER showing zones of apposition (arrows), where
ER depleted of ribosomes comes to within 30nm of the mitochondrion. (Courtesy of Ann de Maziere, Department of Cell Biology, UMC Utrecht,
The Netherlands.) Scale bar represents 200nm.
и трансляция, как полагают, происходит и в аксонах [34,35,36]. Следующим важным вопросом является степень, до которой tER сайты являются эквивалентными. То что они могут функционировать независимо один от др. показано с помощью локального транспорта белка Gurken в ооцитах
Drosophila (Figure 1b). Однако, неизвестно все ли периферические tER сайты HeLa клеток активны в отношении транспорта общих транспортных маркёров и вполне возможно, что эти сайты фактически используются для синтеза локализованных, но еще не идентифицированных мРНК.
ER non-uniformities derived from other
membrane-bound organelles
Помимо хорошо известных субдоменов ER (
RER, smooth ER и tER сайтов), мы рассмотрим здесь неуниформность ER, которая индуцируется с помощью др. органелл. Эти суб-домены ER не достаточно хорошо описаны морфологически помимо близости к др. компартментам. ER интимно ассоциирован со многими др. органеллами, включая TGN [37], эндосомы [38], хлоропласты [39] и пероксисомы [40], а также с плазматической мембраной и митохондриями. Мембраны контактирующих сайтов между ER и др. компартментами формируют специализированные суб-домены с каждой органеллой, которая задействована в передаче информации и материала через узкую цитоплазматическую щель.
ER and plasma membrane
Кортикальная часть ER тесно противопоставлена части плазматической мембраны во всех типах клеток. Эта близость, как полагают, лежит в основе способности липидов к трафику в двух направлениях между ER и плазматической мембраной независимо от секреторных путей [41,42]. Только у дрожжей удалось очистить порцию ER, прикрепленную к плазматической мембране. По сравнению с общим ER она богата lipid synthases, указывающими на то, что она адаптирована для поставки липидов [43]. Физическая природа связи ER-плазматическая мембрана всё ещё не установлена, но недавно охарактеризованы три разных связующих комплекса (Figure 1c). Во-первых, в клетках млекопитающих и у дрожжей, translocon of RER взаимодействует непосредственно с экзоцистом, связанным с плазматической мембраной (rev. [44]). Дальнейшие доказательства важности этого взаимодействия получены при изучении рекрутирования кортикального ER к новым почкам дрожжей с помощью субъединицы экзоцисты Sec3 [45]. Во-вторых, консервативный ER белок, названный VAP (VAMP-associated белок, где VAMP является v-SNARE vesicle-associated мембранным белком) формируют связывающие комплексы с белками периферических мембран на плазматической мембране, а также с др. сайтами в клетке [46]. В-третьих, когда фагоциты захватывают крупные тела, то плазматическая мембрана д. быстро расти и в этих экстремальных условиях добавочная мембрана создается с помощью ER. Эта ступень обеспечивается с помощью ER v-SNARE гомологов к Sec22, только ER v-SNARE, которые спариваются с t-SNAREs плазматической мембраны [47], участвуют в непосредственном SNARE обусловленном слиянии ER с плазматической мембраной. Сходным образом, стимулирование лимфоцитов человека индуцирует контакты между exofacial листком плазматической мембраны и просветным листком ER, указывая тем самым на присутствие временной непрерывности между ER и плазматической мембраной в этих клетках [48]. В дополнение к этим мостикам между ER и плазматической мембраной, имеются доказательства мембранного трафика между этими двумя компартментами, который обходит аппарат Golgi.
Наиболее интригующие данные получены на дрожжах, у которых белок polytopic плазматической мембраны Ist2, по-видимому, переносится из кортикального ER кончика почки (где его мРНК специфически локализуется) на соседнюю плазматическую мембрану [49]. Предположение, что Ist2 транслоцирован в ER, подтверждается тем, что трафик Ist2 не зависит от классического экзоцитического пути, т.к. он неизменен при разных мутациях секреторного пути [49,50]. Альтернативой является то, что Ist2 может подвергаться одной из ранее описанных форм не классической секреции белков (т.e. прямая инсерция в плазматическую мембрану после транслокации в цитозоль), который до сих пор был ограничен в основном малыми секретируемыми цитокинами [51]. Это предположение, что непосредственный перенос происходит между ER и плазматической мембраной подтверждается находками, что др. блоки секреторного пути у дрожжей лишь слегка влияют на отложение в плазматической мембране основной массы интегральных белков плазматических мембран [52]. Т.к. вполне возможно, что контакт ER-плазматическая мембрана является новым способом переноса, то важно подтвердить это путём идентификации молекулярной кухни (machinery), участвующей, напр., в определить, нуждается ли трафик Ist2 в SNAREs, которые спаривают ER и плазматическую мембрану [47].
ER and mitochondria
ER и митохондрии интимно ассоциированы др. с др. Они физически сцеплены вместе во многих типах клеток и они ко-регулируют некоторые важные функции, включая апоптоз и перенос липидов и Ca2+ [53].
Non-vesicular traffic and the physical link between
the ER and the mitochondria
Специфический ER компартмент, который взаимодействует с митохондриями, называется mitochondria-associated ER membranes (MAM). Очень мало известно о MAM, за исключением того, что она обогащена многими lipid synthases по сравнению с общим ER, и бедна рибосомами [54]. Накопление lipid synthases сравнимо с одной из очевидных функций MAM, которая заключается в участии в трафике липидов в и из митохондрий [55]. Сходным образом,
ER сайты Ca2+ высвобождающих каналов, по-видимому, предпочтительно локализованы вблизи митохондрий, указывая тем самым, что MAM может специализироваться на переносе кальция из ER в митохондрии [56]. Не смотря на отсутствие слияния мембран между ER и митохондриями, всплывает тема, что некоторые белки являются общими у этих органелл, включая некоторые интегральные мембранные белки. Для таких мембранных белков пост-трансляционная инсерция в митохондрии имеет тенденцию происходить, если ко-трансляционная инсерция в ER не эффективна [57-59]. Важно, что любые белки, общие ER и митохондриям, которые могут формировать димеры голова-к-голове являются прекрасными кандидатами на роль связующих компонентов в зоне апоозиции (стрелки на Figure 1d). Одним из предполагаемых кандидатов является voltage-dependent anion channel (VDAC или 'porin') [60], и это может быть важным началом в картировании связующих белков между MAM и митохондриями, ни один из которых ещё не был позитивно идентифицирован.
Apoptosis
ER и митохондрии контролируют важные аспекты апоптоза, а пути, используемые этими двумя органеллами, сильно взаимозависимы. Напр., про-апоптический белок BAP31 располагается на ER и усиливает про-апоптический Ca2+ сигнал, который исходит из ER в митохондрии после того, как BAP31 расщепляется с помощью инициирующей апоптоз caspase-8 [61]. Митохондрии вовлечены в это расщепление, т.к. caspase 8 располагается на митохондриях и действует в транс-способом, чтобы расщепить BAP31 на ER [62]. Т.о., интимный контакт между ER и митохондриями важен для запрограммированной клеточной гибели.
Одним из аспектов подобной взаимозависимости является то, что ER и митохондрии обладают многими общими апоптическими регуляторами. Сюда входит PACS-2, который соединяется с про-апоптическим BH3-domain-only белком Bid [63]. В покоящихся клетках фосфорилированный Bid обнаруживается и в цитоплазме и до некоторой степени в ER. Вследствие апоптических стимулов Bid дефосфорилируется и затем соединяется с PACS-2 на митохондриях. Bid затем активируется с помощью caspase-8, расщепляется, образуя truncated Bid (tBid), который в свою очередь индуцирует высвобождение cytochrome c. Интересно, что PACS-2 чувствителен к апоптическим стимулам за счёт транслокации с ER на митохондрии и сама структура MAM нуждается в PACS-2 для своей нормальной интегральности [63],
хотя это не может исключать вторичности эффекта PACS-2's в изменении апоптических путей. Не смотря на эти будоражащие находки мы всё ещё мало знаем о том, как часть ER, которая является MAM организуется под действием внешнего влияния митохондрий.
Conclusions
The ER maintains variety in unity. For a long time, the
ER was considered to act in a unified manner, in keeping
with the unitary nature of the rest of the secretory pathway.
However, we now know that localized mRNAs allow
the sub-division of the classical secretory pathway into
separate compartments. In addition, the ER has specific
relationships with many non-ER cellular components,
inducing multiple sub-domains in the ER [64]. For the
sake of brevity, we have only discussed two of these in
detail, the plasma membrane and the mitochondria. The
molecular bridges between the ER and other organelles
are almost entirely undescribed, except in a single case
(the nuclear–vacuole junction in yeast) [65]. In any event,
the idea that extrinsic cues organize the ER leads to a
further question: what provides these cues with their
positional information? The simple answer must be that
the cytoskeleton contains most of the information needed
to organize the different cellular components and their
inter-relationships. In some cases, the molecular mechanisms
that set up these relationships are now becoming
understood, such as the pathways underpinning the
movement and anchoring of Gurken mRNA [17,18].
However, in most cases of ER sub-compartmentalization
only a small fraction of the overall mechanism is known at
the molecular level, making this an interesting field to
work in.
Сайт создан в системе
uCoz 