Хотя точная степень, с которой созревание вносит вклад в forward транспорт груза
всё ещё не установлена, однако недавние данные указывают на то, что постоянное созревание является критическим для поддержания субкомпартментализации Golgi. Интересны эксперименты, которые анализируют взаимоотношения Golgi к ER. Блокирование экспорта из ER приводит к перераспределению всех Golgi residents, изученных в этом отношении, в ER, это указывает на то, что Golgi участвует в поддержании динамического равновесия с ER скорее, чем выступает в качестве стабильной единицы [13]. Интересно, что обратный ER экспорту блок позволяет клетке генерировать субкомпартментализованный аппарат Гольджи
[14]. Этот процесс может представляться как продолжение дискретных ступеней с отдельными молекулярными потребностями. Во-первых, Golgi белки концентрируются и экспортируются из ER с помощью COPII пузырьков, которые образуют pleiomorphic мембранные структуры, называемые vesicular tubular clusters (VTCs), известные также как ER Golgi промежуточный компартмент.
Во-вторых, субкомпартменты генерируются из не компартментализованных VTC, как это было показано с помощью сегрегации cis, medial и trans Golgi белков. В-третьих, эти компартментализованные структуры затем транспортируются вдоль микротрубочек к центру клетки, где на четвертой ступени они сцепляются, чтобы сформировать одиночную околоядерную Golgi ленту. Т.к. две первые ступени непосредственно участвуют в субкомпартментализации, то необходимо сконцентрироваться на механизмах, которые обеспечивают эти реакции.
Во время
de novo биогенеза Golgi, COPII пузырьки обеспечивают инициальную концентрацию и экспорт Golgi белков из ER. Повторяющиеся раунды слияний COPII пузырьков генерируют VTCs, которые далее концентрируют Golgi белки путём рециклинга заловленных ER белков обратно в ER [15,16]. Компартментализация может стартовать с сортировки cis Golgi
белков от др. с помощью COPI пузырьков. Эти пузырьки сливаются с вновь организованными COPII пузырьками или VTCs, и тем самым обогащают их cis элементами. Затем, medial Golgi белки отсортировываются в пузырькит, которые сливаются с цис-обогащенными VTC, что позволяет им созревать. Как показано на Рис. 1, такой повторяющийся локальный рециклинг постояльцев (residents), индуцированный с помощью COPI покровов имеет высокое сродство к ранним Golgi белкам и пониженное сродство к более поздним компонентам, может инициировать компартментализацию [16-18]. Недавние морфологические доказательства подтверждают, что экспорт из ER может происходить даже в зонах, лишенных COPII пузырьков посредством тубулярных выростов, которые дифференцируются в зрелые VTCs [19]
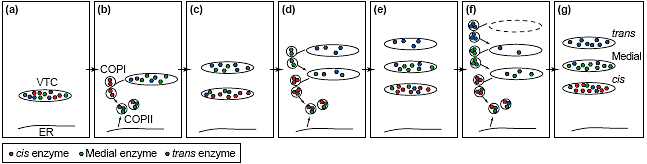 De novo generation of Golgi subcompartments by iterative local recycling. The model assumes that cis enzymes are the most efficiently recycled
while trans enzymes are the least. Local recycling, as opposed to recycling via the ER, allows maintenance of Golgi subcompartments [17].
De novo generation of Golgi subcompartments by iterative local recycling. The model assumes that cis enzymes are the most efficiently recycled
while trans enzymes are the least. Local recycling, as opposed to recycling via the ER, allows maintenance of Golgi subcompartments [17].
Компартментализация, управляемая с помощью созревания, может в дальнейшем получить помощь в виде склонности сродства COPII к разным Golgi белкам. Ранние (cis) Golgi белки, по-видимому, первыми экспортируются, а инициальные VTCs генерируются обогащенные ими [20,14]. Это указывает на то, что cis компартменты генерируются рано во время биогенеза, за ними следуют более поздние компартменты. Согласуется с этим и сегрегация между cis Golgi белком GM130 и medial Golgi энзимом Mannosidase-II , наблюдаемая очень рано во время биогенеза Golgi biogenesis [14].
Непрерывное созревание и локальный рециклинг могут также поддерживать субкомпартментализацию в устойчивом состоянии. В самом деле, т.к. VTCs д. быть обеднены (de-enriched) по Golgi компонентам, то этот процесс скорее всего будет наиболее эффективным. Далее, COPII, склонные в отношении cis-Golgi residents будут гарантировать, что приток в Golgi из ER будет обогащен ранними компонентами, которые способствуют субкомпартментализации.
Mechanisms of local recycling
Как поддерживается точность локального рециклинга? Одной из возможностей является то, что разные оболочки обладают разным сродством к разным SNAREs [10]. Разнообразие в специфичности грузов для COPII и COPI оболочек может быть достигнуто за счёт их существования как мультимерных самостоятельных гетеромеров, отличающихся своими субъединицами, связывающими груз. Согласуется с этим то, что клетки млекопитающих имеют, по крайней мере, 4 изоформы субъединицы sec24 для COPII [21]. Также белки Lst1p и Sfb2p, как было установлено, замещают Sec24p у дрожжей, чтобы сформировать COPII пузырьки с разными специфичностями к грузам [22-24].
Сходные замены изоформ были постулированы для образования COPI coat комплексов [25]. Будучи скоординированной дифференциальная сортировка достигаемая с помощью таких гетеромеров, д. служить концентрации специфических SNAREs в разных компартментах и генерировать градиенты концентраций SNARE вдоль секреторного пути. Это в свою очередь д. диктовать специфичность белка, переносимого через компартменты и помогать поддерживать субкомпартментализацию Golgi (Figure 2).
В соответствии с предсказаниями модели, по крайней мере, три специфических набора SNAREs д. участвовать в трафике между ER и Golgi. Во всяком случае, t-SNARE состоит из трех отдельных белков, которые образуют три из 4-х спиралей. Syntaxin5, если комплексуется с sec22 и membrin, то формирует t-SNARE, который взаимодействует специфически с v-SNARE bet1. Если же комплексуется с GOS28 и Ykt6, то Syntaxin5 формирует t-SNARE, который соединяется с GS15 [26,27]. Эти два набора v-t-SNARE могут обеспечивать слияние COPII, чтобы формировать VTCs, и слияние локально recycling COPI пузырьков, соотв. [27,28]. Ретроградные пузырьки, которые сливаются с ER, как полагают, содержат v-SNARE Sec20, который соединяется с t-SNARE комплексом из Ufe1, Sec22 и Slt1 [29]. Тщательный анализ сортировки этих SNAREs с помощью разных оболочек позволит нам пролить свет на обоснованность градиентной модели SNARE.
В Golgi, локальный рециклинг может быть усилен за счёт удержания пузырьков в локальной среде путём дополнительного слоя белковых взаимодействий, которые закрепляют эти пузырьки в акцепторном компартменте. Т.к. предполагается, что длины таких 'привязей' пузырьков больше, чем расстояние между цистернами, то вполне возможно, что привязи устанавливаются еще до завершения отшнуровки пузырьков. Привязи могут т.о. делать возможным направленный транспорт между цистерн, используя одиночный набор SNAREs.
Два класса белков, как было предположено, формируют привязи COPI
пузырьков. Первый принадлежит к семейству golgin длинных супер-скрученных белков. Исследования белковых взаимодействий и закрепления пузырьков в доках, осуществленные
in vitro подтверждают, что giantin,
который присутствует на пузырьках, может быть сцеплен с ассоциированным с мембраной GM130 посредством docking фактора p115, и что формирование таких привязей является предварительным условием для слияния [30-32]. Недавно было также отмечено, что
 Hypothetical scheme for compartmentalization based on different affinities of coats for various SNARES and guanine nucleotide exchange factors (GEFs), resulting in distinct concentration gradients of proteins. Each compartment (ER, cis, trans, PM) is marked by an enriched GEF (labeled G1-G5),
and an enriched t-SNARE (T1-T5). The GEF determines coat formation by a corresponding coat (C1-C5), which mediates the sorting of specific
v-SNAREs (V1-V5) into vesicles. Cognate t-SNAREs define the acceptor compartment for vesicles. Homotypic fusion, recycling and homeostatic
mechanisms, defined by the same rules, allow, in principle, the de novo generation of the cis and trans compartments from the ER and PM. This
requires that the coats sequester SNAREs on compartments and activate specific SNAREs for fusion during vesicle formation. Concentration
gradients of the components that will be generated by such a system are indicated at the top of the figure.
Hypothetical scheme for compartmentalization based on different affinities of coats for various SNARES and guanine nucleotide exchange factors (GEFs), resulting in distinct concentration gradients of proteins. Each compartment (ER, cis, trans, PM) is marked by an enriched GEF (labeled G1-G5),
and an enriched t-SNARE (T1-T5). The GEF determines coat formation by a corresponding coat (C1-C5), which mediates the sorting of specific
v-SNAREs (V1-V5) into vesicles. Cognate t-SNAREs define the acceptor compartment for vesicles. Homotypic fusion, recycling and homeostatic
mechanisms, defined by the same rules, allow, in principle, the de novo generation of the cis and trans compartments from the ER and PM. This
requires that the coats sequester SNAREs on compartments and activate specific SNAREs for fusion during vesicle formation. Concentration
gradients of the components that will be generated by such a system are indicated at the top of the figure.
пузырьки, содержащие golgin-84, удерживаются на слайдах, покрытых giantin-родственным белком CASP [33]. На основании относительного обилия Golgi энзимов и относительного истощения маркёров forward груза в CASP-связывающих пузырьках, в противоположность p115-связывающим пузырькам, было предположено, что самостоятельные привязи могут диктовать направленность (directionality) COPI пузырьков. Интересно, что и giantin и golgin-84 присутствуют в обоих классах пузырьков. Хотя, если такие привязи должны предопределять мишени для слияния, то дополнительные механизмы д. селективно активировать/инактивировать один из компонентов привязи, ассоциированной с пузырьком.
Основным недостатком модели, базирующейся на golgin привязи, является то, что доказательства in vivo строго аргументируют против необходимой роли любой из этих привязей для слияния пузырьков с субкомпартментализации Golgi. Истощение giantin, GM130 или golgin-84 в интактных клетках не вызывает ни обильного накопления происходящих из Golgi пузырьков, ни коллапса субкомпартментов Golgi [34-36]. Достоверно, p115 необходим для слияния пузырьков и для субкомпартментализации Golgi [34,37]. Однако, механизм действия p115 использует его SNARE-связывающий домен, а не его giantin или GM130-связывающие домены [37]. Т.о., сегодня очевидно, что p115 может быть регулятором SNARE скорее, чем везикулярных привязей.
С др. стороны, in vivo данные подтверждают участие крупных мультибелковых комплексов в привязывании Golgi пузырьков [38]. Истощение COG3, субъединицы COG комплекса, который взаимодействует с COPI и Golgi
SNAREs, вызывает очевидное накопление происходящих из Гольджи пузырьков, содержащих специфические белки, включая и v-SNAREs [39]. Сходным образом, у дрожжей комплекс TRAPP, который непосредственно соединяется с COPII пузырьками, м. привязывать их к аппарату Golgi [40].
Инициальные стадии биогенеза de novo Golgi создают несколько проблем для локального рециклинга. Только что отпочковавшиеся пузырьки, содержащие активный v-SNARE имеют множество потенциальных сайтов для связывания на ER. Что же предупреждает такое бесполезное обратное слияние пузырьков? Также и компартменты сами по себе имеют активные SNAREs, что же удерживает их от слияния др. с др.? Сходные вопросы возникают относительно состояния устойчивости везикулярного транспорта, т.к. SNAREs подвергаются рециклингу для участия во множественных раундах слияний. Очевидным решением является удерживание SNAREs неактивными до тех пор, пока не наступит специфическая реакция слияния. Мembrane-proximal 'переключение', которым необходимо щелкнуть, чтобы сделать их компетентными к слиянию, было идентифицировано на t-SNAREs [41,42]. Пост-трансляционные модификации, такие как фосфорилирование и дополнительные белки, такие как GATE-16 и LMA1, которые переносятся на свободные SNAREs с помощью NSF [43,44], также могут удерживать SNAREs от участия в нежелательных слияниях. Специфическая роль в предупреждении обратного слияния COPII пузырьков с ER приписывается Tip20, SNARE-подобному белку, который взаимодействует с ретроградным ER SNARE комплексом [45].
Интересно, что присутствие пятого SNARE может предотвращать образование fusogenic SNARE комплексов [46]. Возможно, что рециклинг SNAREs действует подобным образом, как ингибирующие молекулы или i-SNAREs, которые предупреждают неспецифические слияния. Они могут позденее секвестрироваться прочь от ассоциированных с мишенями белков, делая возможным специфическое слияние. Удивительно, но cis Golgi SNAREs ингибируют слияния, обусловленные с помощью trans Golgi SNAREs и vice versa. Такая автоматическая генерация комплементарных градиентов i-SNAREs гарантирует градиентам из fusogenic активных SNAREs, быть ниже активных градиентов благодаря их концентрациям.
Т.к. uncoating пузырьков является предварительным условием для слияния, то это может быть тем самым случаем, который покрывает оболочкой секвестрируемые SNAREs и ингибирует бессмысленное слияние пузырьков. Такая секвестрация, если она происходит на компартментах, может быть механизмом, который предупреждает их неразборчивое слияние др. с др. В согласии с этим то, что разборка COPI значительно медленнее на плоских мембранах, в противоположность пузырькам [47]. Кроме того покровные белки сами по себе могут также активировать специфические v-SNAREs и инактивировать все др. recycling SNAREs во время образования пузырьков, гарантируя тем самым только один потенциал для SNARE пары на пузырёк (Рис. 2).
Comparison to post-mitotic Golgi reassembly
Большинство доказательств подтверждает, что во время митозов аппарат Гольджи млекопитающих превращается в популяцию многочисленных пузырьков, которые диспергируют по метафазной клетке. После цитокинеза каждая дочерняя клетка затем восстанавливает компартментализованный аппарат Гольджи. Согласно одному сценарию во время митоза кухня слияния пузырьков в Гольджи ингибирована, тогда как формирование пузырьков продолжается.
однако, необходимо обратить внимание, что необходимые роли в разборке аппарата Гольджи или по ингибированию tether/SNARE или функции COPI, еще необходимо продемонстрировать [48]. Если это так, то эти реакции д. конвертировать Golgi штабеля в самостоятельные наборы пузырьков, которые сохраняют свои интерфазные субкомпартментное богатство и программирование для целенаправленного слияния. Т.о., во время пост-митотической повторной сборки пузырьки, которые оригинально происходили из cis Golgi, и которые содержали cis Golgi residents, будут сливаться со вновь генерируемыми VTCs, управляя тем самым созреванием VTCs. Дальнейшее созревание за счёт оставшихся пузырьков и инициация локального рециклинга д. затем создавать более поздние субкомпартменты. Согласно этому мнению постмитотическая сборка аппарата Гольджи по существу использует те же самые ступени и механизмы как и при поддержании устойчивого состояния Golgi и
de novo Golgi биогенеза из ER. Т.к. инициальное распределение Golgi компонентов в ER, пузырьках и Golgi элементах отличается существенно в этих трёх состояниях, то мощный гомеостатический механизм д. участвовать в становлении собственно организации Golgi из разных стартовых точек.
Conclusions
Efficient incorporation of newly synthesized or cycling
Golgi proteins during ER exit, followed by active sorting
of earlier components into retrograde vesicles to allow
iterative local recycling, might suffice to create and maintain
a subcompartmentalized Golgi apparatus. The accuracy
of local recycling might be achieved by SNARE
gradients generated by differential affinities of coats, with
additional fine control provided by SNARE-interacting
proteins that regulate aspects of the SNARE association–
dissociation cycle. Further elucidation of the interplay
between coats and SNAREs will help us establish the
minimal systemrequired to generate subcompartments in
the Golgi.
Сайт создан в системе
uCoz
