Образование ER экспортных доменов является сложным процессом, связанным с рекрутированием Sar1-обеспечиваемой COPII оболочки в ER, полимеризацией coat в покрытые оболочкой почки и обработкой тубулярных элементов [25,27,28]. Собранные в кластеры профили COPII-coated ER мембран видны на большинстве картин электронных микрографов в виде лишь небольших частей ER экспортного домена, которые имеют диаметр 0.5-1 mm
и значительную область общей поверхности [29] (Рис. 2b,c). Важно, что COPII-coated зоны отпочкования внутри ER экспортных доменов помещаются только там, где происходит экспорт белка в секреторный путь [18,30,31].
Недавние исследования показали, что груз (такой как procollagen)
[18] экспортируется с помощью процесса выроста трубочек из non-coated областей ER экспортных доменов. Учитывая эти характеристики ER экспортных доменов, м. предположить, что и др. белки, помимо Sar1 и его непосредственных регуляторов/эффекторов (e.g. COPII proteins), необходимы для образования и функционирования этих мест. Как упоминалось выше, периферические Golgi белки и рецепторы грузов локализуются в ER экспортных сайтах как при устойчивых состояниях, так и тогда, когда Sar1 находится в постоянном GTP-связанном состоянии; эти белки м. играть роль в формировании и/или функционировании ER экспортных доменов. Наилучшим белком-кандидатом на эту роль руководителя является p115. Представленный несколькими белок-связывающими доменами, p115 взаимодействует с разнообразными белками, участвующими в транспорте ER-to-Golgi, включая и др. белки с суперскрученными доменами (напр., GM130, giantin и GRASP65), SNARE белки (напр., syntaxin 5, Bet1 белок и Sly1 белок), Rab1 GTPase и GBF1 (обменный фактор для Arf1 GTPase) [32-36,37,38,39]. Будучи рекрутированными в мембраны ER экспортных сайтов, p115 м. инициировать каскад регуляторных взаимодействий среди этих белков, которые д. приводить к биогенезу и поддержанию Golgi. Взаимодействие p115 с белками SNARE, напр., позволяет мембранам формировать выпячивания из ER экспортных доменов, чтобы сливаться гомотипически [39], тогда как его взаимодействия с GM130 и giantin д. управлять закрепляющими (tethering) взаимодействиями между мембранами и цитоскелетом [40,41]. Взаимодействия p115 с GRASPs, с др. стороны, м. облегчать сортировку p24 грузовых рецепторов на forward-направленный транспорт промежуточных образований [38], т.к. его взаимодействие с GBF1
м. модулировать Arf1 [37], чья GTPase активность лежит в основе рекрутирования десятков белков в мембраны [3,5,42]. Т.к. p115 , как полагают, рекрутируется в мембраны с помощью Rab1 и/или Rab2 [43-45], которые локализуются не только в ER экспортных доменах, но также в ERGIC
и Golgi мембранах [36,46], то p115 и взаимодействующие с ними партнеры д. действовать, чтобы дифференцировать мембраны на множественных стадиях во время процесса биогенеза Golgi. Имеющиеся доказательства подтверждают, что p115 и взаимодействующие с ним партнеры важны для функционирования ER экспортных доменов, это подтверждают эффекты подавления и/или нарушения активности этих белков. Подавление p115, GM130 (при высоких температурах) или молекул, ассоциированных с p115 или GM130 (включая rab1b, rab2a и golgin 84) блокирует весь секреторный перенос (trafficking) в Golgi [39,47-51]. Более того, возникает фенотип, сходный с наблюдаемым, когда Sar1 постоянно активен: Golgi энзимы перераспределяются в ER, a p115 и матричные и/или грузовые рецепторные белки локализуются в ER экспортных доменах. Т.о., несмотря на то, что p115 и взаимодействующие с ним партнеры полностью активны, ER
экспортные домены (инициируемые активностью Sar1) не м. формировать ERGICs, которые транслоцируются в цитоплазму и сливаются др. с др., чтобы сформировать Golgi элементы.
Building a Golgi apparatus: role of Arf1
GTPase
Какие молекулы или наборы молекул м.б. рекрутированы с помощью p115 и взаимодействующими с ним партнерами управляют биогенезом Golgi?
Необходимо исследовать молекулы, которые не рекрутируются в ER экспортные домены, когда Golgi отсутствует, такие как в Sar1 [H79G]-экспрессирующих клетках или в клетках, где p115 или rab белки подавлены. Эти молекулы включают малую GTPase, называемую Arf1, Arf1's эффекторы (включая COPI, clathrin, ankyrin, spectrin и др.), Golgi энзимы и секреторные белки-грузы [12,20,32,39 ,52]. Из этого списка Arf1 является наиболее вероятным кандидатом на роль координатора кухни, необходимой для globular-tubule транспорта промежуточных образований (т.е., ERGIC), вырастающих из ER экспортных сайтов, и для образования кластеров и слияний, чтобы генерировать элементы аппарата Гольджи. Подобно Sar1, Arf1 является GTPase, которая обменивает свой GDP на GTP. В этом GTP-связанном состоянии, Arf1 активен и ассоциирует с мембранами. После гидролиза GTP до GDP, Arf1 становится неактивным и отсоединяется от мембран. В своей активной, мембран-связанной форме, Arf1 рекрутирует десятки др. цитозольных белков в ERGIC и Golgi мембраны [3,4,5,42]. Среди них следующие: COPI coat белки, которые соединяются с и образуют кластеры грузовых рецепторных белков [2,16,53,54]; липид-модифицирующие энзимы, такие как phosphotidylinositol kinases и phospholipases [55,56], которые создают липидные условия, отличные от ER мембран; и ankyrin и spectrin белки, которые формируют поддержки, на которых м. закрепляться многие цитоскелетные и сигнальные молекулы [3]. Цитоскелетные белки рекрутируются в Golgi мембраны с помощью ankyrin/spectrin сети, включая actin, tubulin, vimentin, dynein, dynamin и изоформы myosin [57-61]. Среди них dynein/dynamin комплекс, как полагают, обеспечивает зависие от микротрубочек образование кластеров ERGIC [16,62], тогда как myosin VI м. стабилизировать мембраны Golgi в центросомной области или помогает обеспечивать события post-Golgi почкования [60]. Вместе эта группа Arf1-зависимых белков и взаимодействующих с ними партнеров м. выполнять следующие функции: во-первых, ещё больше дифференцировать липидную среду в ER экспортных сайтах, так чтобы энзимы и грузы Golgi м. отсортировываться в этих сайтах; во-вторых, облегчает отсоединение глобулярно-тубулярных кластеров (т.е. ERGIC) теперь от груз-загружающих областей ER экспортных сайтов; в-третьих, обеспечивает образование кластеров и слияние этих структур; в-четвертых, стимулирует возвращение специфических мембранных компонентов обратно в ER посредством ретроградного транспорта. Последний процесс д.б. важен для организации carbohydrate-processing энзимов, nucleotide-sugar транспортеров и протоновых насосов внутри Гольджи, так что он д. вести себя взаимодействующая система для быстрой и эффективной конверсии гликопротеидных и гликолипидных субстратов в их продукты.
Доказательства, которые подтверждают критическую роль Arf1 в этом процессе получены благодаря находкам, что когда GTPase активность
Arf1 ингибирована, напр., в клетках, экспрессирующих постоянно неактивную форму Arf1, Arf1 [T31N], или в клетках, обработанных BFA (которые предупреждают Arf1 от связывания с мембранами), то ни один из этих процессов не происходит. Теперь ER домены выхода присутствуют, вместе с динамически локализуемыми COPII белками, p115, матричными белками и рецепторами грузов [12,22,63,64] (Рис. 2a). Рекрутирование Arf1 на мембрану обеспечивается с помощью guanosine exchange factor GBF1, который сам по себе подвергается динамическому связыванию и диссоциации от мембран (Jackson and Lippincott-Schwartz, unpublished). Недавно Sztul и др. показали, что p115 взаимодействует с GBF1 [37]. Т.о., p115 м. регулировать ассоциацию GBF1's с мембранами и тем самым косвенно контролировать рекрутирование на мембрану Arf1's. Это согласуется с находкой, что во время обработки клеток BFA, который, как полагают, инактивирует GBF, p115 продолжает ассоциировать с мембранами
[37]. В BFA-обработанных клетках p115 и Sar1 активности позволяют сформироваться ER экспортным сайтам, но из-за ингибирования Arf1 ER экспортные сайты не образуют обогащенных грузами ERGIC (которые д.б. способными к слиянию, чтобы формировать Golgi).
Уникальная белковая и липидная среда Golgi поддерживается с помощью активности Arf1's, как известно, служит в качестве платформы для сигнальных и регуляторных молекул с разнообразными функциями. Сюда входят гетеротримерные G белки, малый G белок Ras, PKA, PI(3) kinase, IQGAP, eNOS, Nir2, PI4Kb и Cdc42 (см. Box 1). Др. цитоплазматические белки, ассоциированные с Golgi, играют роль в ядре и цитоплазме, включая casein kinase, cyclin B2, tankyrase и членов семейства Cullin и
CtBP/BARS. Кроме того, др. ассоциированные с Golgi белки, являются киназами и активаторами киназ; сюда входят PKC, Myt1 и calmodulin kinases. Наконец, ряд polo-like kinases, которые, как полагали раньше, локализуются в центросомах, находятся однако в Гольджи, включая Plk-3 и Sak1 [5,65]. Эти белки играют роль в регуляции динамики микротрубочек.
Многие из активностей этих сигнальных и регуляторных молекул зависят от мембранной среды Голджи, создаваемой специфически с помощью
 Golgi-associated signaling and regulatory molecules
Golgi-associated signaling and regulatory molecules
Arf1 и его эффекторов. Они подвергаются быстрой диссоциации от Golgi
мембран, когда Arf1 остро инактивируется с помощью BFA
[3,5]. Интересно, что Arf1 инактивируется рано в митозе
[5]. Последующее высвобождение этих сигнальных и регуляторных белков в цитоплазму д. в принципе играть роль в режиссировании митотических процессов, происходящих в цитоплазме. Согласуется с этим то, что когда разборка Гольджи ингибируется во время митозас с помощью воздействий, которые предупреждают инактиваицю Arf1, то Arf1-зависимые Golgi периферические белки не высвобождаются из Golgi и возникают митотические дефекты в сегрегации хромосом и в образовании борозды во время цитокинеза [5]. Это указывает на то, что Arf1-зависимые рассеивание периферических Golgi белков в митозе важно для скоординированного поведения Golgi мембран, хромосом и цитоскелета во время митоза. Инактивация Arf1 во время митоза, т.о., создаёт способ для перераспределения этих белков в цитоплазму, так что они м. выполнять свои митотические функции.
Golgi formation through sequential activity
of Sar1 and Arf1
Многоступенчатый процесс биогенеза Golgi, описанный здесь, по-видимому, режиссируется последовательно с помощью GTPase активностей Sar1 и Arf1 и их эффекторов (Рис. 3). В этой схеме, активность Sar1 GTPase инициирует процесс биогенеза аппарата Гольджи с помощью COPII-обеспечиваемой сортировки специфических интегральных мембранных белков (напр., ERGIC53, p24 белков и KDEL рецептора) в ER субдомены. Образование кластеров этих белков приводит к изменениям в толщине бислоя и композиции этих сайтов, что ведет к рекрутированию и активированию молекул, подобных Rab1, которые в свою очередь рекрутируют p115 в эти сайты. Способность P115 взаимодействовать с SNAREs и матричными белками, затем обусловливает появление ER экспортных сайтов, чтобы дифференцироваться в ERGIC (т.е., незрелый Golgi) путем стимулирования трансформации мембран и событиям слияния в этой локальной области. (Будучи сформированным Golgi обеспечивает Rab1-
и Rab2-обусловленное рекрутирование p115 и его партнеров, что продолжает стимулировать трансформацию мембраны, события прикрепления и слияния в мембранах Гольджи).
Активность Arf1 в ER экспортных доменах позволяет этим доменам трансформироваться в динамические транспортные промежуточные образования, способные упаковывать разнообразные типы секреторных грузов, отсортировывать избранные молекулы обратно в ER и транслоцироваться через цитоплазму. Слитые вместе эти промежуточные образования представляют собой Golgi. Активация Arf1 м.б. результатом рекрутирования GBF1 с помощью
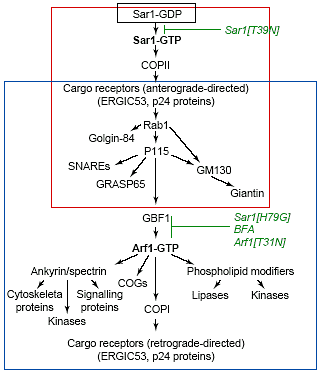 Fig. 3. Schematic organization of Golgi biogenesis. (a) Recruitment of proteins involved in the biogenesis of the Golgi as a steady-state system is based on the sequential GTPase activities of Sar1 and Arf1. Note that different sets of interacting protein pathways associate with different compartments :ER (black box), ER export domain (red box), ERGIC and Golgi membranes (blue box).
Fig. 3. Schematic organization of Golgi biogenesis. (a) Recruitment of proteins involved in the biogenesis of the Golgi as a steady-state system is based on the sequential GTPase activities of Sar1 and Arf1. Note that different sets of interacting protein pathways associate with different compartments :ER (black box), ER export domain (red box), ERGIC and Golgi membranes (blue box).
p115, т.к. GBF1 является скорее всего guanosine exchange фактором для
Arf1 [37,64]. Будучи активированным Arf1 активирует мембраны ER экспортных сайтов, он рекрутирует большие количества эффекторных белков
(включая ankyrin, spectrin, COPI, сигнальные белки и
phospholipid-модифицирующие белки), это позволяет ER экспортному домену трансформироваться сначала в ERGIC , а затем в мембраны Golgi. Этот процесс использует функциональную, а также морфологическую трансформацию мембран, т.к. структуры, представляющие ER экспортные сайты и ERGIC (т.е., кластеры трубочек и пузырьков) отличаются по своему виду от тех, что представляют собой Golgi (т.е., компактные. уплощенные стеки из цистерн). Необходимо установить, какие ассоциированные с Golgi белки ответственны за превращения Golgi мембран в уплощенные стеки цистерн и как это происходит [66,67]. Наблюдение за поведением ER мембран показало, что они способны к драматическому ремоделированию из ретикулярной сети в плотные стеки цистерн (напоминающие Golgi и др. органеллы. организованные в стеки) после избыточной экспрессии ER белков с цитоплазматическими доменами, способными испытывать взаимодействия низкого сродства [68]. Сходный механизм, следовательно, м. объяснить и то, как Golgi приобретает свои специфические морфологические очертания.
Итак, Arf1 и Sar1 последовательно инактивируются и затем ре-активируются во время митозов [5,69]. Это открывает возможность того, что активности этих GTPases имеют отношение к многоступенчатому процессу митогенной сборки Golgi [5]. Необходимы дальнейшие исследования в этом направлении
[5,70–72].
Conclusions
The Golgi apparatus is a steady-state organelle that can
be assembled from the ER de novo in the absence of any
pre-existing structure. This de novo assembly depends on
the sequential activities of Sar1 and Arf1. Sar1 activity
leads to the initial recruitment of numerous peripheral
proteins to ER export domains (including Rab1, p115,
SNAREs and matrix proteins) that permit these domains
to differentiate into ERGIC. These structures are then
further differentiated by the activity of Arf1 and its
numerous effectors, producing Golgi membranes
(enriched in secretory cargo and processing enzymes)
that are morphologically and geographically distinct from
ER. Of the many Golgi-associated proteins whose functions
remain to be unraveled, several are likely to be
involved in modulating the activities of Sar1, Arf1 and its
effectors. Others may not be involved in Golgi biogenesis
or maintenance at all, but function as a consequence of
the Golgi’s steady-state structure. These include the
following: glycosylating enzymes; molecules with roles
in exporting cargo out of the Golgi to the plasma membrane
or endosomal system (e.g. Arl family [73]); proteins
that integrate Golgi structure with the cytoskeleton (e.g.
COGs [74]); and molecules that use Golgi membranes
as a platform for regulating signaling events [55,75,76].
A challenge for the future is to understand how all of the
Golgi-associated proteins interact with each other to
maintain the Golgi’s complex structure and diverse
cellular functions.
Сайт создан в системе
uCoz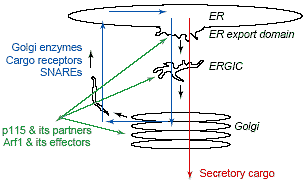 Trafficking itineraries of proteins associated with the Golgi apparatus. All proteins that associate with the Golgi do so only transiently before moving to other destinations in the cell. Integral membrane and luminal proteins enter the Golgi via transport intermediates formed from ER export sites. Among those are cargo proteins (red) that pass through the Golgi to the cell surface or other cellular destinations and Golgi resident components (blue)(including Golgi enzymes, cargo receptors and SNAREs specific to the ER-Golgi system) which return to the ER through retrograde transport intermediates. Cytoplasmic proteins associated with the Golgi (green) (including Arf1 and its effectors, p115 and its binding partners) continuously bind to and dissociate from ER export domains, ERGIC or Golgi membranes.
Trafficking itineraries of proteins associated with the Golgi apparatus. All proteins that associate with the Golgi do so only transiently before moving to other destinations in the cell. Integral membrane and luminal proteins enter the Golgi via transport intermediates formed from ER export sites. Among those are cargo proteins (red) that pass through the Golgi to the cell surface or other cellular destinations and Golgi resident components (blue)(including Golgi enzymes, cargo receptors and SNAREs specific to the ER-Golgi system) which return to the ER through retrograde transport intermediates. Cytoplasmic proteins associated with the Golgi (green) (including Arf1 and its effectors, p115 and its binding partners) continuously bind to and dissociate from ER export domains, ERGIC or Golgi membranes. 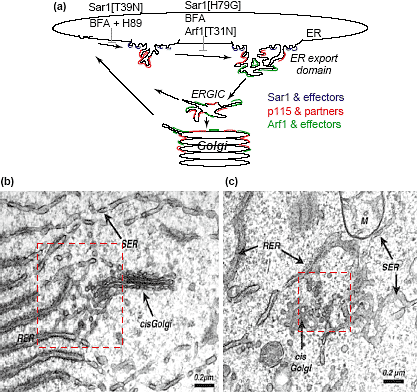 Fig. 2. ER to Golgi transition. (a) Effects of mutations in Sar1 and Arf1, as well as the drugs BFA and H89 on assembly of ER export domains. (b,c) Ultra-structure of endoplasmic reticulum and Golgi apparatus in COS-7 cells. Note the fenestration of the cis-Golgi in (c) and the continuity of membranes between the smooth ER and the Golgi in both (b) and (c) within these cells. The dashed red box indicates the complex organization of an ER export domain.
Fig. 2. ER to Golgi transition. (a) Effects of mutations in Sar1 and Arf1, as well as the drugs BFA and H89 on assembly of ER export domains. (b,c) Ultra-structure of endoplasmic reticulum and Golgi apparatus in COS-7 cells. Note the fenestration of the cis-Golgi in (c) and the continuity of membranes between the smooth ER and the Golgi in both (b) and (c) within these cells. The dashed red box indicates the complex organization of an ER export domain.  Golgi-associated signaling and regulatory molecules
Golgi-associated signaling and regulatory molecules Fig. 3. Schematic organization of Golgi biogenesis. (a) Recruitment of proteins involved in the biogenesis of the Golgi as a steady-state system is based on the sequential GTPase activities of Sar1 and Arf1. Note that different sets of interacting protein pathways associate with different compartments :ER (black box), ER export domain (red box), ERGIC and Golgi membranes (blue box).
Fig. 3. Schematic organization of Golgi biogenesis. (a) Recruitment of proteins involved in the biogenesis of the Golgi as a steady-state system is based on the sequential GTPase activities of Sar1 and Arf1. Note that different sets of interacting protein pathways associate with different compartments :ER (black box), ER export domain (red box), ERGIC and Golgi membranes (blue box).