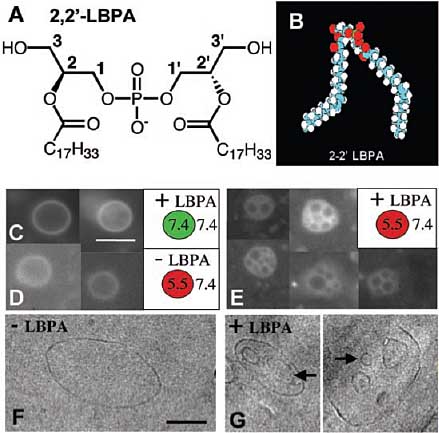
Чтобы проследить процесс инвагинации двойного слоя, липосомы обрабатывали нейтральной pH и затем ацидифицировали с помощью инкубации при pH 5.5 с protonophore nigericin. После удаления лекарства с помощью быстрой хроматографии и нейтрализации внешней pH липосомы инкубировали с водорастворимой окраской 8-hydroxypyrene-1,3,6-trisulfonic acid (HPTS).
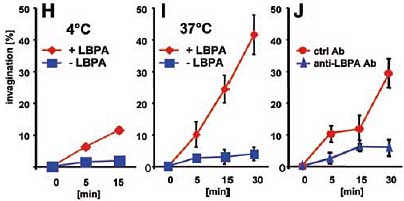
Затем окраску, оставшуюся во внешней среде, избирательно удаляли с помощью p-xylenebis-pyridinium bromide (DPX) (10, 17). Липосомы, содержащие LBPA, обнаруживали высоко достоверную способность включать HPTS и при 4°C (>10% объёма липосом)и 37°C (~5.75 µl/µmol липида или ~40% объёма липосом) по сравнению с контролем, лишенным LBPA (4% объёма липосомы) (Fig. 1, H и I, и Table 1). Эти липосомы сохраняли также способность формировать MVLs (Table 1), с большей готовностью, чем липосомы, обработанные при pH 5.5 (Fig. 1E). Кроме того, антитела против LBPA (3), но не изотипические контрольные антитела, ингибировали процесс инвагинации (Fig. 1J) и образования MVL
(Table 1), подтверждая роль LBPA в образовании внутри-липосомальных пузырьков. Сходным образом, антитела предупреждали образование MVLs при бработке pH 5.5, если они присутствовали во время ступени нейтрализации pH (Table 1). Т.о., процесс инвагинации м.б. воссоздан при ацидификации липосом, содержащих LBPA, это воспроизводит ацидификацию эндосом, которая происходит
In vivo, формирование (и динамика) внутренних мембран внутри поздних эндосом, по-видимому, контролируется с помощью белков. После инкубации в цитозоле мы нашли 5 белков, избирательно рекрутируемых на LBPA липосомы, но не контролирующие липосомы. Один из этих белков идентифицирован с помощью tandem mass spectrometry как Alix, цитозольный партнёр ALG-2 (18), который также присутствует в экзосомах (19)и phagosomes (20). Дрожжевой гомолог
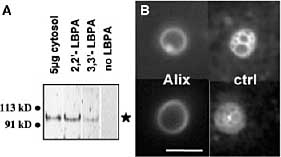
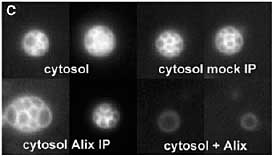
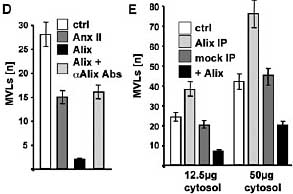
Alix, Vps31p (известный также как Bro1p или Npi3p), участвует в биогенезе мультивезикулярных эндосом, вообще-то вместе с или нижестоящим endosomal sorting complex III required for transport (ESCRT-III) (21). Более того, Alix взаимодействует с ESCRT белками и подобно ESCRT белкам играет роль в почковании вируса иммунодефицита у людей на плазматических мембранах (22, 23). Цитозольный Alix преимущественно рекрутируется с помощью липосом, содержащих 2,2'-dioleoyl LBPA (2,2'-LBPA) (Fig. 2A). Без цитозоля, очищенный, рекомбинантный Alix (24) строго ингибирует образование MVL (Fig. 2, B и D), не влияя на липосомную pH, и это ингибирование частично устраняется с помощью антител к Alix (Fig. 2D). Связывающий фосфолипиды белок annexin II (25),
использованный в качестве контроля, снижает образование MVL, но в значительно меньшей степени, чем Alix (Fig. 2D). Хотя цитозоль эффективно поддерживает образование MVL дозово-зависимым образом (Fig. 2,
C и E), избыток очищенного Alix ингибирует образование MVL. Напротив, иммуно-истощение Alix
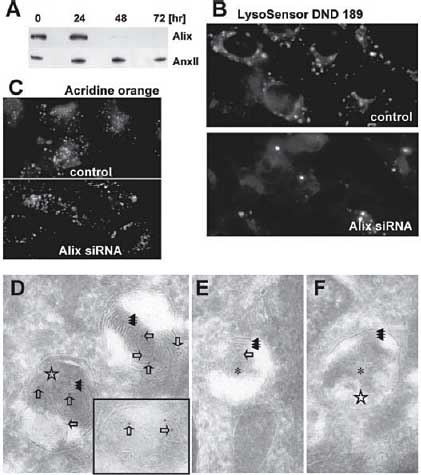
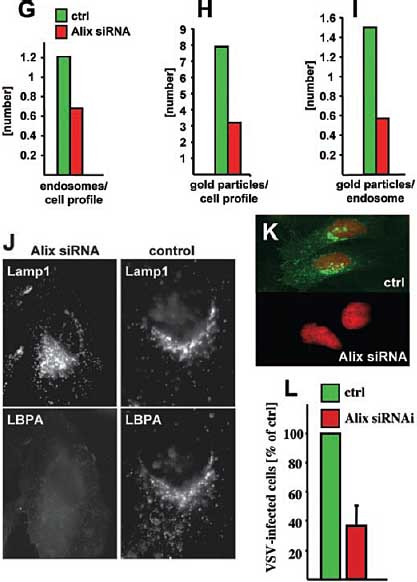 Fig. 3. Alix downexpression. (A) HeLa cells were transfected for the
indicated time with siRNA1, and analyzed by Western blotting, with the
use of antibodies against Alix and annexin II (Anx II). (B and C) Cells
transfected with siRNA1 for 72 hours, as in (A), or mock transfected
(control), were stained with LysoSensor DND189 (B) or acridine orange
(C) and analyzed by fluorescence microscopy. (D to F) Cryosections of
cells transfected with Alix siRNA1 [(E) and (F)] or mock transfected (D)
were immunogold labeled with antibodies to LBPA. Open arrows point at
gold particles; black triple arrows and stars indicate multilamellar and
vesicular regions, respectively; asterisks show late endosomes in siRNAtreated
cells with a typical multilamellar/multivesicular morphology but
devoid of labeling. (G to I) The total number of multilamellar late
endosomes (G), the total number of gold particles per cellular profiles (H),
and the number of gold particles per late endosomal profiles (I) were
quantified in 35 flat cell profiles selected at random, each section
containing a nuclear profile. ( J) Alix siRNA1-treated cells and mocktransfected
cells were analyzed by indirect immunofluorescence with
antibodies against LBPA and Lamp1. (K and L) Cells transfected with Alix
siRNA1 or mock transfected were infected with VSV for 3 hours, labeled
with antibodies against the glycoprotein G (G protein) of VSV and
fluorescein isothiocyanate–labeled secondary antibodies (green), and
analyzed by immunofluorescence (K); cells are identified by nuclear
staining (red). In control infected cells (ctrl), the newly synthesized
VSV–G protein is abundant in the endoplasmic reticulum and the Golgi
complex, whereas the number of infected cells is reduced by Alix siRNA1.
The number of infected cells was quantified (L); data show the mean of
three independent experiments.
Fig. 3. Alix downexpression. (A) HeLa cells were transfected for the
indicated time with siRNA1, and analyzed by Western blotting, with the
use of antibodies against Alix and annexin II (Anx II). (B and C) Cells
transfected with siRNA1 for 72 hours, as in (A), or mock transfected
(control), were stained with LysoSensor DND189 (B) or acridine orange
(C) and analyzed by fluorescence microscopy. (D to F) Cryosections of
cells transfected with Alix siRNA1 [(E) and (F)] or mock transfected (D)
were immunogold labeled with antibodies to LBPA. Open arrows point at
gold particles; black triple arrows and stars indicate multilamellar and
vesicular regions, respectively; asterisks show late endosomes in siRNAtreated
cells with a typical multilamellar/multivesicular morphology but
devoid of labeling. (G to I) The total number of multilamellar late
endosomes (G), the total number of gold particles per cellular profiles (H),
and the number of gold particles per late endosomal profiles (I) were
quantified in 35 flat cell profiles selected at random, each section
containing a nuclear profile. ( J) Alix siRNA1-treated cells and mocktransfected
cells were analyzed by indirect immunofluorescence with
antibodies against LBPA and Lamp1. (K and L) Cells transfected with Alix
siRNA1 or mock transfected were infected with VSV for 3 hours, labeled
with antibodies against the glycoprotein G (G protein) of VSV and
fluorescein isothiocyanate–labeled secondary antibodies (green), and
analyzed by immunofluorescence (K); cells are identified by nuclear
staining (red). In control infected cells (ctrl), the newly synthesized
VSV–G protein is abundant in the endoplasmic reticulum and the Golgi
complex, whereas the number of infected cells is reduced by Alix siRNA1.
The number of infected cells was quantified (L); data show the mean of
three independent experiments.
из цитозоля заметно стимулирует образование MVL, в то время как контрольные антитела не оказывают эффекта (Fig. 2, C и E). Если экспрессия Alix замалчивается с помощью small interfering RNAs (siRNAs) в клетках HeLa (Fig. 3A), то количество кислых, поздних эндоцитических компартментов, по-видимому, снижается (Fig. 3B), тогда как признаки ацидификации др. органелл (таких как ранние эндосомы и trans-Golgi network) по-видимому, не затрагиваются ( Fig. 3C). С помощью EM, LBPA (Fig. 3, D и E, open arrows) обнаруживается в клетках HeLa как в мультиламеллярных областях (Fig. 3D, black triple arrow) так и в мультивезикулярных областях (Fig. 3D, star and inset), часто внутри одних и тех же поздних эндосом. Соответственно, Alix siRNAs уменьшает количество поздних эндосом, содержащих multilamellar области (которые однозначно м.б. идентифицированы на срезах) (Fig. 3B), тогда как др. органеллы, включая комплекс Golgi , по-видимому, не затрагиваются (Fig. 3G).
Биохимический анализ показывает, что подавление Alix редуцирует LBPA до ~50% от контрольного уровня. Соответственно, окрашивание LBPA в Lamp1-позитивных поздних эндосомах снижается при иммунофлюоресценции (Fig.
3J), как и общее количество anti-LBPA золотых частиц на клеточный профиль (Fig. 3H) и на поздние эндосомы endosomes (Fig. 3, E and F,
quantification in I) с помощью EM. Vesicular stomatitis virus (VSV) инфицирует клетки с помощью эндоцитотического пути, но не с помощью ранних эндосом (26, 27). Кислая эндосомная pH запускает слияние оболочки VSV с эндосомными мембранами, позволяя nucleocapsid проникнуть в цитоплазму. Вирусная инфекция (Fig. 3K, quantification in L) ингибируется с помощью подавления Alix, по-видимому, благодаря снижению количества кислых поздних эндосом. Напротив, Alix-зависимая динамика мембран поздних эндосом м.б. необходима для эффективного высвобождения nucleocapsid. Установлено, что LBPA обладает способностью управлять образованием инвагинаций мембраны внутри кислых липосом. Мы также установили, что Alix контролирует этот процесс инвагинации in vitro и организацию LBPA-содержащих эндосом in vivo. Мы полагаем. что внутренние пузырьки и лимитирующая мембрана взаимодействуют динамически посредством событий деления и слияния и что процесс деления контролируется, по крайней мере частично, с помощью временных взаимодействий между LBPA мембранами и Alix (28), по-видимому. вместе с др. факторами, включая и ESCRT белки (22, 23).
Сайт создан в системе
uCoz