Установление собственно LR асимметрии нуждается в сложной и высоко регулируемой сети позитивных и негативных взаимодействий разных членов сверхсемейства transforming growth factor-β (TGF-β) сигнальных молекул (Рис.1). Nodal является секретируемым фактором, принадлежащим к сверхсемейству TGF-β, что сокращает эти потребности, т.к. экспрессия,
- в левой части LPM необходима для установления собственно направленной асимметрии у всех изученных позвоночных [5]. В случае эмбрионов рыбок данио, однако, лево-сторонняя экспрессия родственного
в LPM начинается только где-то в середине сомитогенеза, тогда как др. родственные
гены не выявляются в LPM. Всё это вместе с фактом, что генетические мутации любого из генов не обнаруживают очевидных LR дефектов, вызывает сомнения в том, является или нет критической роль асимметричной передачи сигналов Nodal в развитии LR законсервированной у рыбок данио. Однако, новый ген Nodal-related у рыбок данио,
, был охарактеризован и было показано. что он экспрессируется в левой LPM уже на ранних стадиях сомитогенеза, т.е., еще до LR проявления асимметричной экспрессии
[6]. Важно, что подавление функции
приводит к потере направленной LR висцеральной асимметрии и экспрессии нижестоящих left-специфичных генов, таких как
у мышей. Эти находки Long et al. дают строго подтверждение существования консервативного генетического модуля, инициируемого с помощью лево-сторонней передачи сигналов Nodal в LPM, который служит орудием для трансляции направленной информации LR асимметрии в зачатки органов.
В дополнение к уже экспрессируемому в левой LPM, ранний домен экспрессии Nodal выявляется вокруг организатора у эмбрионов мышей (узелка) и кур (Гензеновского узелка) сразу после гаструляции. Long et al. [6] описали также экспрессию
spaw, фланкирующую зачаток хвоста у эмбрионов рыбок данио на стадии 4-6-сомитов, в тесном соединении с
Kupffer's пузырьком (эквивалентом у рыбок данио дефинитивного узелка мышей). Однако, в то время как асимметрия в экспрессии домена Nodal в LPM
становится выраженной и законсервированной среди видов, то LR различия в самом раннем около-nodal домене находятся в пределах от видимой асимметрии в случае эмбрионов кур до билатеральной симметрии у рыбок данио и лишь до едва заметной, преходящей асимметрии в случае мышей. Следовательно, будет ли ранней домен экспрессии Nodal вокруг узелка связан механистически с более поздним доменом экспрессии в LPM и в самом ли деле peri-nodal экспрессия Nodal может быть важной для детерминации LR асимметрии, остается открытым вопросом. Элегантные трансгенные подходы у мышей с использованием специфического устранения экспрессии Nodal вокруг узелка, пролили некоторый свет на этот вопрос [7,8]. В первом исследовании Brennan et al. [7] избирательно снижали уровень экспрессии
Nodal вокруг узелка, с помощью делеции 2.7kb node-specific enhancer (NDE) элемента. У эмбрионов мышей, гомозиготных по этой делеции, домен peri-nodal экспрессии
Nodal существенно ослаблялся, но тот, что находился в левой LPM оставался неизменным, т.к. происходило нормальное LR размещение органов. Дальнейшее снижение экспрессии
Nodal вокруг узелка достигалось комбинированием 2.7kb делетированного аллеля с нулевым аллелем
Nodal. В этом случае удаление peri-nodal экспрессии
Nodal давало в результате неспособность индуцировать лево-стороннюю экспрессию
Nodal в LPM, терялась также и направленная LR асимметрия органов, это указывало на то, что домен самой ранней экспрессии
Nodal вокруг узелка необходим для размещения специфичного для левой стороны генетического модуля в LPM. Дальнейшее подтверждение этой гипотезы получено в исследовании разных гипоморфных аллелей
Nodal, полученных во время анализа предполагаемого вторичного Nodal asymmetric enhancer [8]. Т.к. делеция этого энхансера не вызывала молекулярных или фенотипических LR дефектов, то авт. нашли, что инсерция selection marker cassette дает гипоморфные аллели
Nodal, характеризующиеся строгим подавлением и отсутствием peri-nodal и LPM Nodal доменов экспрессии, соотв. и рандомизированной LR асимметрией органов [8]. Более того, Saijoh et al. оказались способны устранить как молекулярные так и фенотипические LR дефекты этих гипоморфных мутаций с помощью или избыточной экспрессии
Nodal специфически в peri-nodal области или путем целенаправленного удаления selection marker cassette в клетках вокруг узелка [8]. Всё это открывает новую критическую ступень в переносе LR asymmetric информации от раннего организатора к LPM и зачаткам органов, следовательно, временный домен экспрессии
Nodal вокруг узелка позволяет LR сигналам транслироваться на более широкие, более стабильные домены генной экспрессии в LPM.
Transferring leftness to the lateral plate
mesoderm
Ясно, что механизм, с помощью которого peri-nodal экспрессия
Nodal индуцирует экспрессию
Nodal в LPM, м.б. или прямым - Nodal, высвобождаемый из области узла д. передавать сигналы клеткам в LPM, понуждая их экспрессировать Nodal - или непрямым, т.е. посредством промежуточных факторов. У эмбрионов кур,
Caronte, член семейства Cerberus/Dan секретируемых факторов, экспрессируется в левой около-нодальной области и обеспечивает экспрессию
Nodal в левой LPM [9-11]. Поиск функциональных гомологов куриного Caronte у др. позвоночных не увенчались успехом, но были идентифицированы др. члены семейства Cerberus/Dan, которые, по-видимому, участвуют в детерминации LR асимметрии. Так, мышиный
Dante экспрессируется более строго в правой peri-nodal области, хотя функция его неизвестна [12]. Недавно новый член Cerberus/Dan у рыбок данио, кодируемый
charon, был охарактеризован [13].
charon экспрессируется в области хвостовой почки, фланкирующей Kupffer's пузырек, в домене, соседствующем с тем, что экспрессирует
spaw.
In vitro иммунопреципитация показала, что
charon соединяется с
spaw, это в комбинации с результатами экспериментов по избыточной экспрессии
charon у эмбрионов рыбок данио, указывает на то, что
charon м. функционировать, противодействуя передаче сигналов Nodal, возможно инициированный с помощью
spaw. Более того, подавление функции
charon дает в результате дефекты формирования LR паттерна и неспособность вызывать лево-стороннюю экспрессию
spaw, cyclops, lefty1,
и pitx2 в LPM. Интересно, что эти дефекты не были ассоциированы с морфологическими или молекулярными изменениями развития дорсальной срединной линии [13]. Хотя точный механизм функции
charon во время LR развития неясен, мало вероятно, что он обеспечивается переносом экспрессии
spaw из области хвостовой почки в LPM.
Несколько линий доказательств говорят в пользу прямого механизма переноса экспрессии
Nodal из около-нодальной области в левую LPM, по крайней мере, у эмбрионов мышей и рыбок данио: во-первых, Nodal-related лиганды, такие как
squint, на самом деле способны передавать сигналы на расстояния от источника [14]; во-вторых, экспрессия
Nodal в LPM нуждается в Nodal-подобном сигнале, передаваемом внутри клеток с помощью FoxH1 [15-17]; и, в-третьих, экспрессия
Nodal в LPM нуждается в присутствии Nodal ко-рецепторов из семейства EGF-CFC [18,19]. Однако, недавние находки вызывают некоторые сомнения в прямоте этого механизма и указывают на то, что в действительности ситуация м.б. намного сложнее. Т.о., Cheng et al. [20] открыли, что некоторые члены семейства EGF-CFC, такие как
one-eye pinhead у рыбок данио и
Cripto и Cryptic у мышей,
функционируют как ко-рецепторы TGF-β сигналов, которые включают не только Nodal, но и также членов сверхсемейства Vg1/GDF1 (Vg1 у Xenopus, chick, and zebrafish; GDF1 у мышей) во время индукции мезодермы у рыбок данио. Важно, что потребность в EGF-CFC ко-рецепторах для передачи сигналов, по-видимому, высоко лиганд-специфична, т.к. Activin м. индуцировать мезодермальные маркеры у рыбок данио в отсутствие функции
one-eye pinhead. Последующий анализ в той же самой группе картировал в точности мотив, который ограничивает EGF-CFC-независимость к Activin 14 аминокислотам, кодируемых петлей и β8 областью ActivinβA [21].
Значение потребности в EGF-CFC для передачи сигналов Vg1/GDF1 не была изучена в контексте детерминации LR асимметрии, Однако, тот факт, что
Gdf1 мутантные эмбрионы мышей обладают дефектами LR [22], неотличимыми от таковых у
cryptic мутантов [18,23], также как неспособность установления лево-стороннего домена экспрессии
Nodal в LPM, открывает возможность, что передача сигналов Vg1/GDF1 и/или кооперация с Nodal продуцируется в peri-nodal области для активации Nodal и др. нижестоящих 'leftness' генов в LPM.
Дальнейшее подтверждение этой гипотезы получено при анализе специфичности TGF-β рецепторов во время детерминации LR асимметрии у эмбрионов
Xenopus [24]. TGF-β лиганды передают сигналы путем сборки комплексов типа I и типа II рецепторов, это ведет к фосфорилированию первых с помощью последних. В частности, типа II TGF-β рецептор ActRIIB и тапа I рецепторы ALK4 и ALK7, как было установлено, обеспечивают большую часть функций по передаче сигналов Nodal, Vg1/GDF1, и Activin [25]. Выбор рецепторов типа I, однако, по-видимому, лиганд- и контекст-специфичен. Т.о., хотя и Nodal и Vg1/GDF1 действуют посредством ALK4, чтобы индуцировать спецификацию мезодермы у эмбрионов
Xenopus, но только передача сигналов Vg1/GDF1 обеспечивается с помощью этого рецептора в контекста LR развития [24]. Напротив. др. гены, не связанные с сверхсемейством TGF-β, м. участвовать в переносе экспрессии
Nodal из peri-nodal области в левую LPM. В лаб. Hiroshi Hamada's в сотрудничестве с группой Yoshihide Hayashizaki's из RIKEN Genomic Science Center был проведн поиск таких кандидатов с помощью анализа микро-массивов (micro-array) в левой по сравнению с правой половиной у ранних эмбрионов мышей. В результате Hou et al. [26]
идентифицировали LPlunc1, члена сверхсемейства BPI/PLUNC, экспрессия которого у ранних эмбрионов ограничена peri-nodal областью, тесно следуя за экспрессией
Nodal. Интересно, что экспрессия
LPlunc1 обнаруживает четкую склонность к левой стороне в этой области между стадиями 2- и 7-сомитов, которая теряется у эмбрионов, гомозиготных по мутациям
inversus viscerum (iv) или
inversion of turning (inv), но не зависит от функции Nodal [26]. Хотя информация о функции LPlunc1's отсутствует, но др. члены сверхсемейства BPI/PLUNC участвуют в транспорте липидов, это позволяет предположить, что возможную связь между связыванием и переносом липидов и переносом лево-сторонней информации во время детерминации LR асимметрии.
Передача сигналов Nodal в левую LPM во времени и в пространстве ограничивается с помощью антагонизма, осуществляемого Lefty(s), дивергентными членами сверхсемейства TGF-β, чья экспрессия, в свою очередь, зависит от активности Nodal [3]. Существование этой негативной петли обратной связи было постулировано для объяснения регуляции степени передачи сигналов Nodal в LPM и для предупреждения распространения leftness генов, включая предупреждение распространения Nodal в правую LPM [3]. Пролит свет на механизм, с помощью которого Lefty противодействует передаче сигналов TGF-β и выявлены новые уровни сложности внутри этой регуляторной петли обратной связи. Cheng et al. [21] и Chen and Shen [27], убедительно показали, что важным механизмом действия Lefty's является блокирование функции EGF-CFC ко-репрессоров. Это привело обе группы к открытию, что Lefty эффективно противодействует передаче сигналов с помощью субнаборов TGF-β лигандов, включая Nodal и Vg1/GDF1, но не Activin [21,27], и с помощью их способности индуцировать мезодерму у эмбрионов рыбок данио [21]. Т.к. EGF-CFC ко-рецепторы необходимы для передачи сигналов Nodal и Vg1/GDF1 , но безразличны для функции Activin, то обе группы проверяли м. ли антагонизм Lefty's к передаче сигналов TGF-β быть обусловлен блокадой функции EGF-CFC. В самом деле, Lefty
оказалось физически взаимодействует с EGF-CFC, блокируя тем самым связывание Nodal (а наиболее вероятно также и Vg1/GDF1) с комплексом receptor-co-receptor. В дополнение к непрямому, EGF-CFC-обусловленному, антагонизму передаче сигналов TGF-β с помощью Lefty, Chen and Shen выявили также и прямое взаимодействие между Nodal и Lefty, которое предупреждает соединение Nodal с рецепторным комплексом в отсутствие EGF-CFC ко-рецепторов [27]. Относительная роль любого механизма ограничения передачи сигналов TGF-β в левую LPM в контексте детерминации LR асимметрии остается неизученной (см. [28]). Было бы интересно оценить участие Tomoregulin-1 (TMEFF1), трансмембранного белка, который противодействует передаче сигналов Nodal, но не Activin [29], блокируя EGF-CFC ко-рецепторы [30] во время развития LR.
Getting to the node: translation of epigenetic
left-right information
Хотя несколько механизмов описано выше для экспрессии
Nodal в LPM, ни один из них, по-видимому, не отвечает за инициальный домен экспрессии вокруг узелка. Т.о., хотя экспрессия
Nodal в LPM отсутствует у
Gdf1 или
Cryptic мутантных эмбрионов мышей, peri-nodal экспрессия
Nodal сохраняется в любом случае [18,22,23]. Было показано, что домены экспрессии
Nodal вокруг узелка и в левой LPM регулируются разными энхансерами в гене
Nodal [31,32]. NDE картированные в 0.8kb [31] или 2.7kb [32] элементы локализованы ~9.1kb выше гена
Nodal мыши, затем был связан с фрагментом в 0.35kb [7]. Идентичность специфических транскрипционных факторов, соединяющихся с Nodal NDE не была изучена непосредственно. Однако, присутствие предположительно эволюционно законсервированного сайта связывания для Foxa2 (первоначально известного как Hnf3b) внутри Nodal NDE указывает на возможность того, что экспрессия
Nodal вокуг узелка д. регулироваться с помощью
Foxa2 [7]. Для подтверждения этой возможности получены химерные эмбрионы из
Foxa2 мутантных ES клеток, лишенных peri-nodal экспрессии
Nodal, хотя интерпретация этого анализа затруднена тем фактом, что дефинитивный узелок не образуется у этих эмбрионов [33].
Недавно прямая проверка регуляции экспрессии
Nodal вокруг узелка выявила критическую роль пути передачи сигналов в этом процессе [34,35]. Т.о., анализ у мышей Nodal NDE выявил существование двух предсказанных сайтов для CSL ДНК-связывающего белка, транскрипционного медиатора передачи сигналов Notch. Функциональность этих сайтов связывания подтверждена
in vitro с помощью electrophoretic mobility shift assays и трансгенных подходов
in vivo. Мутация в любом CSL-связывающем сайте Nodal NDE существенно снижали
in vitroсоединение с рекомбинантным CSL, а мутации обоих сайтов устраняли node-специфическую экспрессию Nodal репортерной конструкции [34,35]. Роль передачи сигналов Notch для развития LR у позвоночных впервые была установлена на мышах, мутантных по Notch лиганду Delta-like 1 (Dll1) [36]. Przemeck et al.полагают, что латеральные дефекты, наблюдаемые у Dll1-/- эмбрионов мышей, были результатом альтераций в развитии узелка и структур срединной линии [36]. Однако, последующий анализ LR фенотипа у мутантных эмбрионов
Dll1 [34,35] выявил неспособность к установлению LR направленной асимметрии у этих животных в отсутствие дефектов узелка/срединной линии. Эти результаты в дальнейшем подтвердились на мышах, дефицитных по др. компонентам пути передачи сигналов Notch, таким как
Notch1/Notch2 двойные мутанты [34] и
RBPjk мутанты [35]. Важно, что молекулярные дефекты, лежащие в основе альтерации детерминации LR асимметрии, выявленые у этих мутантов, заключались в отсутствии экспрессии Nodal вокруг узелка. Эти результаты подтверждают мнение, что экспрессия
Nodal вокруг узелка необходима для установления лево-стороннего домена Nodal в LPM [7,8], и выявлена ключевая роль передачи сигналов Notch для регуляции node-специфической экспрессии Nodal.
Поразительным свойством домена peri-nodal экспрессии
Nodal является то, что даже несмотря на то, что его присутствие является критическим для лево-сторонней экспрессии
Nodal в LPM, и , следовательно, для собственно предопределения LR асимметрии, LR асимметрия в этом домене сама по себе варьирует у разных видов. Так, экспрессия
Nodal у эмбрионов кур выразительно ограничена левой строгой Гензеновского узелка, LR асимметрия вокруг узелка у мышей едва обнаружима и совсем не выявляется у эмбрионов рыбок данио. Эти расхождения скорее всего отражают различия в асимметрии вышестоящих событий, включая активность Notch. В нашей лаб. занимались этой гипотезой путем анализа динамики генной экспрессии и взаимодействий среди компонентов пути передачи сигналов Notch во время стадии, которая предшествовала peri-nodal экспрессии
Nodal у эмбрионов кур [37]. Мы сформулировали математическую модель, которая объясняет эту динамику и м. позволить проверить, какие факторы м. лежать в основе LR асимметричной активности Notch. Модель предсказывает, что небольшие изменения в скорости связывания Notch и его лигандов Dll1 или Serrate1 м.б. умножены с помощью серии позитивных регуляторных петель обратной связи, так что экспрессия
Nodal сможет быть индуцирована раньше и более сильно на одной из сторон узла. Очевидно, что скорость связывания Notch-Dll1 и Notch-Serrate1 комплексов зависит от внеклеточной концентрации Ca2+, a повышенные уровни внеклеточного Ca
2+ временно обнаруживались на левой стороне Гензеновского узелка. Возникновение асимметрии в уровнях внеклеточного Ca
2+ поперек узла затем как-то связывается с дифференциальной LR активностью K+/H+-ATPase, ранее это было предложено Levin et al. для создания LR градиента в мембранных потенциалах [38]. Эти наблюдения привели нас к модели, согласно которой генетическая информация от передне-задней оси сливается с эпигенетическими LR сигналами, приводя к созданию пространственно-временных координат для локальной гипер-активации пути передачи сигналов Notch и последующей экспрессии
Nodal на левой стороне Гензеновского узелка [37].
Conclusions
Almost ten years have passed since the identification of
Nodal as a key player in LR patterning. During this time,
we learned that the function of Nodal is conserved among
vertebrates, but not until last year did we realize that its
role in the game of LR patterning was being played in
different, sequential fields. It is now clear that different
members of the TGF-β superfamily, including Nodal,
control the centerfield once the ball of LR information
has been kicked off. However, Nodal appears not to be
alone as the receiver in the LPM, but rather it forms part
of a complex team of players — TGF-β signals, coreceptors,
and antagonists—whose relative contributions
to LR asymmetry determination will be most probably
elucidated in detail in the near future.
Nodal also acts as the quarterback of the LR patterning
game. It receives the ball hiked by Notch (the center)
and, with the help of its TGF-β teammates, throws it to
the LPM. In the case of the chick, Nodal the quarterback
readily knows where to throw the ball, which is already
hiked from the left. In mouse embryos, Nodal seems to
need additional epigenetic information, perhaps provided
by the directional nodal flow generated by rotation of the
node monocilia. In this respect, the recent description of
two populations of node monocilia — one that would
create the nodal flow, and another one that would sense it
[39]—has provided new mechanistic insights into how
epigenetic information can be amplified within the node
(see perspectives on this subject in [40–42]). Ciliated cells
could provide additional help for the bias of LR information
within the node of zebrafish embryos as well. The
first evidence in this direction came from a recent report
in which translation of
no tail/brachyury was locally downregulated
in dorsal forerunner cells and their progeny in
Kupffer’s vesicle [43]. These manipulations resulted in
defective morphogenesis of Kupffer’s vesicle and associated
LR patterning defects, strongly suggesting that this
structure possesses the LR-organizing capacities of
Hensen’s node in the chick or the ventral node in the
mouse [43]. Whether or not the ciliated nature of the
cells that line this structure is relevant for LR development
remains to be demonstrated. Importantly, however,
the feasibility of upregulating or downregulating the
function of specific genes locally in dorsal forerunner
cells/Kupffer’s vesicle predicts that the zebrafish will
be an invaluable experimental model for the investigation
of early genetic and epigenetic events in the establishment
of LR asymmetry (i.e. what kicks the ball off in the
first place, and how it does it).
Finally, we still have much to learn about the particulars of
the touchdown itself: how organ primordia interpret LR
information so that different side-specific cell behaviors or
tissue dynamics give rise to left- or right-sided organs.
Recent insights in this area have also been gained studying
the zebrafish embryo. For instance, Horne-Badovinac et al.
reported that left and right LPMs undergo asymmetric
migration dynamics, which were dependent on the establishment
of proper spaw and pitx2 expression domains
[44]. Furthermore, the asymmetric migratory behavior
of the LPM was shown to bring about the initial intestinal
leftward bend, which eventually determined the direction
of the gut coiling [44]. A detailed understanding of LR
asymmetric organ placement and morphogenesis will
necessitate the correlation of specific genetic or epigenetic
manipulations known to result in LR patterning defects
with changes in cell behavior or tissue dynamics induced
by such manipulations. The particular amenability of
experimental models such as the zebrafish and chick
embryos to techniques of cell biology and live imaging
will undoubtedly provide us with exciting new developments
in this area in the next few years.
Сайт создан в системе
uCoz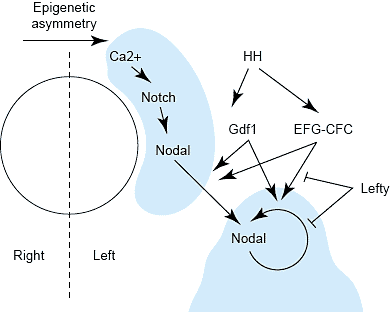 Sequential transfer of LR information. The circle represents the LR organizer - Hensen's node in the chick, ventral node in the mouse, Kupffer's vesicle in the zebrafish - towards which epigenetic LR information is conveyed resulting in a peri-nodal domain of Nodal expression. LR information is then transferred to the LPM by means of a complex interplay of members of the TGF-β superfamily, including signals (Nodal, Vg1/GDF-1), co-receptors (members of the EGF-CFC family), and antagonists (Lefty), regulated by Hedgehog (HH) activity. A second domain of Nodal expression is then established in the LPM in a left-side-specific manner.
Sequential transfer of LR information. The circle represents the LR organizer - Hensen's node in the chick, ventral node in the mouse, Kupffer's vesicle in the zebrafish - towards which epigenetic LR information is conveyed resulting in a peri-nodal domain of Nodal expression. LR information is then transferred to the LPM by means of a complex interplay of members of the TGF-β superfamily, including signals (Nodal, Vg1/GDF-1), co-receptors (members of the EGF-CFC family), and antagonists (Lefty), regulated by Hedgehog (HH) activity. A second domain of Nodal expression is then established in the LPM in a left-side-specific manner.