Эти исследования проливают свет на значение взаимодействий между соматическими клетками и мигрирующими клетками, взаимодействий, которые гарантируют, что развивающиеся гонады будут оккупированы PGCs. Соматические клетки м. играть или пермиссивную роль (напр., путем изменения свойств эпителия средней кишки и тем самым способствуя миграции PGC) или инструктивную роль (напр., в результате продукции отталкивающих и привлекающих сигналов).
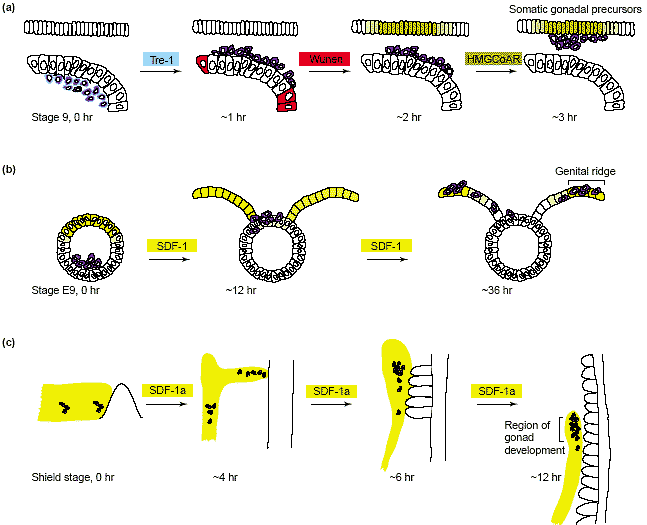
Несмотря на анатомические различия между эмбрионами и на разные способы спецификации PGC [14-16], в принципе пути миграции PGCs мышей сходны с теми, что описаны для дрозофилы. После того как инвагинирует энтодерма, чтобы сформировать заднюю кишку, PGCs обнаруживаются вдоль вентральной стороны формируемого органа. Покидая это место, PGCs активно мигрируют через дорсальный аспект кишки и затем осуществляют непосредственную миграцию в направлении генитального гребня [17,18].
Как и у
Drosophila роль соматической ткани в поддержании направленной миграции продемонстрирована и у мышей. Напр., PGCs, лишенные β1-integrin, не колонизируют эффективно гонады [19]. Эта находка подчеркивает важность взаимодействий между PGC и внеклеточным матриксом. Важно, как продемонстрировали Godin et al. [20]
in vitro, что ткань генитального гребня м. привлекать PGCs, хотя молекулы. ответственные за эту активность неизвестны. Дополнительные молекулы участвуют в ведении PGCs мышей, такие как c-kit рецепторная тирозин киназа, которая экспрессируется в PGCs и ее лиганд Steel, который экспрессируется соматическими клетками вдоль маршрута миграции. Предполагается, что взаимодействие рецептор-лиганд между этими молекулами необходимо для поддержания миграции и жизнеспособности PGCs [21-23], но прямая демонстрация роли Steel как наводящего сигнала все еще отсутствует. Следовательно, вполне возможно, что передача сигналов c-kit играет лишь пермиссивную роль за счет лишь поддержания пролиферации и жизнеспособности мигрирующих PGCs мышей. Наиболее многообещающим кандидатом на роль сигнальной молекулы, которая ведет мышиные PGCs является chemokine
stromal cell derived factor 1 (SDF-1). В контексте проведения PGC, эта молекула была первоначально идентифицирована у рыбок данио [24]. Рецептор для SDF-1, 7-TM доменовый белок CXCR4, экспрессируется в зародышевых клетках мышей, тогда как экспрессия его лиганда на высоком уровне обнаруживается в генитальном гребне и гонадах, мишенях мигрирующих клеток [25,26] (Рис. 1b). Потребность в передаче сигналов chemokine для колонизации PGCs продемонстрирована при изучении процесса у мышей, дефицитных по активности рецептора [26] или лиганда [25]. В обоих случаях спецификация и поступление в кишку, из которой PGCs начинают свою дорсальную миграцию, не затронуты, но мутантные мыши обнаруживают существенное снижение количества PGCs, которые способны достичь генитального гребня. Нарушение колонизации гонад у этих мутантных мышей, по-видимому, отражает двойную роль передачи сигналов CXCR4 в развитии PGC: в дополнение к очевидным дефектам наведения, общее количество PGC снижено, это указывает на то, что CXCR4 участвует в контроле пролиферации и/или выживании [26]. Наилучшее доказательство того, что SDF-1 играет непосредственную роль в проведении PGCs у мышей, получено на живых культурах области задней кишки, где SDF-1 м. влиять на миграцию GFP-меченных PGC [26]. В частности, применение экзогенного SDF-1 ингибирует миграцию PGCs в направлении генитального гребня, возможно путем создания помех генерации позиционной информации с помощью эндогенного лиганда. Боле того, SDF-1-покрытые кусочки, продуцирующие высокие локальные концентрации белка, м. привлекать мигрирующие зародышевые клетки и менять траектории своей миграции.
Как и у
Drosophila миграция мышиных PGC зависит от пермиссивных взаимодействий с соматическими клетками и от инструктивных сигналов, которые ведут их в направлении их мишеней. Наша способность отслеживать процесс миграции, используя slice culture setup, вместе с доступностью мышей, дефицитных по рецепторам и/или лигандам, д. облегчить исследования хемокинами управляемую клеточную миграцию.
Guidance of PGC migration in zebrafish
В противоположность просто организованной миграции из одиночных точек старта у мышей и
Drosophila, PGCs рыбок данио специфицируются в 4-х позициях, которые случайно ориентированы в отношении оси эмбриона [27,28]. Несмотря на эту чрезвычайно сложную ситуацию практически все клетки достигают своих мишеней в течение первого дня развития. Сложность этого процесса особенно наглядна в экспериментах, когда PGCs трансплантировали в область, предназначенную давать головные структуры, которые тем не менее оказались способны достигать гонад [29]. Предпринимаются попытки понять лежащий в основе механизм, который позволяет клеткам достигать своих мишеней, путь миграция PGC у эмбрионов дикого и мутантного типа и поведение PGCs у живых эмбрионов (Рис. 2). Этот анализ привел к определению 6 ступеней миграции, некоторые из которых связаны с активной миграцией, а некоторые с пассивной миграцией в результате которой PGCs переносятся с помощью движений соматических тканей [28,30 ].
Основным заключением из этих исследований было: во-первых, то, что PGCs зависят от сигналов наведения от соматических клеток; во-вторых, что направляющие сигналы являются аттрактантами; в-третьих, что на их пути к гонадам, клетки проходят через домены внутри эмбриона, которые являются промежуточными мишенями [28,30 ,31]. Результаты этих исследований показали, как PGCs достигают общей мишени, независимо от их точки старта. Короче, образуется широкий домен аттрактивных условий в раннем эмбрионе, который включает позиции, где специфицируются PGCs. Динамические изменения на этой стадии формы этого домена
 Active migration of zebrafish PGCs in vivo. Snapshots of PGCs expressing GFP on their membrane showing the formation of cellular protrusions in the leading edge and active migration relative to the weakly labelled neighbouring somatic cells. Photographs taken at intervals of 1 minute and 30 seconds spanning 7 minutes and 30 seconds of development.
Active migration of zebrafish PGCs in vivo. Snapshots of PGCs expressing GFP on their membrane showing the formation of cellular protrusions in the leading edge and active migration relative to the weakly labelled neighbouring somatic cells. Photographs taken at intervals of 1 minute and 30 seconds spanning 7 minutes and 30 seconds of development.
и возникающей в результате миграции PGCs достигает кульминации в накоплении PGCs в двух кластерах в положении, где развиваются гонады.
Молекулой, ответственной за привлечение zebrafish PGCs в направлении их промежуточных и окончательных мишеней, является хемокин SDF-1a, секретируемая молекула, которая экспрессируется в доменах, раннее определенных как привлекающие PGCs (Рис. 1c) [24,31]. У мутантных эмбрионов, у которых паттерн экспрессии SDF-1a изменен в результате аномального соматического развития, миграция PGC изменяется и соответствует новому профили экспрессии гена [24]. Сходным образом экспрессия SDF-1a в эктопических местах достаточна, чтобы привлечь PGCs [24]. Наконец, у эмбрионов, у которых активность SDF-1a [24] или его рецептора CXCR4b [24,32] редуцирована, то клетки достигают эктопических позиций, подтверждая тем самым, что SDF-1a служит в качестве эндогенного направляющего сигнала для PGCs рыбок данио. Клетки, в которых передача сигналов SDF-1a ингибирована, являются подвижными, но в противоположность PGCs дикого типа, они обнаруживают не направляемую миграцию и обладают менее поляризованной клеточной морфологией
[24].
Conclusions
Over the past few years, the field of PGC migration has
advanced significantly, primarily as a result of the identi-
fication of molecules that serve as directional cues for the
cells. These findings make the study of PGC migration, a
classical topic in developmental biology, directly relevant
to work on the development of other organs [33,34], stem
cell homing [35,36], leukocyte trafficking [37,38] and
neuronal cell migration [33,39], in which the same molecules
are utilized. Moreover, the numerous recent demonstrations
of the role of CXCR4 in tumor formation and
the spreading of malignant cells [40,41,42��] make the
research of PGC migration pertinent to this subject too.
The accessibility of the zebrafish and Drosophila embryos
and the techniques that permit visualization of live PGC
migration in the mouse provide excellent experimental
systems in which these processes can be explored.
Сайт создан в системе
uCoz