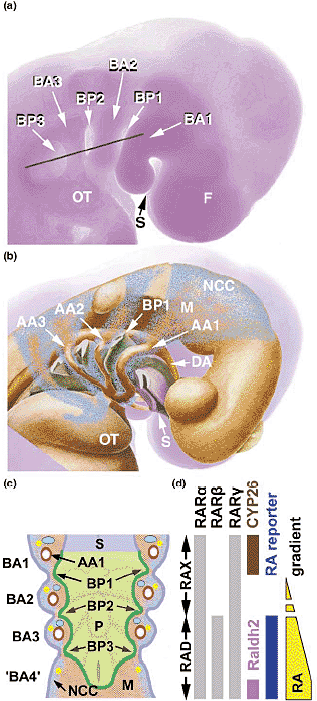
Помимо NCC, клетки, мигрирующие в BA, представлены также краниальными мезодермальными клетками, которые скорее всего дают ангиобласты. предназначенные для BA артерий (AA) [23]. У RARαβnull мутантов [4,19] и у обработанных BMS493 эмбрионов [30], образование AA3-6 тяжело нарушено, но ангиобласты дифференцируются нормально [30]. В заключение, т.к. ни одна из мигрирующих клеток, занимающих BA3-6 не является первичной мишенью для RA, то RA д. действовать на формирование BA посредством их энтодермального и/или эктодермального эпителия.
Растет число доказательств, указывающих сегодня на то, что pharyngeal endoderm (PE) играет важную роль в морфогенезе BA3-6 [24,25,33,34,35]. Эта роль, по-видимому. является критической и необходима для функционального пути передачи сигналов RA. В самом деле нехватки BA3-6, обнаруживаемые у RARαβ-null,
RARαγ-null, RALDH2
hypo мутантов [4,5,12,18,19]
Табл.1 Derivatives of branchial arches 3, 4 and 6 arise from several embryonic tissues, and develop similar abnormalities in RAR and RALDH2 mutant mice and in CATCH22
syndrome patients.
Fate-mapping studies using either quail-chick chimeras [23,33 ] or reporter transgenes in mouse [55] have indicated that each branchial arch (BA) gives rise to specific sets of derivatives. The derivatives from the three caudal mammalian BAs are listed here, as well as their defects in RARab-null, RARag-null, RALDH2 hypomorphic (RALDH2hypo) mutant mice, and human CATCH22 syndromes (cardiac abnormality/abnormal facies, T cell deficit due to thymic hypoplasia, cleft palate, hypocalcemia due to hypoparathyroidism, altogether resulting from
22q11 deletion).
и обработанных BMS493 эмбрионов [30], коррелируют с драматическими изменениями в экспрессии
Hoxa1, Hoxb1, Pax1 и Pax9 генов, которые являются критическими для нормального формирования паттерна PE [30] (Table 1). Среди этих генов,
Hoxa1 и Hoxb1 являются непосредственными мишенями RA, тогда как
Pax1 и Pax9 экспрессируются клеточно автономно в PE [36,37]. Следовательно, передача сигналов RA обеспечивает позиционную информацию PE клеткам, которые скорее всего и являются первичными мишенями для действия RA. Интересно, что эта роль RA в PE вероятно предшествует появлению позвоночных и т.о., появлению NCC во время эволюции [38,39]. Заслуживает внимания также то. что PE у RALDH2
hypo мутантов обнаруживает пониженную экспрессию
Tbx1, гена, чья делеция участвует в возникновении CATCH22 синдрома [40], это подтверждает, что
Tbx1 м. обычно экспрессироваться под контролем RA [12,30]. Более того, аномалии тракта оттока из сердца и cephalic артерий, тимуса и паращитовидных желез, которые являются маркой neurocristopathies, обнаруживаемых у RARαβ-null мутантов и пациентов с and CATCH22 (Table 1), ассоциированы с дефектами в структурах, производных энтодермы, являющихся непрерывными с PE, а именно, пищевода и трахеи, у всех RARαβ-null мутантов мышей [18,19] (Figure 2a) и у некоторых пациентов [41]. Т.к. в нормальном развитии этих органов не участвуют NCC подтверждает мнение, что энтодерма передней части передней кишки (включая и PE), скорее, чем NCC представляют собой первичные ткани-мишени при RAR null, RALDH2 loss-of-function и CATCH22 мутациях.
Некоторые структуры BA3-6, чье развитие нарушено из-за ингибирования передачи сигналов RA, такие как aorticopulmonary перегородка и дуга аорты (Table 1), не получают какого-либо непосредственного вклада от pharyngeal эпителия, а происходят из NCC и/или мезодермальных клеток. Т.к. экспрессия
Fgf8 заметно снижена в PE и/или эктодерме формирующихся BP3-6 у обработанных BMS493 эмбрионов мышей [30], VAD перепелов [8] и RALDH2
hypo мутантов [12], то мы предположили, что развитие этих из NCC и/или мезодермы происходящих структур м. зависеть от Fgf8, секретируемого энтодермой и/или эктодермой под контролем RA [30]. Было установлено, что экспрессия
Fgf8 в PE и в самом деле необходима для формирования aorticopulmonary перегородки, тогда как экспрессия
Fgf8 в BA эктодерме безразлична для правильного позиционирования дуги аорты [42,43]. Всё это указывает на то, что эффекты RA в формировании BA3-6 обеспечиваются посредством пермиссивных факторов, таких как Fgf8, синтезируемых эпителием BA.
The development of branchial arches 1-2
involves retinoic acid-dependent cellular and
molecular mechanisms that are distinct from
those in caudal branchial arches
BA1 никогда не отсутствует в экспериментальных условиях в результате блокирования передачи сигналов RA, a гипоплазия BA1 появляется только в контексте общей задержки эмбрионального роста, вызываемого депривацией RA [7,9]. Однако, некоторые BA1-производные не м. собственно развиваться, если нарушена передача сигналов RA. Напр.. морфогенез моляров, которые происходят из BA1 эктодермы и мезенхимы, четко нуждается в RA (Figure 3a,b). Сходным образом? атавистические модификации хондрогенеза в BA1 у RARα-null мутантов подчеркивают рекрутирование пути передачи сигналов RA во время эволюции челюстей от рептилий до млекопитающих (Figure 3c). Т.о., хотя передача сигналов RA кажется безразличной для формирования BA1, она необходима для более поздних онтогенетических процессов, происходящих внутри BA1 [44].
Напротив, RA необходима для формирования BA2, т.к. BA2 отсутствует у RALDH2-нулевых мышей [9] и VAD перепелов [6]. Однако, BA2 меньше зависит от передачи сигналов RA, чем боле каудальные BAs по нескольким причинам. Во-первых, VAD стартует во время conception у эмбрионов крыс, приводя к агенезу BA3-6, с лишь незначительными изменениями BA2 [7]. Во-вторых, блокирование передачи сигналов RA у эмбрионов мышей с использованием panRAR антагониста до появления передней кишки (E7.5), не оказывает влияния на формирование BA2, но ингибирует формирование BA3-6 [30]. В-третьих, формирование BA2 затрагивается только в слабой степени у RALDH2-null рыбок данио [14,15] и RARαγ-null мышей [5], которые помимо прочего лишены более каудальны BAs. В-четвертых, формирование BA2, но не более каудальных BAs, эффективно восстанавливается у RALDH2-null мутантов за счет материнской поставки RA [28]. Заслуживает также внимания тот факт, что формирование BA2 м. зависеть от RA рецепторов, а RA контролирует клеточные и молекулярные механизмы, отдельные от тех, что используются в более каудальных BAs т.к., во-первых, RARβ экспрессируются на значительно более высоких уровнях в каудальной, чем передней PE [45]; во-вторых, PE из BA2 не экспрессирует генов, непосредственных мишеней для RA, таких как
Hoxa1 и Hoxb1, и поэтому вряд ли является непосредственной тканью-мишенью для RA в противоположность более каудальным BAs [30]; и, в-третьих, обширный апоптоз NCC из заднего мозга, ассоциированный с гипоплазией BA2 у эмбрионов RALDH2-null мышей [10] и VAD перепелов [6], не обнаруживается у мышей, лишенных только BA3-6 в ответ на BMS493-induced блок передачи сигналов RA [30]. Итак. наблюдения, что BA1 м. формироваться в отсутствие RA, что формирование BA2 скорее всего нуждается в более низких уровнях RA, чем BA3-6, подтверждают участие концентрационного градиента RA в формировании передне-заднего паттерна BA (Figure 1d) [28].
The teratogenic effects of retinoic acid excess
and deficiency involve distinct cellular and
molecular mechanisms in the oropharyngeal
region
Воздействие фармакологических доз RA или др. ретиноидов во время беременности вызывают множественные аномалии, которые являются рецептор-обусловленными и чья природа зависит от времени применения RA. У людей приём isotretinoin (13-cis RA) во время гаструляции и раннего органогенеза (3-5 неделя беременности) вызывает целый спектр врожденных уродств, обозначаемых RA-induced embryopathy (RAE) [46].
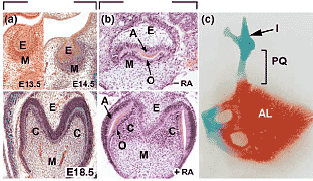 Requirement of RA signalling for the normal development of BA1 derivatives, such as molars and the upper jaw cartilage. (a) Tooth development in vivo. Frontal histological sections through the 1st lower molar at E13.5, E14.5 and E18.5 (same magnification), illustrating normal aspects of its epithelial (E) and mesenchymal (M) components at the dental bud, dental cap and dental bell stages of development, respectively. Note that the developing molar expresses the full complement of retinoid receptors, as well as RA-synthesizing enzymes [44,53,54]. (b) Tooth development in vitro. Histological sections through 1st lower molars that have been explanted at E13.5 and cultured for 10 days in a chemically-defined medium without or with RA (same magnifications as in [a]). RA deprivation ( RA) does not inhibit molar growth nor differentiation of odontoblasts (O) and ameloblasts (A), but yields an arrested morphogenesis at a stage resembling the dental cap (compare [a] and [b]). RA supplementation (+RA) permits progression through dental bell stages, and subsequently the formation of dental cusps (C), yielding a morphology that is strikingly similar to that of E18.5 molar anlagen in vivo (compare [a] and [b]). Despite the fact that, probably because of functional redundancies, none
of the RAR, RXR and RALDH loss-of-function mutants analyzed to date display obvious tooth defects [44] (M Mark, unpublished), the data
summarised above indicate that RA is instrumental for tooth morphogenesis in vivo. Note that histological sections in (a) and (b) were stained using different methods. (c) RARa-null mutants display a supernumerary cartilage, called the pterygoquadrate cartilage (PQ), connecting the incus (I) to the alisphenoid bone (AL). This abnormal skeletal element corresponds to an atavistic trait, defined as the reappearance of a character that was lost during evolution, namely the upper jaw cartilage present in reptilian ancestors of mammals. Its occurrence strongly supports the view that a RA signalling pathway has been recruited during vertebrate evolution to modify jaw functions (reviewed in [44]).
Requirement of RA signalling for the normal development of BA1 derivatives, such as molars and the upper jaw cartilage. (a) Tooth development in vivo. Frontal histological sections through the 1st lower molar at E13.5, E14.5 and E18.5 (same magnification), illustrating normal aspects of its epithelial (E) and mesenchymal (M) components at the dental bud, dental cap and dental bell stages of development, respectively. Note that the developing molar expresses the full complement of retinoid receptors, as well as RA-synthesizing enzymes [44,53,54]. (b) Tooth development in vitro. Histological sections through 1st lower molars that have been explanted at E13.5 and cultured for 10 days in a chemically-defined medium without or with RA (same magnifications as in [a]). RA deprivation ( RA) does not inhibit molar growth nor differentiation of odontoblasts (O) and ameloblasts (A), but yields an arrested morphogenesis at a stage resembling the dental cap (compare [a] and [b]). RA supplementation (+RA) permits progression through dental bell stages, and subsequently the formation of dental cusps (C), yielding a morphology that is strikingly similar to that of E18.5 molar anlagen in vivo (compare [a] and [b]). Despite the fact that, probably because of functional redundancies, none
of the RAR, RXR and RALDH loss-of-function mutants analyzed to date display obvious tooth defects [44] (M Mark, unpublished), the data
summarised above indicate that RA is instrumental for tooth morphogenesis in vivo. Note that histological sections in (a) and (b) were stained using different methods. (c) RARa-null mutants display a supernumerary cartilage, called the pterygoquadrate cartilage (PQ), connecting the incus (I) to the alisphenoid bone (AL). This abnormal skeletal element corresponds to an atavistic trait, defined as the reappearance of a character that was lost during evolution, namely the upper jaw cartilage present in reptilian ancestors of mammals. Its occurrence strongly supports the view that a RA signalling pathway has been recruited during vertebrate evolution to modify jaw functions (reviewed in [44]).
У модельных животных RAE, слияние и гипоплазия первых двух BA объясняет черепно-лицевые альтерации, обнаруживаемые у новорожденных. Слияние и гипоплазия BA1-2 генерируется также у эмбрионов мышей, культивируемых с BMS453, агониста RARβ, обладающего также антагонистическими RARα и RARγ свойствами. Напротив, BA дефекты не обнаруживаются после обработки RARα- или RARγ-избирательных агонистов. Т.к. эти индуцированные BMS453 дефекты BA усиливаются в присутствии panRXR агониста, который не является тератогенным сам по себе, то черепно-лицевые аномалии, характерные для RAE д.б. обусловлены посредством активации RXR/RARβ гетеродимеров, у которых RXR активность подчинена активности RARβ [45]. Неожиданно оказалось, что CYP26A1-null мыши не имеют дефектов BA1, связанных с избытком RA [47,48]. Нормальность BA1 у таких мутантов возможно отражает функциональное перекрывание с CYP26C1 [49].
Даже если RAE соответствует критериям neurocristopathy, но
NCC, по-видимому. не являются первичными мишенями для RA индуцируемого тератогенеза, т.к. индуцируемое RA слияние BA1-2 происходит без изменений миграции NCC или апоптоза [50], и в противоположность др. эмбриональным тканям NCC не экспрессируют RA-responsive RARE-hsp68-
LacZ трансгена в ответ на воздействие BMS453. Напротив, воздействие этого ретиноида запускает RARβ-зависимый сигнал в PE, выстилающем BA1-2, проявляется в виде переднего сдвига доменов экспрессии RA-чувствительных генов в самом PE и изменениях формирования первых двух BP [45]. Т.о., современные данные подтверждают мнение, что дефекты RAE возможно являются результатом аномальной функции PE скорее, чем дефектов первичных NCC.
Conclusions
Malformations induced by excess RA resemble those
generated upon silencing RA-dependent pathways. For
instance, a CATCH22-like spectrum of defects is recapitulated
in mouse fetuses exposed to excess vitamin A
[51]. Such similarities have popularized the idea that both
RA excess and RA deficiency impair developmental
processes by disrupting identical mechanisms. With
respect to the early development of the oropharyngeal
region, this is, however, clearly not the case for the
following reasons. First, at E8.0, excess RA triggers
BA1–2 hypoplasia [45], whereas antagonizing the RA
signal induces BA3–6 hypoplasia, without altering the
development of BA1–2 [30]. Second, blocking RA signalling
after E8.0 does no longer affect the formation of BA3
[30], whereas hypoplasia of BA3 is now induced by
vitamin A excess given at E9.5 [51]. Third, RA excess
but not deficiency alters the level of RA signalling in the
endoderm lining BA1–2 [30,45]. Fourth, the deleterious
effects of RA excess on BA1–2 formation are mediated
specifically by RARb [45], whereas deleting RARb does
not affect BA development [19]. These examples clearly indicate that similar malformations observed in RA excess
and deficiency are generated through disrupting distinct
cellular and molecular mechanisms and that the physiological
functions of RA cannot be extrapolated from
teratogenesis experiments using RA in excess.
Сайт создан в системе
uCoz