DCs. N/r/ известно, что вирусная dsRNA, соединяясь с TLR3 ведет к активации DC, то авт. предположили, что TLR3 м.б. ответственным за выявление присутствия вирусной инфекции в фагоцитированном клеточном материале и что это м. играть важную роль в cross-priming.
Чтобы проверить это авт. показали, что синтетическая dsRNA, трансфицированная в ряд клеточных линий или инфицированные вирусами клетки м. активировать CD8α
+ DCs после того, как они оказываются фагоцитированными. Активации не наблюдается, если фагоцитоз блокирован с помощью актин-стабилизирующих агентов, это указывает на то, что фагоцитоз и фагосомная acidification - но не растворимые факторы - необходимы для активации. Т.к. у
Tlr3-/- CD8α
+ DCs такая активация не обнаруживается, то это указывает на то, что TLR3-зависимое распознавание dsRNA в фагосомах обеспечивает активацию CD8α
+ DCs.
Чтобы исследовать вирусом и dsRNA-индуцированный cross-priming T клеток
in vivo, Schulz
et al. иммунизировали мышей клетками Vero, трансфицированными dsRNA и ovalbumin (OVA), или клетками, инфицированными дефицитным по репликации вирусом, кодирующим OVA. В то время как мыши дикого типа демонстрировали мощный cross-priming, TLR3-дефицитные мыши обнаруживали сильно нарушенный cross-priming. Авт. повторили эксперименты с летально облученными животными, которые были восстановлены с помощью костного мозга от
Tlr3-/- или
Tlr3+/+ доноров и с помощью OVA-специфических T клеток. Усиление клеточной иммуногенности было полностью потеряно у
Tlr3-/- химер, что указывает на зависимость cross-priming от экспрессии TLR3 в APCs.
Т.о., Schulz et al. идентифицировали TLR3 как ключевой фактор cross-priming of CTLs против вирусов, которые не инфицируют непосредственно дендритные клетки. Т.к. передача сигналов TLR3 ведет также к усилению активности ко-стимулирующих молекул, к продукции immunomodulatory цитокинов и индукции IFN-α/β, то нагрузка опухолевых клеток dsRNA м. позволить создать мощную вакцину для терапии рака.
Сайт создан в системе
uCoz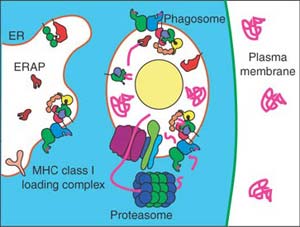 Перекрестная презентация позволяет antigen presenting cells (APCs) знакомить Т клетки с антигенами, которые не экспрессируются самими APCs клетками, но приобретаются за счет фагоцитоза умерших клеток. Schulz et al. показали, что в dendritic cells (DCs) - в наиболее важном типе APC - активация Toll-like receptor 3 (TLR3) вирусными double-stranded RNA (dsRNA) является предварительным условием эффективной in vivo T клеточной реакции против вирусом инфицированных келеток во время перекрестной презентации.
Перекрестная презентация позволяет antigen presenting cells (APCs) знакомить Т клетки с антигенами, которые не экспрессируются самими APCs клетками, но приобретаются за счет фагоцитоза умерших клеток. Schulz et al. показали, что в dendritic cells (DCs) - в наиболее важном типе APC - активация Toll-like receptor 3 (TLR3) вирусными double-stranded RNA (dsRNA) является предварительным условием эффективной in vivo T клеточной реакции против вирусом инфицированных келеток во время перекрестной презентации.