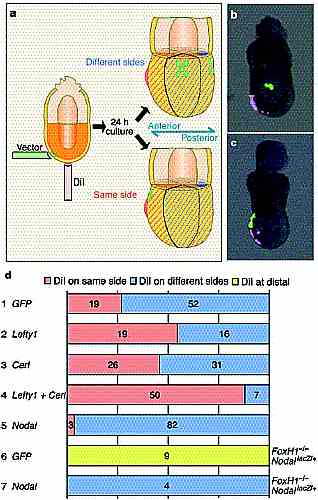
Мы сходным образом вносили вектор экспрессии Nodal в эмбрионы дикого типа. DiI и GFP сигналы локализовались на одной и той же стороне только у 4% таких эмбрионов (n ј 85, P , 0.0001) (Рис. 2d), указывая тем самым, что DVE мигрирует прочь от того места, где очень высокая активность Nodal. DVE не способен мигрировать в FoxH12/2 эмбрионах, содеержащих один аллель дикого типа Nodal и Nodal–lacZ аллель
. У таких FoxH12/2, NodallacZ/ю мутантных эмбрионров, экспрессия Nodal потеряна в VE и дистальной части эпибласта также как и у FoxH12/2 type B эмбрионов, которые в проксимальной части эпибласта радиально симметричны. Если неспособность к миграции у таких мутантов обусловлена потерей экспрессии Nodal, то восстановление экспрессии Nodal д. индуцировать движение DVE. И в самом деле, в то время как DiI-меченные клетки оставались на дистальном конце у 100%
FoxH12/2, NodallacZ/ю эмбрионов, экспрессирующих только GFP (n ј 9), эктопическая экспрессия Nodal отталкивала DVE у 100% таких эмбрионов (n ј 4, P , 0.0001 по сравнению с теми, что экспрессировали только GFP)
(Рис. 2d).
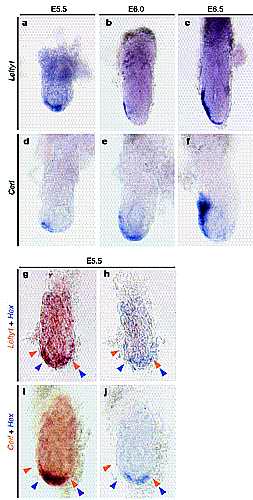
Чтобы определить м. ли дифференциальная пролиферация клеток вносить свой вклад в механизм миграции DVE, мы изучали пролиферацию VE клеток с помощью мечения эмбрионов bromodeoxyuridine (BrdU) на пред- и ранней стадии гаструляции. У эмбрионов дикого типа пролиферация клеток VE была униформной на ст. E5.5 (Рис. 3a). На E5.7 однако, когда DVE начинала мигрировать, пролиферация клеток ингибировалась в области, соответствующей доменам экспрессии Lefty1 и Cerl (Рис. 3b, b0 ). Ингибирование прлиферации клеток в будущей AVE проявлялось на ст. E6.0 (Рис. 3c, c 0 ), а асимметрия в скорости клеточной пролиферации вдоль A–P оси проявлялась в VE вплоть до ст. E6.5 (Рис. 3d, e, e 0 ). Этот паттерн пролиферации клеток напоминал временные изменения передачи сигналов Nodal. Чтобы изучить возможную связь между передачей сигналов Nodal и пролиферацией клеток, мы изучали паттерн включения BrdU на ст.
E6.5 у разных мутантов, дефицитрных по такой передаче сигналов. У NodallacZ/lacZ
эмбрионов
11 (n ј 5) пролиферация клеток была заметно нарушена в VE и эпбласте (Рис. 3f). У эмбрионов FoxH12/2 наблюдалось два типа паттернов окрашивания. У типа A мутантов (n ј 3) асимметричный паттерн включения BrdU был сходен с тем, что наблюдается у дикого типа (Рис. 3g, g0 ), хотя уровень окаривания был редуцирован по сравнению с тем, что у эмбрионов дикого типа. У типа B мутантов (n ј 4), которые экспрессировали Nodal только в проксимальной части эпибласта на этой ст. (Supplementary Рис. S2; data not shown), обнаруживалось униформное окрашивание в VE, лежащей повех проксимальной части эпибласта, тогда как окрашивание в DVE терялось (Рис. 3h, h0 ). Наконец, у
FoxH1flox/2,Lefty2–cre эмбрионов (n ј 4), лишенных FoxH1 специфически в эпибласте
9, включение BrdU в проксимальной области было сходно с обнаруживаемым у эмбрионов дикого типа (Рис. 3i, i 0 ). Однако передняя часть
DVE окрашивалсь сильнее, чем у эмбрионов дикого типа (Рис. 3i), т.к. у этих мутантов отсутствовал Lefty1 в AVE
9. Эти результаты указывают на то, что передача сигналов Nodal способствует пролиферации клеток в VE и что асимметричность пролиферации вдоль A–P оси обучловлена дифференциальной передачей сигналов Nodal.
Затем мы исследовали эффекты эктопической экспрессии Nodal или
Nodal антагонистов на пролиферацию клеток VE (Рис. 4). VE от E5.2 эмбрионов co-transfected с одной из сторон тестируемым геном и GFP экспрессирующим вектором. DVE метилась DiI у некоторых эмбрионов (37/86 при одном GFP; 72/101 при Nodal; 32/86 при Lefty1 + Cerl). Количество GFP
+ клеток подсчитывалось спустя 12 и 36 ч, а увеличение количества GFP
+ клеток подсчитывали за 24-ч период между этими двумя временными точками (обозначены как replication index, RI). У эмбрионов, трансфицированных только GFP вектором (n ј 86), RI для GFP
+ VE клеток варьировал между 1.0 и 9.0
(Рис. 4a–d, i). Эта изменчивость зависела от специфического места трансфекции, с трансфицированными VE клетками на будущей передней стороне, делящимися меньше раз (average RI ј 2.2, n ј 13), чем те, которые были на др. стороне (правая сторона, в среднем RI ј 4.0, n ј 9; левая сторона, в среднем RI ј 3.7,
n ј 8; задняя сторона, в среднем RI ј 4.2, n ј 7). Трансфекция эмбрионов Nodal экспрессирующим вектором (n ј 101) стимулировала пролиферацию клеток (Рис. 4g–i), что проявлялось в заметном увеличении процента эмбрионов, у которых клетки реплицировались более 4-х раз. У большинства эмбрионов, с DVE, меченной DiI (69/72), клетки GFP
+ локализовались не на передней стороне со средним RI в 7.2, что было заметно выше, чем значение RI в контрольных VE клетках: 4.0, 3.7, 4.2 и 2.2. Напротив, эктопическая экспрессия и Lefty1 и Cerl у эмбрионов (n ј 86) вызывала ингибирование клеточной пролиферации (Рис. 4e, f, i), с трансфицированными клетками редко удваивающимися болеее 4 раз. В большинстве эмбрионов с DVE, меченной DiI (23/32), GFP
+ клетки обнаруживались на передней стороне со средним RI в 2.5, что значительно ниже, чем в контрольных VE клетках. Эти результаты демонстрируют, что DVE мигрирует прочь от той стороны, где стимулируется пролиферация VE с помощью эктопической экспрессии Nodal. Напротив DVE мигрирует в направлении стороны, где пролиферация VE клеток ингибируется с помощью Lefty1 и Cerl.
Чтобы определить степень, с которой асимметричная пролиферация клеток вносит вклад в миграцию DVE мы подвергали эмбрионы и односторонней ко-трансфекции VE GFP вектором и экспрессионным вектором для дикого типа и доминантно негативной формы Cdk2 (ref. 12) при одновременном мечении DVE с помощью DiI (Рис. 4j).
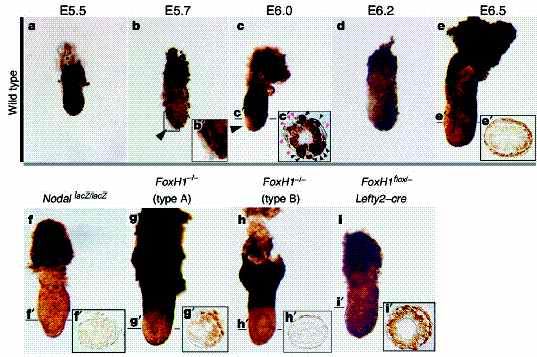 Рис. 3 Patterns of VE cell proliferation in wild-type иvarious mutant embryos. The pattern of BrdU incorporation was determined in wild-type embryos at the indicated stages (top row: a–e0 ) as well as in the indicated mutants at E6.5 (bottom row: f–0 i). Lateral views are shown for each embryo, with the anterior side on the left. Arrowheads indicate regions negative for BrdU labelling. The square region in b is expanded in b0 . The planes of transverse sections at the indicated points on each embryo (c0 , e0 , f 0 , g0 , h0 и i 0 ) are indicated by the horizontal bar of the embryos in c иe–i, respectively. c0 , BrdU-positive or -negative nuclei in the VE are shown by closed black и red arrowheads, respectively.
Рис. 3 Patterns of VE cell proliferation in wild-type иvarious mutant embryos. The pattern of BrdU incorporation was determined in wild-type embryos at the indicated stages (top row: a–e0 ) as well as in the indicated mutants at E6.5 (bottom row: f–0 i). Lateral views are shown for each embryo, with the anterior side on the left. Arrowheads indicate regions negative for BrdU labelling. The square region in b is expanded in b0 . The planes of transverse sections at the indicated points on each embryo (c0 , e0 , f 0 , g0 , h0 и i 0 ) are indicated by the horizontal bar of the embryos in c иe–i, respectively. c0 , BrdU-positive or -negative nuclei in the VE are shown by closed black и red arrowheads, respectively.
Эктопическая экспрессия дикого типа Cdk2 оттакливала DVE у 90% исследованных эмбрионов (n ј 79, P , 0.008 по сравнению с эмбрионами, экспрессирующими только GFP), тогда как экспрессия доминантно негативной формы Cdk2 привлекала DVE у 45% эмбрионов (n ј 98, P , 0.016). Затем мы изучали эффект эктопической экспрессии Cdk2 у FoxH12/2, NodallacZ/ю эмбрионов. В то время как экспрессия только GFP была неспособной двигать DVE, тогда как дикого типа Cdk2 отталкивал DVE у всех 4-х изученных эмбрионов (P , 0.0001). Это указывает на то, что ингибирование пролиферации клеток с помощью антагонистов Nodal заставляет
DVE мигрировать в направлении будущей передней стороны.
Impaired anteroposterior patterning without Lefty1 иCerl
Чтобы подтвердить действие Nodal антагонистов на формирование A–P паттерна, мы анализировали мутантных мышей, лишенных Lefty1 или Cerl. Lefty12/2 (ref. 13) и Cerl2/2 (refs 6, 14, 15) эмбрионы нормально проходили гаструляцию, тогда как Cerl2/2,Lefty12/2 эмбрионы давали множественные первичные полоски
8, указывая тем самым на функциональную перекрываемость (redundancy) между Lefty1 и Cerl. Мы впервые изучили экспрессию AVE маркёра Hex
(Рис. 5a, b, h, i). Домен экспрессии Hex расширяется слабо у Cerl2/2 и Lefty12/2 мутантов (data not shown) и заметно у Cerl2/2,Lefty12/2 двойных мутантов (Рис. 5b, i), у которых клетки, позитивные по Hex транскриптам занимали всю переднюю половину VE на ст. E6.5 (n ј 4). Эти результаты показали, что Nodal антагонисты ограничивают размеры и локализацию AVE, за счёт ингибирования пролиферации клеток AVE.
Затем мы исследовли миграцию DVE у Lefty1 и Cerl мутантов путём монииторинга экспрессии Hex. Хотя Lefty12/2 или Cerl2/2 эмбрионы не обнаруживали очевидных дефектов миграции (data not shown), миграция DVE задерживалась у Cerl2/2,Lefty12/2 эмбрионов (Рис. 5o). Домен экспрессии Hex, который обычно локализован на передней стороне на ст. E6.0 (Рис. 5a), остаётся в дистальной области у двойных мутантов в это время (Рис. 5h).
Асимметрия включения BrdU между переденей и задней частью VE сохраняется у Lefty12/2 (n ј 4) (Рис. 5s, s 0 ) и Cerl2/2 (n ј 5) (Рис. 5w, w0 )эмбрионов. У эмбрионов Cerl2/2,Lefty12/2 на E6.0 (n ј 5) (Рис. 5j) и E6.5 (n ј 4) (Рис. 5k, k0 )включение BrdU происходит на высоком уровне по всей VE, но остаётся небольшая BrdU-негативная область в AVE. Мы также исследовали экспрессию Nodal у разных мутантных эмбрионов на ст. E6.5. У дикого типа экспрессия Nodalв эпибласте на этой ст. выше в задней области
2 (Рис. 5e–g). У одиночных мутантов с отсутствием Lefty1 (n ј 3) (Рис. 5t–v) или Cerl (n ј 5) (Рис. 5x–z), экспрессия Nodal усилена в VE. Повышенная экспрессия Nodal ещё более очевидна у двойных мутантов (n ј 4) (Рис. 5l–n); экспрессиия Nodal
в эпибласте т.о. униформа в дистальной области (Рис. 5n) , но асимметрична в проксимальной области (Рис. 5m). Кроме того, экспрессия Nodal усилена во всей VE
(Рис. 5l–n).
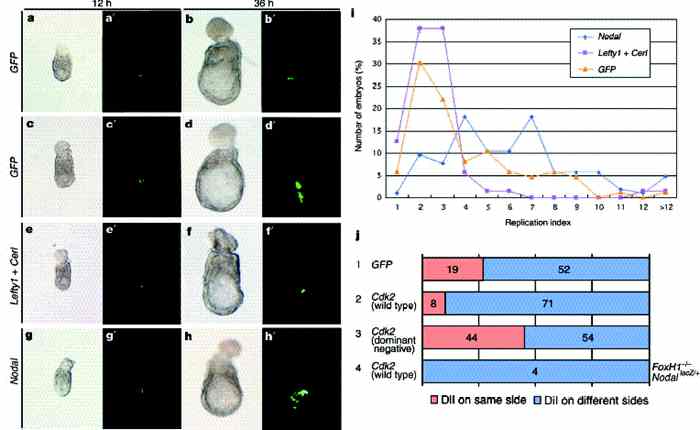 Рис. 4 Nodal antagonists inhibit иNodal promotes VE cell proliferation. a–h, The VE of E5.2 wild-type embryos was transfected unilaterally with a GFP expression vector either alone or together with an effector gene, as indicated. The DVE was labelled with DiI in some embryos (37/86 for GFP alone; 72/101 for Nodal; 32/86 for Lefty1 ю Cerl). The numbers of GFP-positive cells were counted 12 и36 h after transfection. Both differential interference contrast (a–h) иGFP fluorescence (a0–h0 ) images of typical embryos are shown for the three groups. Two types of embryos are shown for those that received GFP alone. The embryo shown in a, a0 , b и b0 represents the case where GFP was introduced into the prospective anterior side, whereas the one shown in c, c0 , d and d0 represents the case where GFP was introduced into non-anterior sides. i, Summary of the percentages of embryos in which GFP-positive cells replicated the indicated numbers of times during the 24-h period of analysis for the three groups of embryos. The data are based on embryos in which the DVE was labelled with DiI иthose unlabelled. Thus, the sample sizes are 86 for GFP alone, 101 for Nodal, и86 for Lefty1 ю Cerl. j, Effects of ectopic expression of wild-type Cdk2 or of a dominant negative form of Cdk2 on DVE migration. Host embryos were wild-type (rows 1–3) or FoxH1 2/2,Nodal lacZ/ю (row 4) and were analysed as described in Рис. 2a. DVE migration induced by Cdk2 in FoxH1 2/2, Nodal lacZ/ю embryos was incomplete (the migration distance was shorter than that in wild-type embryos), possibly because the small population of proliferating cells was not sufficient for complete migration of the DVE or because Nodal signalling has relevant effects other than on cell proliferation. The numbers of embryos showing localization of DiI on the same side or on a different side relative to that of GFP are indicated.
Рис. 4 Nodal antagonists inhibit иNodal promotes VE cell proliferation. a–h, The VE of E5.2 wild-type embryos was transfected unilaterally with a GFP expression vector either alone or together with an effector gene, as indicated. The DVE was labelled with DiI in some embryos (37/86 for GFP alone; 72/101 for Nodal; 32/86 for Lefty1 ю Cerl). The numbers of GFP-positive cells were counted 12 и36 h after transfection. Both differential interference contrast (a–h) иGFP fluorescence (a0–h0 ) images of typical embryos are shown for the three groups. Two types of embryos are shown for those that received GFP alone. The embryo shown in a, a0 , b и b0 represents the case where GFP was introduced into the prospective anterior side, whereas the one shown in c, c0 , d and d0 represents the case where GFP was introduced into non-anterior sides. i, Summary of the percentages of embryos in which GFP-positive cells replicated the indicated numbers of times during the 24-h period of analysis for the three groups of embryos. The data are based on embryos in which the DVE was labelled with DiI иthose unlabelled. Thus, the sample sizes are 86 for GFP alone, 101 for Nodal, и86 for Lefty1 ю Cerl. j, Effects of ectopic expression of wild-type Cdk2 or of a dominant negative form of Cdk2 on DVE migration. Host embryos were wild-type (rows 1–3) or FoxH1 2/2,Nodal lacZ/ю (row 4) and were analysed as described in Рис. 2a. DVE migration induced by Cdk2 in FoxH1 2/2, Nodal lacZ/ю embryos was incomplete (the migration distance was shorter than that in wild-type embryos), possibly because the small population of proliferating cells was not sufficient for complete migration of the DVE or because Nodal signalling has relevant effects other than on cell proliferation. The numbers of embryos showing localization of DiI on the same side or on a different side relative to that of GFP are indicated.
Хотя степень пролиферациии клеток VE существнено увеличена у довоных мутантов, небольшая BrdU-негативная область всё-таки обнаруживается в AVE (Рис. 5j, k, k0 ). Это подтверждает существование дополнительного Nodal антогониста (ов), которые частично компенсируют отсутствие Lefty1 и Cerl. Очевидным кандидатом на роль такой молекулы является Lefty2. Lefty2 не экспрессируется в VE эмбрионов дикого типа
4, но неожиданно экспрессируется в части AVE эмбрионов Cerl2/2,Lefty12/2 на ст. E5.7 (n ј 2) (Рис. 5p),
E6.2 (n ј 2) (Рис. 5q)16 иE6.5 (n ј 5) (Рис. 5p), это соответствует BrdU-негативной области (Рис. 5j, k). Следовательно, наиболее вероятно, что эктопическая экспрессия Lefty2 частично компенсирует потерю Lefty1 и Cerl.
Discussion
Как же диффренциальная активность Nodal управляет миграцией DVE? Несколько доказательств свидетельствуют, что дифференциальна пролиферация клеток в VE вдоль будущей A–P оси регулирует миграцию DVE (Supplementary
Рис. S4). Однако это не обязательно исключает др. возможности, В частности, миграция AVE, которая является быстрой миграцией клеток, м. также использовать механизм активнрой миграции. Такой механизм также д. нуждаться в сигналах Nodal, потому что DVE не способна перемещаться у разных мутантных эмбринов с отсутствием сигнала Nodal. Интересно отметить, что DVE у FoxH12/2, NodallacZ/ю эмбрионов движется частично в ответ на Cdk2 (Рис. 4j). Это м.б. потому, что дифференциальная пролиферация клеток детерминирует направление миграции DVE, тогда как движущие силы миграции AVE обеспечиваются в основном за счёт механизма активной миграции и частично за счёт неравномерной пролиферации клеток. В этой связи, почти нормальное образование AVE у Cerl2/2,Lefty12/2 эмбрионов м.б. не обязательно обусловлено компенсаторной активностью Lefty2 , а м. б. обусловлено активным
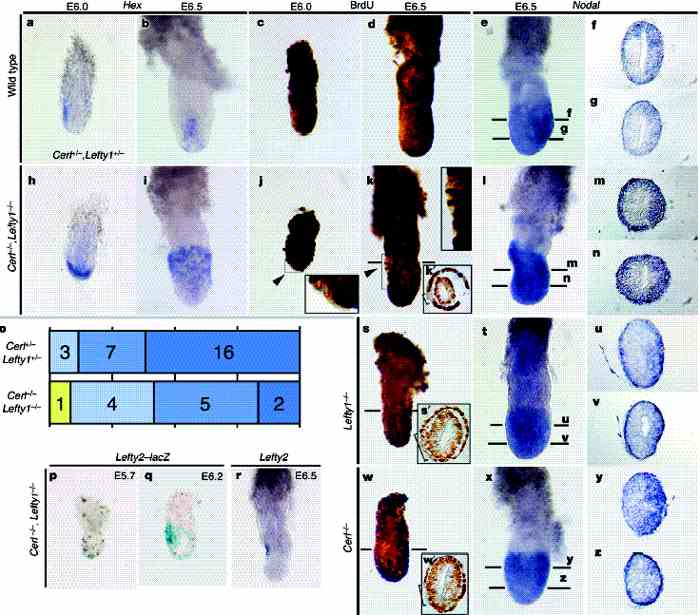 Рис. 5 Anteroposterior patterning defects in the absence of Lefty1 иCerl. Cerl ю/2, Lefty1 ю/2 (a), wild-type (b–g), Cerl 2/2,Lefty1 2/2 (h–n, p–r), Lefty1 2/2 (s–v) and Cerl 2/2 (w–z) embryos were examined for Hex expression (a, b, h, i), BrdU incorporation (c, d, j, k, s, w), Nodal expression (e–g, l–n, t–v, x–z), иLefty2 expression (r) at the indicated stages. Lefty2 expression was also examined with a Lefty2–lacZ transgene (p, q) inwhich LacZ expression is driven by the upstream5.5-kb region of the Lefty2 gene17. This transgene is not active in the wild-type embryo at the pre-gastrulation stage (data not shown), but is expressed in the regions of the Cerl 2/2,Lefty1 2/2 embryo at E5.7 (p) and E6.2 (q) that correspond to the BrdU-negative regions. Lateral views are shown for each embryo with the anterior side on the left, with the exception that anterior views are shown in b иi. The planes of transverse sections (f, g, k0 ,m, n, s0 , u, v, w0 , y, z) are indicated by
the horizontal bars in e, k, l, s, t, w иx. Patterns of the Hex expression domain are summarized for Cerl ю/2,Lefty1 ю/2 иCerl 2/2,Lefty1 2/2 embryos at E6.0 in o. The numbers of embryos showing each pattern are indicated. Yellow, the expression domain remains at the distal tip; light blue, it was shifted towards the anterior side; medium blue, it reached half way towards the junction between embryonic иextraembryonic regions; dark blue, it reached the junction. BrdU-negative VE regions are indicated by arrowheads иbrackets (j, k, k0 , s0 , w0 ).
Рис. 5 Anteroposterior patterning defects in the absence of Lefty1 иCerl. Cerl ю/2, Lefty1 ю/2 (a), wild-type (b–g), Cerl 2/2,Lefty1 2/2 (h–n, p–r), Lefty1 2/2 (s–v) and Cerl 2/2 (w–z) embryos were examined for Hex expression (a, b, h, i), BrdU incorporation (c, d, j, k, s, w), Nodal expression (e–g, l–n, t–v, x–z), иLefty2 expression (r) at the indicated stages. Lefty2 expression was also examined with a Lefty2–lacZ transgene (p, q) inwhich LacZ expression is driven by the upstream5.5-kb region of the Lefty2 gene17. This transgene is not active in the wild-type embryo at the pre-gastrulation stage (data not shown), but is expressed in the regions of the Cerl 2/2,Lefty1 2/2 embryo at E5.7 (p) and E6.2 (q) that correspond to the BrdU-negative regions. Lateral views are shown for each embryo with the anterior side on the left, with the exception that anterior views are shown in b иi. The planes of transverse sections (f, g, k0 ,m, n, s0 , u, v, w0 , y, z) are indicated by
the horizontal bars in e, k, l, s, t, w иx. Patterns of the Hex expression domain are summarized for Cerl ю/2,Lefty1 ю/2 иCerl 2/2,Lefty1 2/2 embryos at E6.0 in o. The numbers of embryos showing each pattern are indicated. Yellow, the expression domain remains at the distal tip; light blue, it was shifted towards the anterior side; medium blue, it reached half way towards the junction between embryonic иextraembryonic regions; dark blue, it reached the junction. BrdU-negative VE regions are indicated by arrowheads иbrackets (j, k, k0 , s0 , w0 ).
и независимым от Nodal движением клеток. Возможно также, что неравномерная пролиферация клеток косвенно детерминирует направление миграции. Т.о., уменьшение пролиферации м. понуждать клетки к выходу из клеточног цикла, что м. индуцировать направленное движение соседних клеток.
Эктопическая экспрессиия Lefty1 и Cerl оказывает более существенное влияние на миграцию DVE, чем это делает экспресия Nodal антогониство в отдельности. Более того, формирование дефектов A–P паттерна было очевидным только во отсутствие и Lefty1 и Cerl, хотя пролиферация клеток VE слегка нарушена и у Lefty12/2 и Cerl2/2 одиночных мутантов. Lefty1 и Cerl, как полагают, противодействуют передаче сигналов Nodal посредством разных механизмов. В то время как Lefty1 блокирует Nodal сигналы благодаря конкурентному связыванию рецепторов Nodal
17, Cerl ингибирует активность Nodal путём связывания самого Nodal
18. Ингибирование обоих уровней т.о. м.б. необходимым для полной супрессии передачи сигналов Nodal. Альтернативно, Cerl м. ингибировать передачу сигналов с помощью др. молекулв, таких как Wnt или bone morphogenetic protein
6,18.
Мыши, дефицитные по β-catenin также обнаруживают дейекты миграции DVE
19, указывая тем самым, что канонические пути передачи сигналов Wnt аносят вклад и в этот процесс, прямо или косвенно.
Необходимость установки полярности экспрессии Nodal вдоль A–P оси законсервирована у позвоночных, хотя, по-видимому, используются разные стратегии для достижения этого конечного результата. У Xenopus и рыбок данио20,21, экспрессия Nodal-related белков в вегетеативном полушарии или маргинальной зоне индуцируется материнскими факторами; эта экспрессия позднее гасится с помощью негативной сигнаьной петли с участием Lefty (Antivin) у рыбок данио22, тогда как экспрессии на дорсальной стороне увеличивается с помощью передачи сигналов β-catenin20 в дополнение к Nodal позитивной синальной петле23,24. У эмбрионров кур экспрессия Nodal индуцируется с помощью Vg1 и Wnt в задней маргинальной зоне25, тогда как экспрессия на периферии бластодермы супрессируется с помощью Cerl, продуцируемого гипобластом26. Позиционные сигналы, такие как те, что генерируют кортикальную ротацию у Xenopus27 или с помощью тяжести у эмбрионов кур28, по-видимому, не вносят вклада в развитие у мышей. Вместо этого эмбрионы мыши развивают динамическую систему с участием Nodal–Lefty/Cerl позитивной и негативной синальной петли, которые используют слабые изменения. генерируемые в VE.