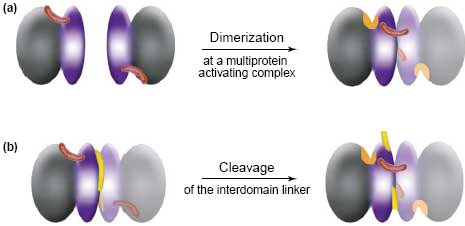
Этот механизм активации указывает на ранее недооценённое свойство procaspase-8: что в своём неактивном состоянии она является мономером. Это свойство теперь
исчерпывающе демонстрируется как на рекомбинантном материале [5] так и на естественных эндогенных зимогенах [4]. Это находится в резком контрасте по отношению к исполнительным caspases-3 и -7, которые уже димерны в своей латентной форме.
Ортолог caspase-8, caspase-10, также является инициатором гибели клеток посредством death-receptor, по крайней мере, у людей (мыши, по-видимому, лишены гена caspase-10). Существуют противоречия относительно способности caspase-
10 замещать функционально caspase-8 в передаче сигналов death-рецепторами. Первые работы с caspase-8 дефицитными клетками, происходящими из Jurkat T-клеточной линии, привели к заключению, что caspase-8 существенна для death-рецепторами обусловленного апоптоза [10]. Однако, последующие исследования установили, что эта клеточная линия имеет также пониженные уровни и
caspase-10 и что преходящая трансфекция этих клеток caspase-10 достаточна для сенсибилизации их к death-рецепторами обусловленной клеточной гибели [11,12]. В др. работе было найдено, что восстановление этих Jurkat T клеток с помощью стабильной трансфекции death рецептором DR4 в комбинации с caspase-10 не сенсибилизирует death-рецепторами индуцируемый апоптоз [13]. Люди с мутантной caspase-10 имеют autoimmune lymphoproliferative синдром, обусловленный дефектным апоптозом лимфоцитов [14]. Люди с мутантной caspase-8 также обнаруживают дефекты апоптоза лимфоцитов, но имеют дополнительные выраженные дефекты в своей способности активировать лимфоциты, в результате чего развивается иммунодефицит [15]. Важно, что последнее исследование выявляет, что дефицит caspase-8 совместим с развитие у людей, хотя он вызывает эмбриональную гибель у мышей [16]. Всё это указывает на то, что хотя и имеется некоторое перекрывание, но caspase-8 и -10 выполняют самостоятельные функции.
Интересным дополнением к механзму активации caspase-8 является вовлечение FLIP (FLICE-like inhibitory protein - FLICE одно из оригинальных имен
caspase-8). FLIP является гомологом caspase-8 с определенными важными отличиями, напр., отсутствие каталитического cysteine, что обусловливает его неспособность к каталитической активности. Избыточная экспрессия FLIP в некоторых линиях клеток ингибирует death-рецепторами обусловленный апоптоз, преимущественно за счёт блокирования сайта, связывающего caspase-8 в DISC. Работа Chang и др. выяснила этот кажущийся конфликт, показав, что низкие уровни экспрессии (близкие к тем, что появляются в нормальных клетках) FLIP усиливают Fas-индуцируемую активацию caspase-8 в DISC; но только высокие уровни (обнаруживаемые в определенных опухолях, напр.) FLIP ингибируют активацию caspase-8 [17]. Это исследование было дополнено результатами работы, показавшей, что FLIP способен формировать гетеродимеры с caspase-8, которые обладают каталитической активностью [18], подтверждая механизм активации caspase-8 посредством димеризации.
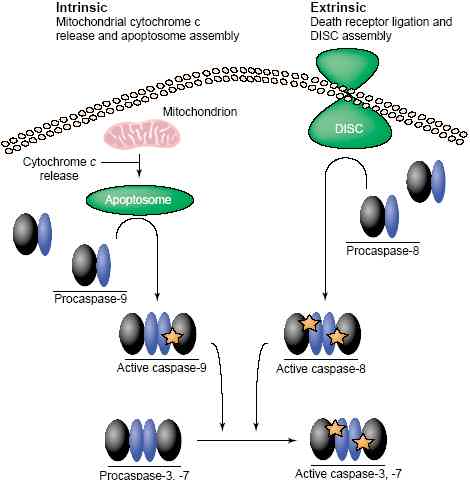
Intrinsic pathway (caspases-9 and -2)
Внутренне присущие пути используются для элиминации клеток в ответ на ионизирующее излучение, химиотерапию, митохондриальные повреждения и некоторые онтогенетические сигналы. После запуска гибели митохондрии м. оказаться избирательно permeabilized, что ведет к высвобождению цитохрома c и рекрутированию и активации начальной каспазы внутренне присущего пути, caspase-9, в комплекс, известный как 'apoptosome' [19]. Центральным компонентом apoptosome является белок, известный как Apaf-1 (apoptotic protease activating factor 1), который и рекрутирует caspase-9 посредством своего N-терминального caspase-activation recruitment domain (CARD) [20]. В своём молчащем состоянии Apaf-1 является компактной молекулой с головкой (CARD domain), засунутой между её ног (два β-propellers, образуемые набором WD40 повторов). Цитохром c (который, что удобно, примерно того же самого размера, что и ) смещает головку, позволяя компактной структуре расправиться в более линейную структуру, которая полимеризуется после связывания с АТФ [21]. ЭМ исследования показали, что apoptosome является колесом с 7 карманами (seven-spoked) и с центральной ступицей, которая содержит домен, рекрутирующий caspase-9, который формируется с помощью CARD Apaf-1. К сожалению, конформация caspase-9 не видна на этой картине, но др. техники показывают переход от мономера к димеру, аналогичный тому, что наблюдается при активации caspase-8.
Хотя мономеры концентрируются в цитозоле, но трехмерная кристаллическая структура caspase-9 показывает, что активной формой является димер [22]. Интересно, что эти димеры содержат только один активный домен в результате стерического столкновения интерфейса димера. Др. домен димера находится в зимоген-подобной конформации с выведенными из строя детерминантнами специфичности и каталитическим аппаратом. Важно, что конформация неактивного домена почти идентична зимогенной форме caspase-7.
Как и в случае каспазы-8, не только расщепление необходимо для активации caspase-9, но оно также недостаточно для продукции активного энзима [3,23]. Каспаза-9 активируется с помощью мало-масштабной перестройки поверхностной петли, которая предопределяет расщепление субстрата и каталитические остатки [22]. В простейшей модели это достигается с помощью димеризации мономеров caspase-9 внутри apoptosome, с интерфейсом димера, обеспечивающим поверхность, подходящую к каталитической организации активного сайта.
Хотя caspase-9 является общим инициатором внутренне присущего пути, недавние исследования показали, что необходима caspase-2 для апоптической реакции на нейротрофическую deprivation [24] и повреждения ДНК [25], субнабор внутренних стимулов. Caspase-2, по-видимому, активируется с помощью взаимодействия с комплексом высокого мол. веса, который нуждается в CARD каспазы-2 [26]. Компоненты этого комплекса ещё не идентифицированы, но показано, что он независим от Apaf-1. Как и у др. инициаторных каспаз зимоген caspase-2 является латентным мономером (F Scott, K Boatright and G Salvesen, unpublished data) и не требуется расщепления для её активации [26]. Скорее всего, активная форма caspase-2 существует и в расщепленном и нерасщепленном состоянии, в комплексе с активатором высокого мол. веса неизвестного состава.
Executioner caspases-3 and -7
В сильном контрасте с инициаторными исполнительные зимогены caspase-3 и -7 существуют в цитозоле в виде неактивных димеров [4]. Они активируются с помощью ограниченного протеолиза внутри своего междоменового линкера, который осуществляется с помощью инициаторной каспазы или случайно с помощью др. протеаз в специфических условиях (Figure 2b). Caspase-6 изучена недостаточно по сравнению с caspases-3 и 7, но отнесена к исполнительным каспазам на основании отсутствия длинного pro-domain и своего презумптивного расщепления ниже инициаторов. Кроме того, в рекомбинантной форме её зимоген является димерным [27]. Кристаллическая структура зимогена caspase-7, активной caspase-7 и связанной с ингибитором caspase-7 служит в качестве модели, которая устраняет кажущийся конфликт между механизмом расщепления для активации исполнительных каспаз и механизмом димеризации для апикальной активации каспаз [28,29,30].
В цитозольных концентрациях в клетках человека зимогены caspase-3
и -7 уже димеры, но расщепление внутри их соотв. линкерных сегментов необходимо для активации [29,30]. ТО же самое переустройство каталитических и субстрат-связывающих остатков, наблюдаемый у caspase-9, происходит и у
caspase-7, указывая тем самым, что фундаментальный механизм активации зимогенов эквивалентен. Различны только движущие силы: линкерный сегмент pro-caspase-7
блокирует переустройство активного сайта вплоть до расщепления, после которого ordering of the active site until cleavage, whereupon
новые N- и C-терминальные последовательности помогают стабилизации активного сайта. Свойство, которое позволяет самостоятельным движущим силам сходиться на одном и том же механизме активации, благодаря необычной пластичности остатков, составляющих активный центр каспаз, который довольно необычно для протеаз преимущественно помещается в flexible петли, а не в области с упорядоченной вторичной структурой.
Почему зимогены исполнительных каспаз димерны, тогда как зимогены зачинающих каспаз мономерны при физиологических концентрациях? Частично это связано с относительно слабым гидрофобным характером интерфейса димеров у каспаз-8 и -9, которое сильно контрастирует с чрезвычайно гидрофобной природой интерфейса димеров каспаз-3 и 7. Так, Kd для димеризации caspase-3 более 50 nM [31], это больше на 3 порядка величин, чем Kd для caspase-8
(менее 50 mM) [5].
Исполнительные каспазы-3 и 7 имеют более короткие N-терминальные расширения, чем инициаторные каспазы и в течение некоторого времени роль этих prodomains оставалась неясной. они не участвуют в механизме прирожденной активации [32,33], но очевидно важны для эффективной активации исполнительных каспаз in vivo, возможно благодаря пространственной секвестрации или клеточной компартментализации [33,34].
Conclusions
Хотя инициаторные и исполнительные каспазы обладают разными механизмами активации - димеризация для initiators и расщепление между доменами для executioners - фундаментальный механизм латентности зимогена законсервирован: активация обоих типов каспаз нуждается в транслокации активационной петли. Для executioners, эта транслокация заблокирована с помощью стерического препятствия, накладываемого междоменовым линкером. Для initiators, сначала должна произойти димеризация, которая позволяет активационной петле взаимодействовать с соседним мономером. Мы предполагаем, что все инициаторные каспазы д. подвергаться действию механизма monomer-dimer активации, за счёт гомодимеризации или даже гетеродимеризации (как это предполагается для caspase-8 и FLIP [18]). Имеющиеся данные подтверждают, proximity-induced активация м.б. приложима к инициаторным каспазам, участвующим в воспалении. Установлено, что у людей caspases-1 и -5, по-видимому, собираются в ансамбль в interleukin-1β активаторном комплексе, наз. 'inflammasome' [35], тогда как генетические доказательства у мышей указывают на взаимодействия между белками ортологами caspases-1 и -11 [36]. Интересно, что это м.б. примеры гетеродимеризации, важные для активации цитокинов.
Пересмотр гипотезы для активации инициаторных каспаз имеет важные последствия для интерпретации эксперим. результатов, связанных с активностью каспаз. Напр., большинство исследований интерпретировало расщепление каспаз как доказательство их активации. Это приложимо только для исполнительных каспаз, которые активируются за счёт такого расщепления. Безусловно расщепление caspase-8 и -9, описанное в большинстве публикаций обычно является следствием их активации. Расщепление инициаторных каспаз не способствует их активности несмотря на то, что они уже в димерной конфигурации. В этом контексте концепция обратной (feedback) активации executioners (caspases-3 и -7) с помощью initiators (caspases-8, -9 и -10) м.б. неправильной.
Разумно полагать, что инициальное активирующее событие на протеолитическом пути не м.б. самим протеолизом. В самом деле, большинство протеолитических каскадов инициируется с помощью кофакторами управляемых конформационных изменений в зимогенах протеаз. В случае апоптоза специфические конформационные изменения, управляемые с помощью кофакторов (DISC или apoptosome), это димеризация. Induced proximity преодолевает энергетический барьер для димеризации инициаторных каспаз, чтобы превратить бимолекулярные взаимодействия в одномолекулярные. Как только сгенерирован первый протеолитический сигнал м. начинаться специфический протеолиз, чтобы направить вперед каскад. Мы полагаем, что механизм активации исполнительных каспаз является недавним приобретением. Исходным же механизмом м.б. proximity induced
димеризация.
Update
Две группы недавно выявили неожиданный аспект внутреннего пути активации. В противоположность простейшему процессу, представленному на Рис. 1, активации caspase-8 в Fas-индуцированном DISC, активация caspase-8 с помощью TNF пути происходит не на ассоциированном с мембраной сигнальном комплексе [37,38]. Скорее caspase-8 активируется с помощью ассоциации с цитозольным комплексом во время TNF-индуцированного апоптоза. С др. стороны, описана кристаллическая структура caspase-2 в комплексе с aldehyde ингибитором [39]. В этой структуре caspase-2 была расщепленным димером с интерфейсом, стабилизированным с помощью дисульфидных связей. Это подтверждает роль redox условий в модуляции активации caspase-2 с помощью димеризации.
Сайт создан в системе
uCoz