Сравнение расположения хромосом между клонами фиксированных клеток предоставляет лишь непрямые механистические доказательства неслучайного расположения хромосом. Сложная динамика митотических хромосом м. наблюдаться только непосредственно в живых клетках. GFP белки слитые со стержневыми гистонами широко используются для отслеживания динамики хроматина в живых клетках [41]. Однако, GFP-нагруженные гистоны не позволяют различать с помощью светового микроскопа отдельные хромосомы в интерфазе или во время всех стадий митоза, из-за высокой компакции хромосом в метафазе и анафазе. Поэтому стали использовать паттерн photobleaching GFP-histone-меченных клеток [11,12]. При этом подходе искусственные метки на хроматине создаются с помощью photobleaching избранных регионов ядра. Эти паттерны обесцвечивания остаются видимыми в течение нескольких часов из-за медленной замены стержневых гистонов в хроматине [10] и bleached и unbleached хромосомы, особенно после усиления с помощью non-bleached reference channel, м. отслеживаться в ходе всего митоза (Рис. 1c) [11,12].
3D time-lapse imaging живых клеток (т.e. 4D imaging, [42]) bleach-меченных хромосом подтвердило, что не происходят большие перестройки в позиции хромосом во время интерфазы [11,12]. Более интересно то, что когда расположенные в ядре хромосомы, из которых половина хромосом bleach-мечена, и в поздней G2 они проходят через митоз, то пост-митотические дочерние ядра обнаруживают чёткое разделение меченных от не меченных хромосом в виде двух кластеров, указывая на высокую степень передачи позиционного порядка с помощью митоза [11] (Рис. 1c). В разных исследованиях Walter et al. [12] оставляли только флюоресцентной небольшую периферическую область хроматина после bleaching большей части ядра. И снова в большинстве дочерних ядер флюоресцентные хромосомы обнаруживались в кластерах в небольших ядерных суб-регионах. Однако, обоих исследованиях наблюдали также некоторые пространственные перестройки хромосом. В частности, схема мечения, использованная Walter et al., была чувствительна к выявлению достоверных локальных изменений в непосредственном хромосомном окружении, из-за небольшого количества меченных хромосом. Всё это указывает на то, что хромосомы перемещаются преимущественно в позиции пост-митотических дочерних ядер, которые сходны, но не идентичны с таковым в материнском ядре [43-45].
Models for mitotic chromosome positioning
Mitotic chromosome dynamics
Во время открытых митозов у большинства высших эукариот пространственное расположение ядра обратимо нарушается и реконструируется в дочерних клетках после клеточного деления. Чтобы распределить генетическую информацию одинаково, существенно упаковать геном в очень компактные структуры, метафазные хромосомы, которые возникают в результате конденсации в профазе без изменения своего относительно др. положения [11,46]. Метафазные хромосомы м. двигаться как индивидуальные единицы во время митозов. Первой ступентью в разборке ядра является разрыв ядерной оболочки, который облегчается механическими разрывами в клетках млекопитающих [47]. Это определяет начало прометафазы. Хромосомы уже сконденсированы на этой стадии и начинают последовательно прикрепляться к микротрубочкам веретена своими кинетохорами, возможно стохастически [48]. Хромосомы прикрепляются биполярным образом, затем собираются вокруг центральной части веретена, формируя метафазную пластинку. Как только все хромосомы окажутся соотв. расположены, начинается анафаза с деградации физической связи между сестринскими хроматидами [49]. Сестринские хроматиды движутся самостоятельно е противоположным полюсам чтобы сформировать дочерние ядра, которые покрываются вновь формируемыми ядерными оболочками в телофазе. Последующая isometric деконденсация хроматина полностью восстанавливает интерфазные ядра в дочерних клетках [50,51]. Предложены разные модели этой сложной динамики индивидуальных хромосом.
Physical linkage between chromosomes/mitotic preset
На основании наблюдений в FISH исследованиях, которые показали неслучайное позиционирование хромосом в метафазных rosettes в клетках человека [26], было высказано предположение, что физическое сцепление между соседними хромосомами во время митоза м. помогать сохранять относительные их позиции (Рис. 2a).
Некоторые наблюдения согласуются с этой модель. Во-первых, во время конденсации и деконденсации хроматина не происходит крупных позиционных изменений [46,51]. Во-вторых, во время congression хромосом в метафазную пластинку относительное соседство всё ещё сохраняется [11,52]. В третьих, симметричные положения хромосом обнаруживаются в пост-митотических сестринских клетках, подтверждая зависимость от метафазной конфигурации, 'mitotic preset'
[37]. Важно, что эксперименты с микроманипуляциями показали, что хромосомы в самом деле физически прикреплены др. к др. во время метафазы [53]. Молекулярные основы подобной связи неизвестны. Физическое сцепление создает интуитивное объяснение того, как непосредственное хромосомное соседство м.б. сохранено во время митозов. Однако, трудно представить, как радиальное расположение всех хромосом м. передаваться посредством связей, т.к. метафазная пластинка довольно плоская структура, и относительные позиции вокруг оси веретена т.о. теряются при митозах, позволяя только очень ограниченную позиционную предетерминацию трехмерного ядра. Кроме того, в недавних исследованиях не было подтверждена неслучайная конфигурация метафазных розетеок [28].
Tethering of chromosomes by the nuclear envelope
Др. модели позиционирования хромосом предполагают, что относительное положение хромосом рандомизировано во время митоза и воссоздаётся в дочерних
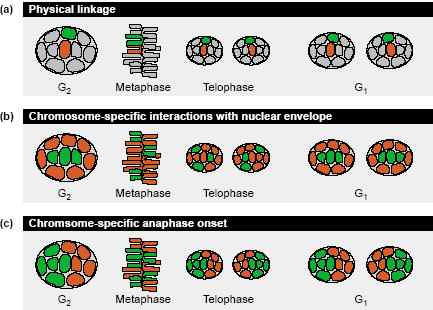 Models of mitotic chromosome positioning. (a) Physical linkage between chromosomes in interphase and mitosis for conservation of neighborhood relations. (b) Mitotic chromosome dynamics randomize chromosome positioning. Chromosome-specific interactions with the nuclear envelope then establish radial positioning during early G1. (c) Positional information along the spindle axis is lost after chromosomes have congressed to the flat metaphase plate. Chromosome-specific anaphase onset re-establishes chromosome positions along this axis during early anaphase. Positions along the metaphase plate are maintained by essentially linear congression and segregation (not shown).
Models of mitotic chromosome positioning. (a) Physical linkage between chromosomes in interphase and mitosis for conservation of neighborhood relations. (b) Mitotic chromosome dynamics randomize chromosome positioning. Chromosome-specific interactions with the nuclear envelope then establish radial positioning during early G1. (c) Positional information along the spindle axis is lost after chromosomes have congressed to the flat metaphase plate. Chromosome-specific anaphase onset re-establishes chromosome positions along this axis during early anaphase. Positions along the metaphase plate are maintained by essentially linear congression and segregation (not shown).
ядрах с помощью специфических взаимодействий некоторых хромосом с воссозданной ядерной оболочкой (Рис. 2b). Подтверждение этой модели получено при сравнении покоящихся клеток и клеток, которые повторно вступают в митоз после покоя [31]. Было установлено, что хромосомы оккупируют случайно радиальное положение в покоящихся клетках. Только после того, как клетки прошли через митотические деления наблюдается типичная периферическая локализация бедных генами хромосом. Гетерохроматиновые белки, которые, как было показано, взаимодействуют с белками ядерной мембраны [54,55] м. представлять собой молекулярные связи, которые закрепляют бедные генами хромосомы и богатые гетерохроматином в периферических позициях, когда они контактируют с ядерной оболочной за счёт случайных движений во время ранней G1. Однако, попытки оценить эту модель в клетках, лишенных одного из таки х белков ядерной мембраны, оказались безуспешными выявить ожидаемые изменения в радиальном положении хромосом [32]. С др. стороны, усиление динамики хроматина наблюдали в живых клетках во время ранней G1 [12], это м. отражать движения по ре-позиционированию, когда повторно формируется ядерная оболочка. Однако, во время этой стадии клеточного цикла ядра от слипшихся клеток также уплощены, т.к. клетки повторно присоединяются к субстрату и растут как результат деконденсации ДНК. Эти события связаны с увеличением динамики хроматина, которые не вносят вклада в позиционные изменения хромосом [11,50,51].
Хотя модель специфичных для хромосом взаимодействий с ядерной оболочкой и м. объяснить, как устанавливается радиальный порядок, она не даёт какого-либо объяснения наблюдению предпочтительного соседства определенных хромосом, которое должно достигаться где-то на определенном радиальном расстоянии от центра. Более того, нельзя объяснить, как достигается расположение хромосом в клональных производных клеток, напоминающее др. др. больше, чем в неродственных клетках.
Chromosome-specific timing of segregation
Визуализация в живых клетках bleach-меченных хромосом указывает на то, что неслучайные относительные позиции хромосом устанавливаются во время ранней анафазы [11] (Рис. 2c). Две половинки ядра, дифференциально меченные с помощью photobleaching, использовали для анализа положения хромосом относительно митотического веретена. Эксперименты, в которых границы мечения были ориентированы параллельно оси веретена, показали, что позиции в плоскости метафазной пластинки в основном поддерживаются и в дочерних ядрах (Рис. 1c,
верхний ряд). Учитывая в основном линейность движений хромосом вдоль микротрубочек веретена во время congression и сегрегации, это не явилось неожиданностью. Напротив, эксперименты с меченными границами, ориентированными перпендикулярно оси веретена, продемонстрировали, что хотя пространственный порядок вдоль оси веретена теряется во время congression в плоскость метафазной пластинки, этот порядок затем восстанавливается во время сегрегации хромосом, так что пост-митотические дочерние ядра снова оказываются сходными с материнским ядром (Рис. 1c, нижний ряд). Отслеживание хода центромер во время анафазы показывает, что время инициации движения хромосом в направлении полюсов коррелирует с положением вдоль оси веретена в дочерних клетках [11]. Это привело к модели, согласно которой время сегрегации специфических хромосом д. предопределять их положение вдоль оси веретена.
Эта модель подтверждается ранними исследованиями времени разделения центромер в в метафазных пластинках [56]. Так, хромосомы с большими количествами перицентромерного гетерохроматина воспроизводимо разделяются поздно в метафазе. Кроме того, это последовательное разделение центромер м.б. нарушено лекарствами, что предупреждает формирование конституитивного гетерохроматина как в фиксированных [57] , так и в живых клетках [11]. Дополнительные подтверждения идеи, что количество околоцентромерного гетерохроматина м. влиять на время начала анафазы, получены в экспериментах с искусственными хромосомами у дрожжей, у которых повышенные количества околоцентромерного гетерохроматина задерживали сегрегацию [58].
В противоположность двум моделям, упомянутым выше, хромосом-специфическое время расхождения согласуется с обоими способами неслучайного позиционирования хромосом (т.e. с радиальным позиционированием и предпочтительным соседством). Эта модель предсказывает, что интерфазные позиции в основном зависят от состава центромер скорее, чем от последовательностей хромсомных плеч. Важно, что эта модель не исключает возможности хромосом-специфичных взаимодействий с ядерной оболочкой, что м. позднее модифицировать позиционирование пост-митотических хромосом во время ранней
G1.
Quantitative hypothesis testing with computer models
and simulations
Оценка любого гипотетического механизма неслучайного расположения хромосом нуждается в ситуации, при которой он неактивен. Этого не всегда легко достичь экспериментально, если, напр., участвуют некоторые избыточные межбелковые взаимодействия, как в случае взаимодействий с ядерной оболочкой. В таких случаях компьтерное моделирование м. очень помочь в предсказании конфигураций хромосом в контрольных и нарушенных условиях in silico. Такой подход был предпринят, чтобы генерировать reference данные для in vivo исследований позиционирования хромосом [11] и проиллюстрирован на Рис. 3.
Симуляции предсказывают передачу положений хромосом вдоль плоскости метафазной пластинки, тогда как позиционная информация вдоль оси веретена д. теряться после congression, это д. приводить к рандомизации положений хромосом вдоль этой оси в дочерних ядрах. Хотя первое предсказание сопоставимо экспериментальным наблюдениям, второе находится в резком контрасте. Из-за этого модель была модифицирована за счёт введения хромосом-специфйичного начала анафазы. Симуляции с этой новой моделью оказались в согласии с экспериментами, это демонстрирует, что такое свойство в принципе возможно
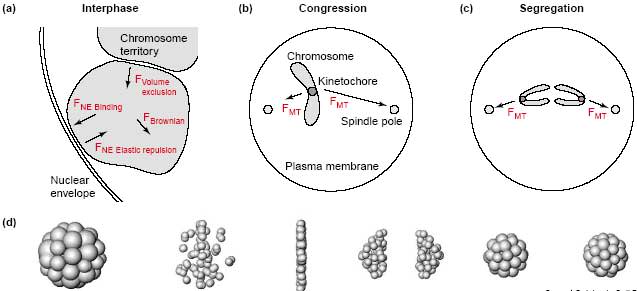 Computer model and simulations of mitotic chromosome dynamics. (a) Interphase chromosomes modeled as spheres that occupy non-overlapping
territories in the nucleus with sizes according to their DNA content [59]. Random chromosome movements occur by Brownian motion (FBrownian),
but are limited by exclusive volume interaction with neighboring chromosomes (FVolume exclusion) and interaction with the nuclear envelope
(FNE Elastic repulsion, FNE Binding). (b) Long-range dynamics after attachment of chromosomes to both spindle poles by microtubules. The microtubule-dependent force (FMT) towards the more distant spindle pole is larger, leading to displacement towards the metaphase plate.
(c) After removal of cohesion between sister chromatids, they are
Computer model and simulations of mitotic chromosome dynamics. (a) Interphase chromosomes modeled as spheres that occupy non-overlapping
territories in the nucleus with sizes according to their DNA content [59]. Random chromosome movements occur by Brownian motion (FBrownian),
but are limited by exclusive volume interaction with neighboring chromosomes (FVolume exclusion) and interaction with the nuclear envelope
(FNE Elastic repulsion, FNE Binding). (b) Long-range dynamics after attachment of chromosomes to both spindle poles by microtubules. The microtubule-dependent force (FMT) towards the more distant spindle pole is larger, leading to displacement towards the metaphase plate.
(c) After removal of cohesion between sister chromatids, they are
достаточно для объяснения предпочтительного позиционирования вдоль этой оси. Важно, что симуляции со случайным началом анафаз (эквивалент неактивности предполагаемого механизма) м.б. сравним с потенциальными экспериментальными пертурбациями начала специфических анафаз при индукции деконденсации гетерохроматина [11 ]. Компьютерные модели м. также помочь в оценке др. двух моделей динамики митотических хромосом, касающихся или хромосом-специфического прикрепления к ядерной оболочке или физической связи между хромосомами.
Conclusions and future directions
Even though it is becoming clear that chromosomes
occupy preferred positions in the interphase nucleus,
we are still far from understanding how these patterns
are established and maintained in dividing cells. The
models for mitotic chromosome positioning discussed
here are still at a highly speculative stage and will have
to address the underlying molecular mechanisms. Quantitative
assays of chromosome positioning in live cells
have now set the stage for thorough testing of the
required factors. This will probably include downregulation
of genes by RNA interference, perturbation by
specific drugs or analysis of chromosomes with modified
sequence composition. Predictions from computer simulations
will help us to evaluate any mechanism of chromosome
positioning quantitatively A second key task is to define the functional consequences of preferred chromosome positions. Correlation
between changes in gene expression state and nuclear
relocation has been described for several loci (reviewed in
[1,2,23,24]). Functional relevance is also suggested by the
observation of clustering of chromosomes that frequently
undergo tumor-specific translocations [35,36]. It will be
important to follow changes in chromosome positioning
during embryonic development and differentiation in live
cells and to interfere with potential specific chromosomal
rearrangements to assay their functional consequences.
Сайт создан в системе
uCoz

