Kimmel et al., 2003) предположили, что Edn1 м. действовать в виде градиента внтри дуг, с наивысшими уровнями Edn1 в вентральных частях и а элементы внутри дуг имеют дифференциальные уровни зависимости от Edn1 вдоль дорсо-вентральной оси. Указывает ли это на то, что Edn1 м. действовать как аттрактант или сигнал наведения для клеток НГ, неясно. Однако, экспрессия tyrosin kinase ephrin receptor,
мутантных рыбок и м. иметь важные последствия для морфогенеза (Miller et al., 2000; Miller, Kimmel, 2001). Т.к. большинство членов семейства ephrin участвует непосредственно или косвенно в наведении клеток и формировании эмбриональных компартментов (Flanagan, Vanderhaeghen, 1998; Wilkinson, 2000), то регуляция
с помощью Edn1 м. активировать экспрессию генов, необходимых для миграции клеток НГ или их последующего перемещения внутри дуг (Cerny et al., 2004). Картирование судеб клеток НU у endothelin мутантов мышей и рыб и неправильная экспрессия Edn1 вдоль пути миграции клеток НГ д. помочь решить этот вопрос.
Отсутствие
edn1 ведет у рыбок данио к потере вентральных частей мандибулярной и гиоидной дуг и к трансформации структур дуг вдоль дорсо-вентральной оси. Такие изменения скорее всего отражают потерю экспрессии нормального гена в вентральной (дистальной) части дуг. Однако, Edn1 м. также ограничивать экспрессию более дорсальных (проксимальных) генов, а дефекты в результате такого ограничения м. вносить вклад в потерю mandibular качественных особенностей у
Edn-/- или Ednra-/- мутантных эмбрионов. У мышей потеря
Edn или Ednra ведет к драматическим изменениям в экспрессии генов со ст. Е9.5, включая членов семейства
Distalless Dlx3 и Dlx6, членов семейства helix-loop-helix twist
dHAND/HAND2 и
eHAND/HAND1, Msx1, goosecoid (gsc), Barx1 (Clouthier et al., 1998; Thomas et al., 1998; Clouthier et al., 2000). Из этих факторов, регуляция экспрессии
HAND2 с помощью Edn1 изучена лучше всего и является прекрасным примером Edn1-зависимого иерархического сигнального каскада (Рис. 2). Экспрессия
HAND2 у мышей зависит от экспрессии и
Dlx5 и Dlx6 (Charite et al., 2001; Beverdam et al., 2002; Depew et al., 2002). Один цис-действующий элемент, как было установлено, управляет специфичной для дуг экспрессией
HAND2 (McFadden et al., 2000; Charite et al., 2001). Этот элемент содержит несколько Dlx6 консенсусных связывающих сайтов (Charite et al., 2001) и м. управлять экспрессией
lacZ трансгена (McFadden et al., 2000; Charite et al., 2001; Ruest et al., 2003) или
Cre (Ruest et al., 2003) по всему эндогенному домену
HAND2 в дистальной части дуг. Однако, целенаправленная инактивация энхансера лишь нарушает экспрессию
HAND2 в проксимальном домене
HAND2 мандибулярной дуги (Yanagisawa et al., 2003), это указывает на то, что, по крайней мере, один дополнительный энхансер участвует в регуляции экспрессии
HAND2 в дуге. Этот цис-действующий элемент, предположительно, регулируется с помощью Dlx5, т.к. экспрессия
HAND2 подавляется у
Dlx5/Dlx6-/- эмбрионов.
Т.к. механизм, с помощью которого Edn1 индуцирует экспрессию
HAND2 выяснен недостаточно, точная функция HAND2 в развитии челюстей у млекопитающих неясна. Целенаправленная инактивация всего
HAND2 гена приводит к эмбриональной гибели на ст. Е10.5 из-за сосудистых дефектов, это препятствует анализу его роли в черепнолицевом развитии (Srivastava et al., 1997; Yamagishi et al., 2000). Однако, анализ перед гибелью иллюстрирует, что клетки НГ внутри мандибулярной дуги способны воспринять дистальную судьбу и затем подвергаются апоптозу, это указывает на то, что HAND2 м. действовать как паттерн-формирующий и/или жизнеспособности фактор (Thomas et al., 1998). Целенаправленная инактивация Dlx6 энхансера инактивирует экспрессию
HAND2 только в проксимальной части домена экспрессии
HAND2, в результате возникают лишь незначительные изменения в структуре челюстей, включающие укорочение нижнечелюстной кости и потерю артикулярного отростка (Yanagisawa et al., 2003). Пониманию функции HAND2 в формировании паттерна клеток НГ возможно поможет условный нокаут
HAND2 в краниальных клетках НГ, так фенотип, наблюдаемый у
Dlx5/Dlx6-/- эмбрионов, у которых экспрессия
HAND2 подавлена, даёт некоторые указания на важность Edn1/HAND2 пути. Дистальные структуры челюстей у
Dlx5/Dlx6-/- мутантов подвергаются гомеозисной трансформации в более проксимальные структуры челюстей. Это указывает на то, что Edn1-индуцированная экспрессия
HAND2 осуществляемая посредстом Dlx5 и Dlx6, м.б. одним из ключевых факторов, обеспечивающих качественные особенности дистальных клеток НГ в мандибулярной дуге (Рис. 2А).
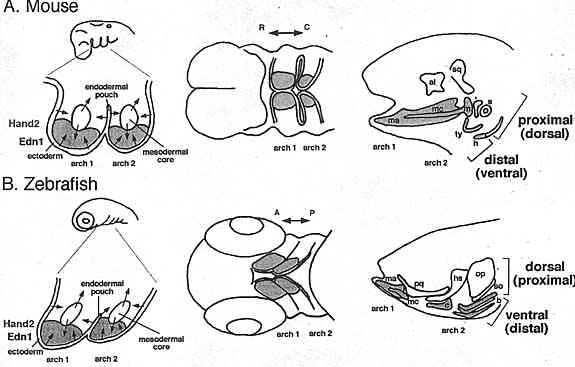
Более строгие доказательства функции в формировании мандибулярного паттерна Edn1/HAND2 получены на рыбках данио (Рис. 2В). Анализ экспрессии генов внутри глоточных дуг у
suc/et1 мутантных рыб иллюстрирует сходные изменения в экспрессии генов с наблюдаемыми изменениями у
Edn1-/- и Ednra-/- эмбрионов мышей. Сюда входят, снижение экспрессии
dlx2, dlx3, gsc, msxE, hand2 в вентральной части дуги (Miller et al., 2000). Разрушение
edn1, однако, не влияет на дорсальную экспрессию ни
dlx2, ни
gsc. Среди генов, экспрессируемых вентрально,
hand2, по-видимому, играет критическую роль в формировании паттерна вентральной части дуг. Мутации в гене
hand2, наз. hands off (han) выявлена при скрининга мутаций, затрагивающих развитие сердца (Yelon et al., 2000). Мутация
hans6 вызывает потерю функции гена
hand2 и последующие дефекты сердечнососудистого паттерна спустя 24 ч после оплодотворения, включая отсутствие и сердца и крови. Однако, рыбки данио м. жить, по крайней мере, 4 дня без кровообращения, что позволяет анализировать роль hand2 в развитии глоточных дуг. У
hand2 мутантов вентральные хрящи, включая Меккелев хрящ (первая дуга) и ceratohyal (вторая дуга), отсутствуют, и вместо этого замещены небольшими хрящевыми узелками (miller et al., 2003). Дорсальные хрящи, включая palatoquarate, pterygoid отросток кости palatoquadrate и hyosymplectic, все они присутствуют, но слегка уменьшены в размере.
Ген
hand2 м.б. точкой развилки для Edn1 регуляции развития дуг, т.к. многие из генов, чья экспрессия нарушается у мутантов
suc/et1, всё ещё экспрессируются у мутантов
han/hand2, включая
dlx3 и EphA3 (Рис. 2В) (Miller et al., 2003). Другие, включая
gsc, полагаются на экспрессию
hand2, хотя эта потребность, по-видимому, заключается в поддержании экспрессии
gsc скорее, чем в её инициации. Интересно, что экспрессия msx генов, включая
msxB и msxE, в вентральных частях дуг усиливается в отсутствие
hand2 (Miller et al., 2003). Т.к. трудно определить соотв. ортологи у млекопитающих, но Msx1 и Msx2, безусловно участвуют в развитии мандибулярных дуг у мышей (Satokata, Maas, 1994; Bei, Maas, 1998; Thomas et al., 1998; Tucker et al., 1998; Satokata et al., 2000; Zhang et al., 2003). Далее. т.к. маркёры клеток НГ дорсальных частей дуг ещё не идентифицированы у рыбок данио, поэтому Miller et al., (2003) нашли, что домен экспрессии маркёра дорсальной параксиальной мезодермы
engrailed2 (eng2) расширяется у у мутантных эмбрионов
hand2. Всё это согласуется с находками у мышей и указывает на то, что HAND2 м. действовать как паттерн-формирующий эффектор Edn1 в клетках НГ путём индукции экспрессии вентральных генов.
Edn1 and Joint Formation
У рыбок данио суставы формируются в первой дуге между вентральными и дорсальными производными мандибулярных дуг, разделяя Меккелев хрящ и palatoquadrate. У
suc/et1 мутантных эмбрионов формирование суставов нарушено, вентральный и дорсальный хрящи сливаются (Miller et al., 2000, 2003), это указывает на то, что Edn1 каким-то образом специфицирует область сустава или регулирует его поддержание и развитие. Одним из маркёров суставной области у рыбок данио и Xenopus является ортолог гена Drosophila
bagpipe (Azpiazu, Frasch, 1993), транскрипционный фактор, названный
bapx1 (Nkx3.2) (Newman et al., 1997). Внутри мандибулярной дуги
bapx1 локализуется в мезенхиме между дорсальной и вентральной половинами и, по-видимому. демаркирует клетки, которые будут формировать сустав, с экспрессией
dlx2 дорсальнее и
hand2 вентральнее этой области (Miller et al., 2003). Дефекты суставов, наблюдаемые у мутантов
suc/et1, согласуются с этим, т.к.
bapx1 подавляется в области суставов (Miller et al., 2000). Потеря
bapx1, по-видимому, обусловливает этот дефект суставов, т.к. рыбки данио, которым инъецировали morpholino против
bapx1 вызывают сходные слияния дорсальных и вентральных хрящей (Miller et al., 2003). Т.к. экспрессия edn1 необходима для экспрессии
bapx1 в дугах, то этот эффект не является результатом только потери экспрессии
hand2. Фактически, экспрессия
bapx1 распространяется на вентральную часть дуги у
hand2 мутантных эмбрионов, указывая тем самым, что
edn1 и
hand2 обладают несколько отличающимися функциями в установлении дорсо-вентральных доменов внутри глоточных дуг.
Целенаправленная инактивация
Bapx1 у мышей не приводит к дефектам развития temporomandibular сустава (Tribioli, Lufkin, 1999; Akazawa et al., 2000). Это не является сюрпризом, т.к. сустав между Меккелевым хрящом м palatoquadrate у рыбок данио, как полагают, соответствует суставу между молоточком и наковальней в среднем ухе млекопитающих (Wilson, Tucker, 2003). Т.к. эмбрионы
Bapx1-/- имеют дефекты в развитии и тимпанической и gonial костей в среднем ухе, но malleus-incus сустав остаётся интактным (Tucker et al., 2004). Эти находки указывают на то, что генетическая регуляция становления челюстных сочленений подвергается эволюционным изменениям или что места суставных артикуляций сдвигаются во время эволюции, так что гомологичные суставы увеличиваются или теряются (de Beer, 1937). Однако, ген или гены, отвечающие за формирование суставов челюстей, м. всё ещё зависеть от Edn1 сходным образом с
bapx1 у рыбок данио, т.к. кости, происходящие из мандибулярной дуги у
Edn1-/- и Ednra-/- эмбрионов, формируют аномальные суставы с jugal костью zygomatic дуги скорее, чем с temporal костью (Kurihara et al., 1994; Clouthier et al., 1998), подтверждая тем самым изменения в ориентации или локализации этих суставов во время развития.
Nature of Edn1 Function in the Pharyngeal Arches: Cell Autonomus Action, Gradient, or Both?
Т.к. функция Edn1 является критической для формирования паттерна клеток Нг внутри глоточных дуг, механизм, с помощью которого это достигается, до конца неясен. Edn1, как растворимый фактор, по-видимому, действует не-клеточно-автономным образом во время развития клеток НГ. Клетки НГ, трансплантированные из меченных
suc/et1 эмбрионов в клетки НГ дикого типа у рыбок данио, нормально мигрируют и вносят вклад в развитие вентральных хрящей (Miller et al., 2000). Сходным образом, реципрокные трансплантаты дикого типа клеток НГ в эмбрионы
suc/et1 м. восстанавливать формирование вентральных хрящей в мутантном окружении. Комплементарным образом мутации в
Ednra у мышей, по-видимому, являются клеточно-автономными. У
Ednra мутантных химерных эмбрионов мышей большинство структур, происходящих из первой и второй дуг, состоят исключительно из клеток дикого типа, указывая тем самым, что мутантные клетки внутренне не способны формировать эти структуры (Clouthier et al., 2003). Это не является неожиданным, т.к. большинство рецепторов функционирует клеточно-автономно. Однако, некоторые др. структуры, производные дуг, которые деформированы у эмбрионов
Ednra-/-, по-видимому, не обладают той же самой клеточно-автономной потребностью. Элементы, происходящие из проксимальных частей первой (incus) и второй (Stapes и styloid отросток) дуг, содержат и дикого типа и
Endra-/- клетки, перемешанные гомогенно. Т.к. эти структуры уродливы у мутантных химер с высокой пропорцией мутантных клеток, то перемешивание клеток указывает на то, что передача сигналов Ednra или действует не-клеточно-автономно при формировании эти х структур, или не нужна вообще. Интересна гипотеза, согласно которой передача сигналов Ednra действует только в субнаборах клеток НГ, происходящих из специфических средний мозг/задний мозг областей. Эт о наиболее очевидно в первой дуге
Ednra мутантных химер, где все структуры за исключением incus, состоят из клеток НГ, происходящих из задней части среднего мозга и ромбомера 1 (r1) заднего мозга (Couly et al., 1996; Kontges, Lumsden, 1996). Наковальня имеет также вклад от r2, это указывает на то, что только НГ уровня среднего мозга и r1 нуждаются в передаче сигналов Ednra.
Эта модель "crest dependence" более трудна для интерпретации внутри второй глоточной дуги, которая занимается прежде всего клетками Нг из r4 и в меньшей степени клетками из r3 и r5. Однако, градиентная модель, предложенная Kimmel et al., (2003) для рыбок данио м. объяснить эту дифференциальную зависимость от передачи сигналов Ednra. У личинок рыбок данио вторая дуга содержит два больших хряща (hyosymplectic и ceratohyal) и два элемента из дермальной branchiostegal-opercle серии. Вентральные branchiostegal лучи, часто отсутствуют или редуцированны у мутантов
suc/et1, тогда как изменения в дорсальном opercle являются наиболее изменчивыми. Чтобы лучше понять эти изменения, варьирующие концентрации
edn1 morpholinos инъецировали рыбкам данио. Если эмбрионам вводили высокие дозы morpholono, то opercle были редуцированы в размерах, тогда как при низких концентрациях morpholino наблюдалась экспансия opercle. Эти изменения указывают на то, что формирование паттерна дуг осуществляется с помощью градиента Edn1. Наивысшие концентрации Edn1 (пик предполагаемого градиента) д. обнаруживаться в вентральных частях дуг, самых ближайших к клеткам, которые экспрессируют
edn1 (Miller et al., 2000). Модель градиента предполагает, что вентральные элементы (т.е. branchiostegal лучи) должны зависеть от высоких концентраций Edn1 для собственно формирования паттерна клеток НГ. Как только градиент снижается в дорсальных частях дуг, то согласно градиентной модели, структуры в этой области (т.е. opercle) д. обладать пониженной потребностью в Edn1 для собственного формирования и поэтому менее тяжело повреждаются при потере
edn1. Градиентная модель д. постулировать, что редукция Edn1 д. приводить к снижению склона концентрации градиента Edn1? , следовательно, более вентральная популяция клеток будет получать меньше Edn1 и будет редуцирована в размерах или будет воспринимать дорсальную судьбу, это м. объяснить увеличение opercle. Альтернативно, Edn1 м. просто специфицировать вентральный компартмент дуги без необходимости в градиенте, а дорсальный компартмент м. увеличиваться в его отсутствие.
Future Directions
Хотя существуют морфологические отличия черепа у мышей и рыбок данио, но многие одни и те же сигнальные факторы и генетические пути регулируют их развитие. Сравнительный анализ действия Edn1 во время развития глоточных дуг показал, что передача сигналов Edn1/Ednra индуцирует экспрессию дистальных (вентральных) генов, ингибируя при этом экспрессию более проксимальных (дорсальных) генов. Действуя таким образом, передача сигналов Edn1/Ednra формирует паттерны дистальных (вентральных) частей дуг, обеспечивая качественные особенности клеткам НГ и окружающей ткани. Однако, очевидные отличия в анатомии дуг у двух видов осложняют некоторые из интерпретаций.
Сила сравнительного анализа в том, что системы мышей и рыбок данио допускают уникальные для них манипуляции , позволяющие отвечать на общие вопросы, связанные с функцией Edn1 во время развития глоточных дуг. Одним из наиболее сильных аспектов биологии рыбок данио является способность претворять широко-масштабный скрининг мутаций. такой скрининг у мышей затруднителен и требует много времени. Очевидно, что у рыбок данио ещё будут выделены дополнительные эффекторы Edn1. Затем они м.б. тестированы на эпистатические взаимодействия с
edn1 или др. мутациями вентральных частей дуг. Дополнительным преимуществом рыбок данио является способность инъецировать эмбрионам morpholino, которые knock down экспрессию генов (Miller, Kimmel, 2001; Heasman, 2002), которая довольно стабильно нарушает функцию генов на относительно поздних стадиях (2-3 дня после оплодотворения), когда формируется ранний черепнолицевой скелет. После секвенирования генома рыбок данио стали возможны исследования микромассивов кДНК для выяснения профилей экспрессии разных мутаций.
Мыши также имеют одно преимущество - способность инактивировать специфические гены с помощью гомологичной рекомбинации. Новый подход, который комбинирует поиск генных ловушек с микромассивами кДНК и технологией нокаута у мышей, м.б. использован для выявления нижестоящих эффекторов передачи сигналов Ednra (Chen et al., 2004). Этот комбинированный подход упрощает скрининг генных ловушек (Gossler et al., 1989; Friedrich, Sorano, 1991; Forrestor et al., 1996; Bonaldo et al., 1998). SDoriano и др. сравнивали экспрессию генов в эмбриональных фибробластах мышей, выделенных из дикого типа и PDGFα-/- и PDGFβ-/- эмбрионов с помощью такого подхода в такой системе, пригодной для широкого круга молекул. Дифференциально экспрессируемые гены м.б. затем быстро инактивированы с помощью инъекций в бластоцисты соотв. целенаправленно полученных клонов ES клеток.
Дополнительные молекулярные техники, включая условное инактивирование генов у мышей (Kwan, 2002) и чувствительные к температуре мутантные аллели у рыбок данио (Rawls, Johnson, 2001) м. понадобиться для полного выяснения функции генов-эффекторов Edn1/Ednra.
Сайт создан в системе
uCoz