Всё это привело к гипотезе, что экзосомы м. представлять новый способ межклеточного общения [15,46]. Пока неясно, как экзосомы взаимодействуют со своими клетками-мишенями. М. б. предположены разные способы взаимодействия для разных типов клеток и это м.б. прямо связано с их функциями. Экзосомы м. сливаться с плазматической мембраной или эндоцитозироваться с помощью неизвестного способа интернализации. Экзосомы часто высвобождаются в виде небольших агрегатов, которые воспринимаются соседними клетками посредством механизма фагоцитоза. Нельзя исключить, что экзосомы в основном прикрепляются к клеточной поверхности, придавая новые свойства клеткам-мишеням [39].
Неизвестны также механизмы, регулирующие слияние MVB с клеточной поверхностью и тем самым сами секреторные процессы. EBV-трансформированные B-клеточные линии, прежде всего DC культуры и опухолевые клетки, обнаруживают постоянную секрецию экзосом. Для mast клеток и ретикулоцитов, предположено, что MVBs сливаются с клеточной поверхностью Ca
2+-зависимым способом [10,47]. Mast клетки действуют не только секретируя содержимое MVBs, но также содержимое гранул с плотной сердцевиной. Не ясно, оперирует ли та же самая кухня слияния в обоих случаях. Synaptotagmin VII участвует в слиянии лизосом с клеточной поверхностью [48], но не известно, секретируется ли содержимое MVBs и лизосом сходным образом. В дополнение к soluble NSF-attachment protein receptors (SNAREs), небольшие GTPases из Rab сверхсемейства также являются очевидными кандидатами на роль регуляции пришвартовки и слияния MVB. Изучение ретикулоцитов позволило предположить, что Rab 11,
Rab пути раннего эндоцитоза, м. выступать в качестве регулятора экзосомной секреции [49]. но эти исследования не позволили различать, действуют ли этиRab 11 мутанты на уровне образования экзосом или секреторных событий
per se. Др. кандидатами являются Rab белки, непосредственно участвующие в секреторных событиях, такие как Rab27 и Rab3 [50]. Хотя MVBs являются широко распространенными органеллами эндоцитотического пути, нельзя исключить, что клетки, секретирующие с экзосомами специальный набор белков, регулируют экзоцитотическое слияние.
Exosomes, an easy vehicle for transmissible
pathogens?
Исследования ретровирусов и в частности HIV, выявили способность вирусов захватывать внутриклеточную кухню биогенеза MVB для своего собственного отпочкования на клеточной поверхности; они м. также эксплуатировать кухню эндосом, где они нормально действуют [51]. В макрофагах людей, MHC class II компартменты со всеми характерными при знаками поздних эндоцитотических MVBs являются основным местом отпочкования и накопления HIV [52,53]. Это вместе со сравнительным изучением экзосом и HIV частиц [54], привело к гипотезе 'Trojan exosome' [55], которая предполагает, что покрытые оболочкой вирусы вынуждены эксплуатировать MVB путь для генерации вирусных частиц. Высвобождающиеся вирусы д. затем признаваться хозяином своими ILVs и после высвобождаться в виде экзосом со всеми присущими им свойствами. Эта заманчивая гипотеза, т.к. она объясняет легкое распространение ретровирусов и из плохую способность стимулировать иммунную реакцию. В согласии с этим было установлено, что экзосомы м. индуцировать аллогенные реакции, задерживающие отторжение трансплантата
in vivo, это м. иметь важные следствия для стратегии превентивной вакцинации [45]. Накопление в MVBs м.б. также благоприятным для зрелых вирусов, которые м. скрываться в хозяйском клеточном компартменте и эксплуатировать процесс экзоцитотического слияния для своего высвобождения. Тем не менее, несмотря на сходство между ретровирусами и экзосомами, имеются также некоторые признаки. которые нуждаются в дальнейшем изучении[56]. Композиция экзосом отличается от той, что в плазматической мембране. Следовательно, отпочкование вирусов от плазматической мембраны м. иметь др. композицию из intracellular/exosome-like вирусов. Более того, теперь ясно, сколь далеко вирусы модифицируют свойства MVB, внутрь которых они отпочковываются. ILVs/exosomes, возникающие в результате соединения hepatocyte growth factor tyrosine kinase substrate (Hrs) , чтобы убиквитинировать груз, который рекрутирует Tsg101. HIV-1 Gag воспроизводит Hrs и тем самым узурпирует Tsg101 и др. компоненты MVB
кухни, чтобы облегчить отпочкование вирусов [57]. Обход обычного пути биогенеза MVB м. модифицировать свойства MVBs, ILVs и экзосом. Кроме того, ретровирусы нуждаются в своих покровных белках, чтобы инфицировать клетки-мишени. Следовательно, м. ожидать существенных различий в том, как вирусы, по сравнению с экзосомами, взаимодействуют с клетками-мишенями.
Conclusions and perspectives
Since the initial studies on reticulocyte exosomes, recent
work has revealed that exosome secretion is a much
more general phenomenon with a range of important
regulatory functions. The discovery of prostasomes [58]
and argosomes [59] has led to the suggestion that an
‘exosomal’ type of communication is not limited to the
immune system, but may also function in conferring
fertility (in the case of prostasomes) and participating
in tissue-developmental processes (in the case of argosomes).
This is still an open hypothesis, and the definite
classification of these vesicles as exosomes requires
further exploration.
The description of the protein and lipid composition of
exosomes has greatly facilitated their characterization. It
should be noted, however, that the given composition is
global and does not reflect possible heterogeneity within
the exosome population. Exosomal vesicles isolated from
the cell culture supernatant, in particular from DCs, are in
most cases heterogeneous in terms of size (their diameters
range between 30–90 nm within the same population)
and even protein composition. Such heterogeneity can be
observed within a MVB and it still cannot be excluded
that different populations of ‘secretory’ MVBs exist in
a cell. Further investigation should also help to define
the different regulatory activities of exosomes and the
cellular and molecular basis for their specific targeting to
acceptor cells.
The discovery of the molecular machinery involved in
MVB biogenesis enables us to study the components
involved in exosome formation, regulation and secretion
using approaches such as overexpression, use of dominant
negatives or small interfering RNA technology.
Such approaches need to be validated and require a
delicate balance between efficient levels of transfection
and cell viability. Methods that could be applied to
block or stimulate exosome secretion in different cells
are also required to shed light on their functions. Such
methods await a better comprehension of the cellular
and molecular mechanisms regulating MVB fusion with
the cell surface. Any advances in this field will also be of
great value for the development of strategies to interfere
with the release of pathogens that use MVBs as
reservoirs.
Update
In addition to the proposed implication of exosomes in
the regulation of the immune response, recent studies
also highlight their role in pathological states. Proteomic
analysis of exosomes secreted by mesothelioma cells
revealed the presence of developmental endothelial
locus-1 (DEL-1). DEL-1 is a strong angiogenic factor
involved in the vascuolar development in the neighborhood
of the tumor, suggesting a role for exosomes in the
interaction between tumor cells and their environment
[61]. An additional role for exosomes in disease is suggested
by our studies showing that the cellular prion
protein (PrPc) and the transconformed infectious
PrPscrappie (PrPsc) are associated with exosomes in
the culture medium of non-infected and infected cells,
respectively. Furthermore, exosomes bearing PrPsc are
infectious, suggesting that exosomes may contribute to
intercellular membrane exchange and spread of prions
throughout the organism [62].
Сайт создан в системе
uCoz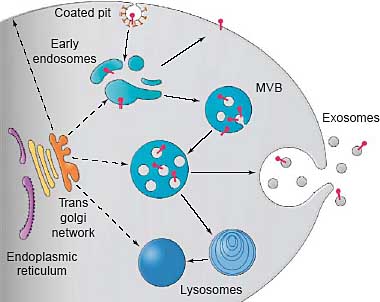 Schematic representation of the endocytic pathway. Membrane proteins (shown in red) internalized through clathrin-coated vesicles are
delivered to early endosomes. In early endosomes, molecules are
either recycled to the plasma membrane or sequestered in internal
vesicles. Early morphological observations revealed that the internal
vesicles of MVBs are generated by budding from the limiting
membrane into the lumen of endosomes [60]. In the degradation
pathway, MVBs fuse with lysosomes. In several haematopoietic and
non-haematopoietic cells, MVBs fuse with the plasma membrane, in
which case the internal vesicles of the MVB are released into the
extracellular medium as exosomes. Exosomes display the same
orientation as the plasma membrane, with extracellular domains of
proteins exposed at the surface, and enclosing a droplet of
cytoplasm.
Schematic representation of the endocytic pathway. Membrane proteins (shown in red) internalized through clathrin-coated vesicles are
delivered to early endosomes. In early endosomes, molecules are
either recycled to the plasma membrane or sequestered in internal
vesicles. Early morphological observations revealed that the internal
vesicles of MVBs are generated by budding from the limiting
membrane into the lumen of endosomes [60]. In the degradation
pathway, MVBs fuse with lysosomes. In several haematopoietic and
non-haematopoietic cells, MVBs fuse with the plasma membrane, in
which case the internal vesicles of the MVB are released into the
extracellular medium as exosomes. Exosomes display the same
orientation as the plasma membrane, with extracellular domains of
proteins exposed at the surface, and enclosing a droplet of
cytoplasm. 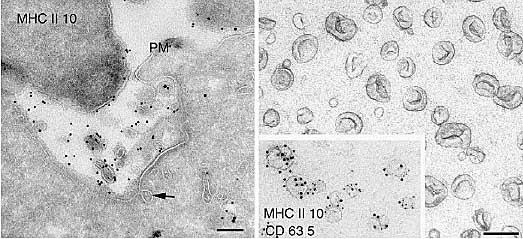 Fusion of MVBs with the cell surface and exosome release. Left panel: Detail of an ultrathin cryosection showing evidence for exocytic fusion of a MVB with the plasma membrane (PM). MHC-class-II-positive exosomes are present in the extracellular space. Clathrin-coated pits are
often observed at the plasma membrane in exocytic areas (arrow). Scale bars: 100 nm. Right panel: Purified exosomes were put on formvar-carboncoated electron microscopy grids, fixed, contrasted and embedded using a mixture of methyl cellulose and uranyl acetate. Inset: exosomes were double immunogold labeled for MHC class II and CD63. Primary antibodies were visualized with protein A coupled to gold (PAG10 and PAG5, respectively) before contrasting and embedding. Scale bars: 100 nm.
Fusion of MVBs with the cell surface and exosome release. Left panel: Detail of an ultrathin cryosection showing evidence for exocytic fusion of a MVB with the plasma membrane (PM). MHC-class-II-positive exosomes are present in the extracellular space. Clathrin-coated pits are
often observed at the plasma membrane in exocytic areas (arrow). Scale bars: 100 nm. Right panel: Purified exosomes were put on formvar-carboncoated electron microscopy grids, fixed, contrasted and embedded using a mixture of methyl cellulose and uranyl acetate. Inset: exosomes were double immunogold labeled for MHC class II and CD63. Primary antibodies were visualized with protein A coupled to gold (PAG10 and PAG5, respectively) before contrasting and embedding. Scale bars: 100 nm.