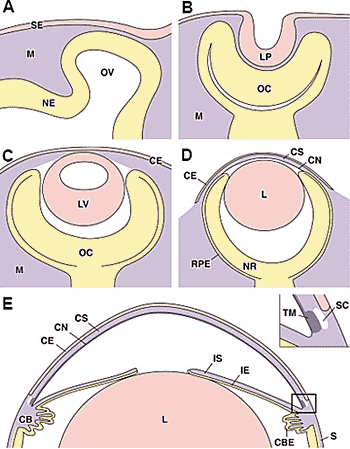
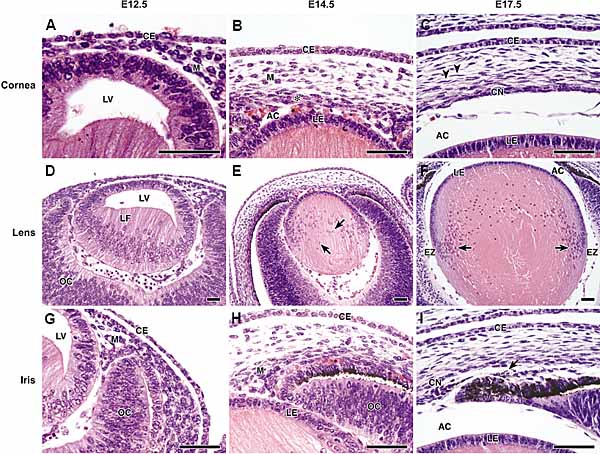
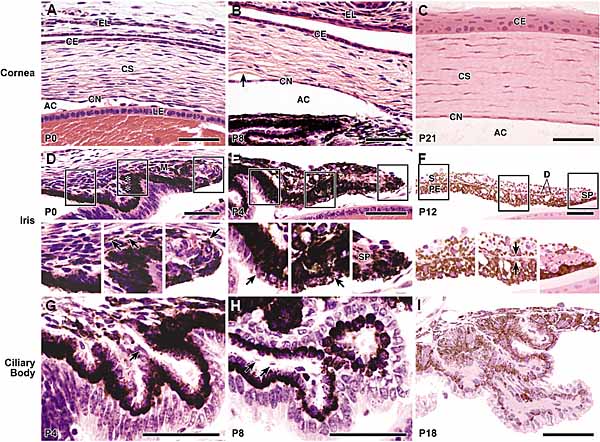
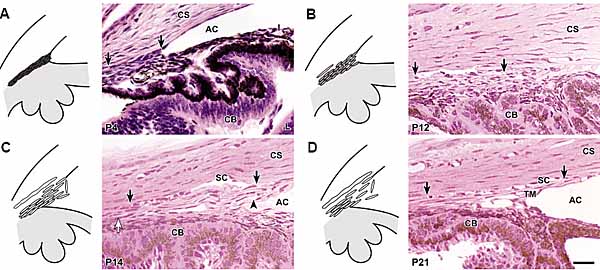
обнаруживают молекулярные отличия на E13.5 до появления морфологических отличий. Экспрессия
. Обычно, когда клетки периокулярной мезенхимы мигрируют в презумптивную роговицу, то экспрессия
выключается и клетки презумптивной роговицы начинают экспрессировать keratocan (молекулу ECM) т.к. дифференцируются кератиноциты. У
в презумптивной роговице и эти клетки не экспрессируют keratocan на E15.5 (Pressman et al., 2000). Т.о., LMX1B не обязателен для миграции мезенхимы в презумптивную роговицу, но необходим для нормальной дифференцировки этих клеток. Помимо keratocan, LMX1B влияет также на экспрессию др. молекул ECM.
мыши и некоторые пациенты с NPS имеют почечные дефекты. Эти дефекты касаются потери двух субтипов type IV коллагена, COL4A3 и COL4A4, в гломерулярной базальной мембране.
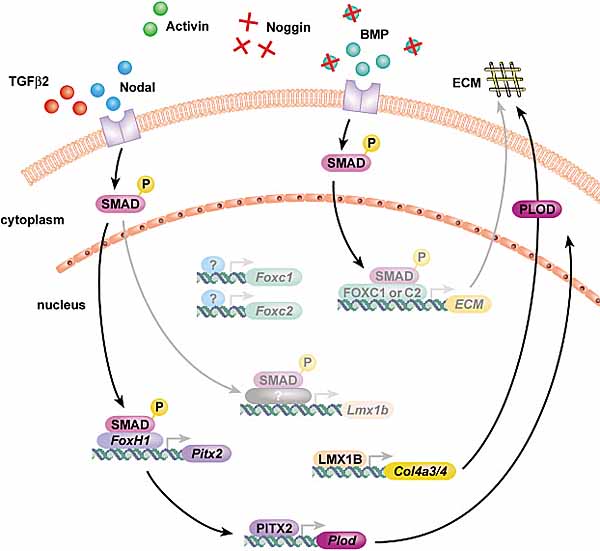
являются непосредственными транскрипционными мишенями LMX1B (Morello et al., 2001). Т.о., регуляция ECM м.б. основной ролью LMX1B в развитии глаз.
Ген
Cyp1b1 (Cytochrome P450, family 1, subfamily b, polypeptide 1) кодирует энзим, который участвует в развитии iridocorneal
угла. В развивающихся глазах мышей
Cyp1b1 экспрессируется на наиболее высоком уровне в цилиарном теле после рождения (Bejjani et al., 2002).
Cyp1b1-/- мыши в основном нормальны, но имеют фокальные аномалии iridocorneal угла (Libby et al., 2003). В затронутых областях уродства м. включать гипопластичную трабекулярную сеть, аномально локализованную базальную ламину в трабекулярной сети и iridocorneal адгезии. Рецессивные мутации в
CYP1B1 ассоциируют в врожденной глаукомой у людей (Stoilov et al., 1997, Bejjani et al., 1998, Plasilova et al., 1999, Bejjani et al., 2000, Belmouden et al., 2002). Онтогенетические аномалии у некоторых детей с врожденной глаукомой напоминают те, что обнаруживаются у
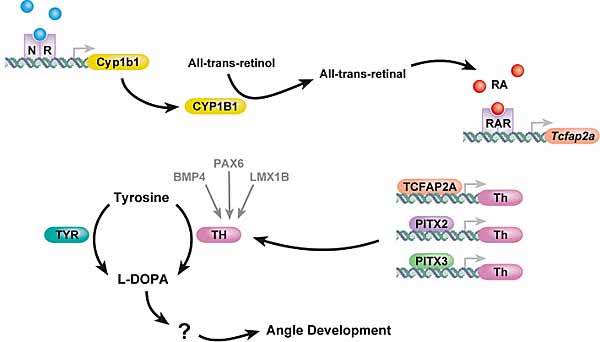 Fig. 6. Multiple genes implicated in anterior segment development and glaucoma may modulate L-dopa levels. Many of the genes implicated in anterior segment dysgenesis, elevated IOP and glaucoma may affect L-dopa levels. Most can be linked to L-dopa through tyrosine hydroxlase (TH,as discussed in the text). The dark arrows represent known direct relationships. TCFAP2, PITX2 and PITX3 can all directly bind to the tyrosine hydroxylase promoter. The fainter arrows and text indicate that the represented genes affects on TH and L-dopa may not be direct. BMP4, PAX6 and LMX1B can promote either tyrosine hydroxylase expression or the number of TH expressing neural crest cells during the development of other tissues, but how they do so is not known. How L-dopa modulates angle development also is not known. It is possible that either L-dopa itself or a catecholamine metabolite(s)of L-Dopa mediates an important signaling event(s).
Cyp1b1-/-
Fig. 6. Multiple genes implicated in anterior segment development and glaucoma may modulate L-dopa levels. Many of the genes implicated in anterior segment dysgenesis, elevated IOP and glaucoma may affect L-dopa levels. Most can be linked to L-dopa through tyrosine hydroxlase (TH,as discussed in the text). The dark arrows represent known direct relationships. TCFAP2, PITX2 and PITX3 can all directly bind to the tyrosine hydroxylase promoter. The fainter arrows and text indicate that the represented genes affects on TH and L-dopa may not be direct. BMP4, PAX6 and LMX1B can promote either tyrosine hydroxylase expression or the number of TH expressing neural crest cells during the development of other tissues, but how they do so is not known. How L-dopa modulates angle development also is not known. It is possible that either L-dopa itself or a catecholamine metabolite(s)of L-Dopa mediates an important signaling event(s).
Cyp1b1-/- мышей (Allen et al., 1955, Maumenee 1958, Libby et al., 2003). CYP1B1 принадлежит семейству мономерных со смешанной функцией monooxygenases (Sutter et al., 1994). Экспрессия
Cyp1b1 м.б. индуцирована ароматическими углеводами, действующими как лиганды для ядерного рецепторного комплекса (Denison et al., 1989, Shehin et al., 2000). Рецепторный комплекс состоит из двух basic helix-loop-helix белков, aryl hydrocarbon receptor (AHR) и aryl hydrocarbon nuclear translocator (ARNT) (Reyes et al., 1992, Dolwick et al., 1993). Предполагается, что CYP1B1 участвует в метаболизме сигнальных молекул, важных для развития глаз (Sarfarazi and Stoilov 2000). Возможно, что в отсутствие CYP1B1, ключевая сигнальная молекула не продуцируется или не активируется или напротив не деградирует или не деактивируется. Одной из возможностей является то, что CYP1B1 влияет на развитие переднего сегмента посредством механизма, участвующего в передаче сигналов ретиноевой кислоты. CYP1B1 окисляет all-trans-retinol до all-trans-retinal, это является скорость-ограничивающей ступенью в биосинтезе ретиноевой кислоты (Chen et al., 2000). Однако, точная роль CYP1B1in в развитии глаз не известна.
Cyp1b1-/- мыши м. позволить решить этот вопрос.
Tyrosinase modifies anterior segment dysgenesis
Ген tyrosinase (Tyr) идентифицирован в качестве модификатора дефектов iridocorneal уогла, присутствующих у мышей
Cyp1b1-/- (Libby et al., 2003). Мыши
Cyp1b1-/-, которые также дефицитны по Tyr, имеют более тяжелые аномалии iridocorneal угла, чем мыши
Cyp1b1-/- с функциональным Tyr. Tyr необходима для синтеза melanin, поэтому мыши
Tyr-/- являются albino. Демонстрация, что Tyr участвует в развитии iridocorneal угла м. объяснить повышенный показатель ASD у людей с альбинизмом (van Dorp et al., 1984).
Важно, что Tyr модифицирует также угловые фенотипы и у др. модельных мышей ASD.
Albino Foxc1+/- имеют более тяжелые аномалии iridocorneal угла, чем у пигментированных
Foxc1+/- мышей
(Libby et al., 2003). Т.о., эффект Tyr не является специфичным для Cyp1b1 недостаточности.
Tyrosinase, tyrosine hydroxylase, dopa and ASD
TYR превращает тирозин в dihydroxyphenylalanine (L-dopa). L-dopa
затрагивает выход из клеточного цикла и является предшественником онтогенетически важных catecholamines (Thomas et al., 1995, Zhou et al., 1995, Ilia and Jeffery 1999). Следовательно, TYR м. вносить вклад в развитие путём продукции L-dopa. Возможно, что недостаток Tyr усиливает аномалии iridocorneal угла благодаря нехватке L-dopa. Добавление L-dopa
albino Cyp1b1-/- мышам существенно смягчает дефекты развития. Это указывает на то, что Tyr затрагивает развитие переднего сегмента посредством механизма с участием L-dopa или L-dopa метаболитов (Libby et al., 2003).
Др. гены, влияющие на передачу сигналов L-dopa, также м. участвовать в развитии переднего сегмента, включая dopamine рецепторы, гены, затрагивающие метаболизм или передачу сигналов catecholamine и гены, влияющие на уровни L-dopa. Tyrosine hydroxylase др. энзим, который превращает тирозин в L-dopa. Следовательно, tyrosine hydroxylase и гены. влияющие на уровни tyrosine hydroxylase являются прекрасными кандидатами на участие в развитии глаз.
Многие др. гены развития переднего сегмента, упомянутые в этом обзоре, м. непосредственно или косвенно влиять на уровни tyrosine hydroxylase. BMP4, PAX6 и LMX1B м. способствовать активности tyrosine hydroxylase или пролиферации клеток нервного гребня, экспрессирующих tyrosine hydroxylase (Varley and Maxwell 1996, Dellovade et al., 1998, Smidt et al., 2000, Vitalis et al., 2000). Мутации этих генов м. влиять на поставку L-dopa к соотв. развивающимся глазным структурам. Кроме того, экспрессия tyrosine hydroxylase м. регулироваться с помощью PITX2, PITX3 и TCFAP2 (Cazorla et al., 2000, Kim et al., 2001, Lebel et al., 2001). Наконец, CYP1B1 м. катализировать скорость ограничивающую ступень в биосинтезе ретиноевой кислоты. Ретиноевая кислота индуцирует
Tcfap2a, который м. регулировать tyrosine hydroxylase и способствует также пролиферации субнабора клеток нервного гребня птиц, которые экспрессируют tyrosine hydroxylase (Rockwood and Maxwell 1996). Всё это открывает новые перспективы для изучения роли L-dopa в развитии переднего сегмента и глаукомы. вызываемых множественными генами. Т.к. L-dopa участвует в развитии угла и различные глазные гены потенциально влияют на L-dopa (посредством tyrosine hydroxylase), то вполне возможно, что метаболические дефекты, связанные с L-dopa, являются общей темой для ASD и глаукомы.
Common themes and developmental networks
Нормальное развитие нуждается в перекрестном общении между сетями из взаимодействующих путей, которые имеют синергичные или противоположные эффекты. Дозовая чувствительность развития переднего сегмента ко многим генам/путям, рассмотренная выше, указывает на то, что необходим деликатный баланс передач сигналов путем взаимодействующих путей для нормального развития. Др. эффект большинства из генов, рассмотренный выше это нарушения состава и количества ECM. Рассматривая онтогенетическое значение ECM и его существенную структурную и физиологическую роль в трабекулярной сети, становится очевидным, что неправильная регуляция ECM м.б. общим следствием мутаций многих генов, которые вызывают ASD и глаукому. Помимо измененной регуляции ECM мутации в самих ECM генах м. вносить вклад в ASD. Напр.,
Col18a1-/- мыши имеют аномалии радужки и цилиарного тела (Ylikarppa et al., 2003). Т.о., акпклача сигналов ECM является одним из важных компонентов онтогенетических сетей, которые регулируют формирование переднего сегмента.
Несмотря на гены и пути, рассмотренные выше, онтогенетические сети, которые регулируют формирование переднего сегмента, в основном не определены. Многие компоненты еще необходимо идентифицировать и пути, с помощью которых известные гены взаимодействуют, еще охарактеризованы недостаточно. Первой попыткой связать действие известных генов и путей с формированием переднего сегмента, д. явиться выяснение, как они м.б. связаны с передачей сигналов семейства TGFβ и регуляцией ECM (Рис. 5). Расширением этого является то, что передача сигналов членами семейства TGFβ взаимодействует с др. сигнальными путями, включая передачу сигналов fibroblast growth factor во время морфогенеза оптического пузырька (Ohkubo et al., 2002). Кроме того, передача сигналов Sonic hedgehog signaling м. индуцировать компетентность клеток отвечать на передачи сигналов BMP путем регуляции экспрессии SMAD (Dick et al., 1999, Murtaugh et al., 1999). Как пример того, как разные гены, участвующие в формировании переднего сегмента, м. конвергировать, влияя на передачу сигналов с помощью общих молекул и путей, мы показали известные онтогенетические гены, которые м. влиять на L-dopa или catecholamine обусловленные онтогенетические события (Рис. 6).
Как обсуждалось выше многие компоненты сложных регуляторных/сигнальных сетей, контролирующих развитие переднего сегмента, остаются неизвестными. Collection of extensive datasets
of pertinent biological information in a stage and tissue specific
fashion is needed (including mutant phenotypes, gene expression,
protein abundance and modification). The production of mouse
mutants by gene targeting and transgenic technologies, along
with the many new mutants provided by mutagenesis efforts, will
be a substantial help in defining network components. To reach
an in depth understanding of these networks and how independent
networks interact with each other, it will be essential to combine
the tools of genomics, molecular biology, developmental biology,
bioinformatics and computational biology. The availability of the
genome sequence from various species will allow candidate
identification of network members in silico and subsequent role
testing in vivo. Combining tissue specific gene expression studies
with computational methods can identify important configurations
of cis-regulatory elements for coordinately regulated genes, (as
recently reported for genes responding to similar thresholds of
developmental gradients (Stathopoulos et al., 2002). Knowledge
of these regulatory elements and genome sequence analysis can
then be used to predict roles of other genes for subsequent
testing. Continued investment in appropriate electronic and
biological resources will poise the field for an unprecedented
molecular understanding of anterior segment development.
Сайт создан в системе
uCoz