не экспрессируется в глазном диске, а экспрессируется в той части в головном мозге, которая наз. ellipsoid тела, и в clypeolabrum. У планарий ген
не обнаруживает экспрессии в глазах планарий (Salo et al., 2002). У полухордовых,
экспрессируется в передней части нейроэктодермы. Т.к. этот желудевый червь не имеет глаз, то экспрессия
у этого вида не м. б. ассоциирована с глазами.
A. Targeted elimination Rx in mice
Транскрипция
Mrx начинается около Е7.5 в передней части нервной пластинки. На Е10.5 экспрессия
Mrx ограничивается развивающейся сетчаткой и вентральной чатсью переденего мозга. Проверка эффектов удаления функции
Rx на морфологию мышиных
Mrx-/- эмбрионов показала отсутствие видимых глазных структур, хотя гетерозиготы выглядят нормальными (Рис. 2D). Аномальный фенотип таких эмбрионов обнаруживается самое раннее на Е8.5 по отсутствию образования оптических бороздок, дающих глазные бокалы. Это указывает на то. что
Rx важен для инициации развития глаз. На морфологическом уровне первичные проблемы возникают в вентральной части переднего мозга. Вентральная часть нейроэктодермы значительно тоньше у мутантов, тогда как дорсальные и латеральные структуры переднего мозга вы глядят нормальными. У эмбрионов дикого типа гены
Otx2, Six3, Pax6, Foxe3 экспрессируются на ранних стадиях развития глаз.
Otx2, Six3, Pax6 первоначально активны в передней части нервной пластинки, позднее их экспрессия наиболее выражена в клетках предшественниках сетчатки. Все три гена экспрессируются также в др. областях эмбриона. Ген
Foxe3 первоначально экспрессируется в хрусталиковой плакоде и позднее сохраняет активность в клетках переднего хрусталикового эпителия. Когда мы анализировали экспрессию
Otx2, Six3, Pax6 у
Rx-/- эмбрионов, то нашли, что инициальная активация этих генов в передней части нервной пластинки не зависит от
Rx. Возможны два объяснения. Во-первых, возможно, что клетки предшественники сетчатки не образуются у таких эмбрионов и поэтому отсутствует экспрессия генов, характерных для развивающейся сетчатки. Во-вторых, возможно, что некоторые клетки сетчатки специфицированы, но они неспособны пролиферировать из-за их малого количества их трудно выявить с помощью гибридизации
in situ/ особое внимание привлекает отсутствие экспрессии Рах6 в клетках предшественниках сетчатки, т.к. предполагается, что
Rx генетически стоит выше Рах6. Мы не обнаружили достоверных изменений в экспрессии
Rx на
Рах6-/- фоне. Экспрессия
Foxe3, раннего маркера развития хрусталика, не выявлялась у мутантов
Mrx-/-, т.е. образование хрусталиков у мышей зависит от формирования клетко предшественников сетчатки. Изучали экспрессию и некоторых др. маркеров развития глаз у этих мутантов и мы снова не обнаруживали экспрессии этих генов в боковых частях головного мозга, где д. эвагинировать сетчатка. Всё это указывает на то, что клетки сетчатки у
Rx-/- эмбрионов не специфицируются, или специфицируются, но не пролиферируют, что мало вероятно. Нулевые
Mrx эмбрионы уникальны в отношении их неспособности формировать оптический пузырек, т.к. даже у
Small eye мутантов обнаруживается образование оптических пузырьков, хотя и аномальных.
B. Analysis of eye development in embryos with mutated Rx gene
Мутация eyeless (ey1) мышей вызывает тяжелые аномалии глаз и гипоталямуса. Эти аномалии обусловлены мутациями в гене
Mrx? они затрагивают консервативный AUG кодон, который используется как сайт инициации альтернативной трансляции. В результате этих мутаций уровень белка Rx снижается (Tucker et al., 2001).
Чувствительная к температуре мутация eyeless у medaka обусловлена интронной инсерцией в гене
Rx3. Эта инсерция ведет к транскрипционной репрессии локуса, что в свою очередь ведет к отсутствию образования глаз.
Мутация
chokh у рыбок данио обусловлена нарушениями в гомеобоксной области гена
Rx3. Мутация вносит стоп-кодон в гомеодомен, давая сильно укороченный белок Rx. Мутантные рыбки не формируют глаз.
У
Xenopus функция
Rx элиминируется с использованием доминантно негативной конструкции и с помощью
Rx-специфических morpholinos. Это ведет к редукции или потере глаз и фенотип структуры передней части головы похож на фенотип мышей
Rx-/- (Рис. 2УбА) (Andreazzoli et al., 2003).
У кур предполагаемый доминантно-негативный аллель
RaxL вносился в глаза ранних цыплят, используя ретровирусный вектор. Эта конструкция вызывала достоверную редукцию экспрессии ранних маркеров фоторецепторных клеток. Уменьшение количества фоторецепторных клеток, по-видимому, обусловлено снижением жизнеспособности развивающихся фоторецепторных клеток, т.к. при данной конструкции наблюдается усиление апоптоза (Chen, Cepko, 2002). Напротив, использование доминантно-негативного
RaxL (Sakagami et al., 2003) привело к заключению, что
RaxL участвует в регуляции ганглиолярных клеток.
У людей
RX обнаруживает критическую роль в формировании глаз. Мутации в
RX человека вызывают анафталмию и sclerocornea (Рис. 2 G,H; Voronina et al., 2004). Были идентифицированы пациенты с двумя разными мутантными аллелями
RX , укороченный аллель, который предупреждает образование ДНК-связывающей спирали гомеодомена, и миссенс мутация внутри этой спирали, которая редуцирует способность белка Rx связывают ДНК-мишени.
C. Overexpression of Rx
Избыточная экспрессия
Xrx1 в дорсальных анимальных бластомерах
Xenopus обусловливает избыточную пролиферацию нейросетчатки и пигментного эпителия сетчатки (Рис. 2J). У некоторых эмбрионов наблюдается эктопическая ткань сетчатки и удвоения передней части нервной трубки. Сходные результаты получены у рыбок данио.
Regulation of Rx
На молекулярном уровне экспрессия
Rx м.б. активирована у эмбрионов
Xenopus с помощью
chordin, noggin, Hedgehog, wnt путей (Andreazzoli et al., 2003; Rasmussen et al.,. 2001; Zauber et al., 1999). Neurogenin и ретиноевая кислота репрессируют транскрипцию
Rx. Экспрессия
Rx в переденей части нервной пластинки ограничивается с помощью экспрессии
X-ngnr-1 и p27Xic1 X-ngnr-1 способствует нейрональной дифференцировке, а
p27Xic1 является ингибитором клеточного цикла. По-видимому,
Xrx1 ингибирует экспрессию
X-ngnr-1 и p27Xic1. Кроме того
Rx активирует транскрипцию
XBF-1. XBF-1 подобно
X-ngnr-1 ингибирует экспрессию
p27Xic1 и тем самым способствует клеточной пролиферации (Hardcastle et al., 2000). И как результат всех этих взаимодействий клетки, экспрессирующие
Rx, пролиферируют, но не дифференцируются. Др. мишенью для
Rx является Otx2, гомобокс-содержащий ген, который существенен для спецификации передней части нервной пластинки, но он д.б. супрессирован на территории сетчатки. Rx белок, по-видимому, обеспечивает эту репрессию транскрипции
Otx2.
Регуляторные элементы у
Xenopus гена
Rx расположены на 5' вышестоящей области гена (Hirsch et al., 2002; Zhang et al., 2003). Эти последовательности способны управлять экспрессией гена в развивающихся глазах и вентральной части гипоталямуса. Мы использовали эти последовательности для изучения роли передачи сигналов FGF, обеспечиваемой с помощью FGFR-4, в спецификации типов клеток сетчатки (Zhang et al., 2003).
Implication for eye development and evolution
Имеются указания на то, что
Rx в первую очередь участвует в пролиферации клеток сетчатки и вентральной части гипоталямуса. Эмбрионы
Xenopus, которые избыточно экспрессируют продукт гена
Xrx1 обнаруживают повышенные количества клеток в сетчатке. Это м.б. объяснено усилением пролиферации клеток или увеличением детерминации клеток в ретинальной судьбой. Casarosa et al., (2003) продемонстрировали, что избыточная экспрессия
Xrx у эмбрионов
Xenopus удлиняет экспрессию маркеров деления клеток, таких как циклин D1, это подтверждает, что пролиферация играет важную роль в этом процессе. Это подтверждается и тем, что у
Xenopus Rx контролирует пролиферацию клеток путем ингибирования
X-ngnr-1, фактора, способствующего дифференцировке нейронов, и
p27Xic1, ингибитора клеточного цикла (Andreazzoli et al., 2003). Отсутствие глаз у
Rx-/- мутантов сравнимо с функцией
Rx в детерминации и/или пролиферации клеток предшественников сетчатки, но Zhang et al., (2003) показали. что необsчно тонкая вентральная нейроэктодерма, которая присутствует у мышей
Rx-/-, способна индуцировать образование кармана Ратке. Это указывает на то, что эта вентральная нейроэктодерма у
Rx-/- мышей, по крайней мере, частично специфицирована и функциональна. Однако, нет доказательств, что специфицируется сетчатка и происходит индукция хрусталика (Brownwll et al., 2000; Zhang et al., 2000).
Напротив, у medaka мутантов
eyeless обнаруживаются некоторые признаки спецификации сетчатки в отсутствие белка
Rx3. Т.к. глазной бокал у этих мутантов не эвагинирует, то наблюдается экспрессия генов, характерная для поздних стадий развития сетчатки. Происходит у них и индукция хрусталиков. Сходная ситуация наблюдается и у мутантов
chokh рыбок данио. Это позволяет предположить, что функция
Rx3 заключается в эвагинации оптического пузырька.
Расхождение в фенотипах у мышей и рыб не полностью ясно, но важно подчеркнуть, что medaka и рыбки данио имеют по три
Rx гена, а у мышей он только один. Затем только у мышей мутация действительно нулевая.
Итак, растут доказательства, в основном на
Xenopus, что
Rx действует как фактор пролиферации специфических клеточных типов, который участвует в пролиферации клеток, из которых происходят сетчатка и вентральная часть гипоталямуса. Данные по medaka и рыбкам данио указывают на то, что
Rx м. участвовать в морфогенезе оптического пузырька. Наконец,
Rx м. играть роль в спецификации предшественников сетчатки. Это подтверждается тем. что эмбриональные стволовые клетки м.б. специфицированы к формированию ретинальных клеток с помощью эктопической экспрессии
Rx (Tabata et al., 2004).
Потребность в функции
Rx не универсальна для всех видов. Так развитие глаз позвоночных зависит от функции
Rx, а развитие глац у низших животных, включая насекомых, нет. Возможно глаза позвоночных и насекомых имеют разное эволюционное происхождение. Считается в ходе эволюции глаза возникали независимо несколько раз (Salvini-Plawen, Mayr, 1977), тогда как др. предполагают, что все глаза произошли из одного общего прототипа (Gehring, Ikeo, 1999). Сегодня предпочтительна последняя точка зрения. Тем не менее камера глаз позвоночных и компаундные глаза насекомых выглядят очень по-разному и генерируются посредством двух совершенно отличных онтогенетических процессов. Сетчатка позвоночных возникает из нейроэктодермы, тогда как глаза
Drosophila возникают из поверхностной эктодермы
(Wolff and Ready, 1991).
What supports the hypothesis that all all eyes developed from common prototype?
The initial support for this hypothesis came from the observation that orthologues of many genes involved in vertebrate eye development are involved in DrosophHa eye development. The realization ftat flies lacking the function of eyeless, or mice lacking the function of the murine eyeless homologue Pax6 do not develop visible eyes (Hill etal., 1991; Quiring etal.; 1994), strengthens this argument. Finally, the finding that eyeless and Pax6 can induce ectopic eye formation in DrosophHa (Haider etait 1995), led to the suggestions that Pax6 is a master control gene of eye development (Gehring, 1996) and that all eyes evolved from a common prototype (Gehring and Ikeo, 1999). Further support for these two proposals came from the observation that the overexpression of
Pax6 in
Xenopus embryos can lead to the formation of ectopic eyes (Chow et aL, 1999). However, while the experiments leading to these proposals are convincing, there might be alternative explanations tor these observations.
While in insects, eyeless truly might be the master gene of eye development, the role of its vertebrate homologue, PaxB, is less clear. First of all, the function of PaxB is not as essential for vertebrate eye development as originally believed. While it is true that embryos lacking Pax6 function do not develop eyes, the eyes begin to form in
Pax6-/- embryos, but they arrest at the optic vesicle stage (Grindley et al., 1995; Zhang et ai, 2000). Therefore initiation of vertebrate eye development does not require PaxB function, arguing against
Pax6 being a master gene of vertebrate eye development.
Second, while it is true that the overexpression of
Pax6 can lead to the formation of ectopic eyes in
Xenopus, this experiment does not necessarily show that Pax6 is the gene initiating eye formation during normal Xenopus development. The interpretation of this experiment is complicated by the fact that genes involved in the regulation of eye development are involved in a complicated regulatory framework in which a feedback mechanism is frequently used (Chen etal., 1997). For this reason, a dramatic overexpression of a certain gene product might activate upstream genes through a feedback loop that during normal development does not play a significant role. Indeed, it was observed that during overexpression of
Pax6, Rx is activated ectopically (Chew et al., 1999). This is somewhat troubling in the light of the fact that genetic evidence in mice shows that during normal development activation of f?xis not PaxB dependent (Zhang et at., 2000). Therefore, it is hard to exclude in this experiment that the formation of ectopic eyes is due to an artificial activation of Rxor some other gene that is normally upstream of Pax6. ft is therefore entirely possible that in some cases overexpression experiments show what can be done by a dramatic overproduction of a regulatory molecule, rather than demonstrating what is taking place during normal embryonic development.
Finally, while it is true mat the overexpression of the vertebrate
Pax6, like the overexpression of eyeless, leads to ectopic eye formation in DrosophHa, this experiment only shows that thet>asic function of Pax6 as a transcriptional activator/repressor is conserved to the degree that it can activate the insect eye-forming network. This is not surprising given the extremely high sequence conservation seen in the
Pax6 gene family.
Nevertheless, it is clearthat many factors that are involved in the invertebrate eye formation have homologues in vertebrates and are expressed during vertebrate eye formation. Does this mean that all eyes developed from a common prototype? While many components of eye development are conserved in very distant species, recently several examples have been brought to light demonstrating that certain components that were believed to be critical for the eye-forming cascade are missing in a certain type of eyes. For example, the planarian eyes require neither
Pax6 activity nor
Six3 (Pineda et aL, 2002; Pineda and Saio, 2002). While
dachshund is critical for invertebrate eye formation (Mardon et aL, 1994), it does not seem to have an important role in vertebrate eye formation (Davis ef al.,2001). And last, but not least, vertebrate eye formation is
Rx dependent while invertebrate eye development is Rx independent (Davis etal., 2003). We believe that the differential dependence of eye formation on
Rx in insects and vertebrates reflects different evolutionary origin of these two types of eyes.
We believe that the precursors of the vertebrate eye emerged in a region of the embryo where
Rx was essential for the specification, survival or proliferation of ceils. When considering this concept, it is important to realize that
Rx is not only expressed in retinal progenitor cells. Rather, it is expressed in a field of cells from which the retinal progenitor cells, but also the ceJis of the ventral hypo-thalamus, will form. Therefore the expression of
Rx, or for that matter
Pax6, in the anterior neural plate Is not sufficient for the formation of retinal progenitor cells. Indeed, there is no gene that is specifically expressed only in the presumptive retinal progenitor cells. For that reason, we do not believe that
Rx, or any other gene can be called the "master gene" of eye development. In addition, the concept of a "master gene" of eye development is not supported by the finding that essentially all the genes involved in eye formation are dispensable in one or the another species. Therefore, we consider it far more likely that specific regulatory interactions between several genes are necessary to assure that the retinal ceils are formed.
In the ancestral eye, which eventually gave rise to the distinctive eye of
Drosophila, Pax6 might have played a critical role, but there is increasing evidence that the precursor of vertebrate eyes developed by the formation of a new regulatory network in
Rx dependent cells.
Naturally, it is expected that the two regulatory networks involved in the formation of these two different types of eyes will show some similarities, since they were generated from a similar repertoires of active genes in the similar area of the embryo. However, the presence of superficially related regulatory networks cannot be easily used as a proof of a common evolutionary origin, as regulatory circuits are frequently reusedduring development and differentiation (Pichaud etal., 2001). Some interactions among these genes result in eye formations, others do not. It is possible, indeed likely, that more than one combination of these transcription factors can tead to eye formation. As a consequence af a different use of these factors, the development and the appearance of eyes vary drastically between species that developed independently. We believe that the different regulatory networks that are present in Drosophila and vertebrate eye formation reflect this fact It is possible that the initial successful interactions that led to the insect eye formation were triggered by
Pax6, while flxtriggered the successful interactions that led to the vertebrate eye formation.
One piece of evidence which directs us towards this alternative explanation of Pax6- and Rx~ dependent eye evolution is the presence of two different types of photoreceptor cells which are present in many bilaterian groups (Arendt and Wittbrodt, 2001). It has been suggested that the rhabdomeric photoreceptors might be the manifestation of Pax6 dependent eye evolution, while the ciliary photoreceptors are the result of Rx dependent eye evolution (Arendt, 2003). The hypothesis that Rx has an important function in the photoreceptor formation cannot be excluded. While the knockout of Rx in mouse shows only the dependence of formation of retinal progenitor cells on this gene, expression of Rx was observed in photoreceptor cells of several species (Perron et al., 1998; Chuang etal., 1999; Deschet etal., 1999; Zhang et ai, 2003). Furthermore, it was shown that Rx binds to the photoreceptor conserved etemenM (PCE-1/Ret 1) in the photo-receptor cell-specific arrestin and IRBP promoter (Kimura et ah, 2006). Finally, the bovine gene related to Rx, QRX, was recently described as being capable of modulating photoreceptor gene expression (Wang et al., 2004). Findings that show sequence changes in the human QRX gene of individuals with retinal degeneration (Wang etal, 2004) indicate that Rx genes might be also involved in later steps of vertebrate eye formation.
Сайт создан в системе
uCoz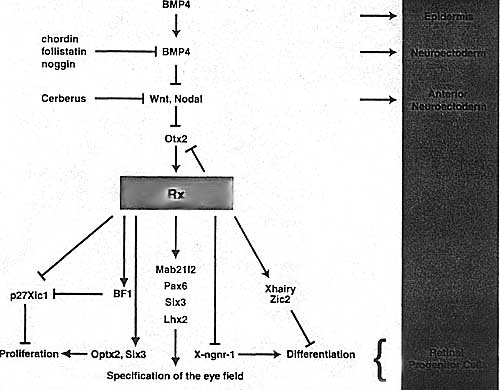 Fig. i. A schematic diagram of the regulatory interactions taking place during the specification of the retinal field. This simplified view shows that in the presence of BMP4 expression, the uncommitted ectoderm will form epidermis. As BMP4 is antagonized by chordin, follistatin or noggin, neural tissue will form. Additional inhibition of Wnt and/or nodal pathway is necessary to form anterior neuroec-toderm. Anterior neuroectoderm expresses Otx2 that in turn, activates transcription of Rx. Rx performs several functions that are required for the formation of retinal progenitor cells. Rx promotes proliferation and inhibits differentiation of Rx expressing cells. At the same time, it increases transcription of several eye-specific genes likePax6, Six3 and Lhx2. It also downregulates the transcription of Otx2 in the cells of the presumptive neuroretina. Since many of these regulatory interactions were not yet investigated in detail, it is important to emphasize that arrows between genes do not always imply direct regulatory interactions.
Fig. i. A schematic diagram of the regulatory interactions taking place during the specification of the retinal field. This simplified view shows that in the presence of BMP4 expression, the uncommitted ectoderm will form epidermis. As BMP4 is antagonized by chordin, follistatin or noggin, neural tissue will form. Additional inhibition of Wnt and/or nodal pathway is necessary to form anterior neuroec-toderm. Anterior neuroectoderm expresses Otx2 that in turn, activates transcription of Rx. Rx performs several functions that are required for the formation of retinal progenitor cells. Rx promotes proliferation and inhibits differentiation of Rx expressing cells. At the same time, it increases transcription of several eye-specific genes likePax6, Six3 and Lhx2. It also downregulates the transcription of Otx2 in the cells of the presumptive neuroretina. Since many of these regulatory interactions were not yet investigated in detail, it is important to emphasize that arrows between genes do not always imply direct regulatory interactions.