Ocular surface epithelial and stem cell development | |
|
Phenotypic features and developmental events involved in the genesis of the limbocorneal and conjunctival epithelia are described. Together, these two epithelia define the ocular surface. They derive from a small cohort of optic vesicle-induced PAX6 + head ectodermal cells that
remain on the surface following lens vesicle formation by the main PAX6 + cell cohort. Both epithelia are stratified, and display wet, non-keratinizing phenotypes. The most significant spatial feature of
the limbo-corneal epithelium is the segregation of its supporting stem and early precursor cells to the limbus, the outer vascularized rim separating the cornea from the conjunctiva. These stem cells express ABCG2, a xenobiotic transporter present in stem cells from other organs. ABCG2
transport activity excludes the DNA dye Hoechst 33342, allowing the isolation of the ocular stem cells by flow cytometry, as a unique cohort known as a side ‘side population’. Limbal stem cells do not form gap junctions and exist as metabolically isolated entities. Tracking of expression changes in Cx43, the main gap junction protein expressed in both the pre-epithelial ectoderm and in the mature central corneal epithelium, indicates that a limbal stem cell phenotype starts
developing very soon after lens vesicle invagination, in advance of the appearance of any recognizable anatomical sub-epithelial limbal feature. Differences in Cx43 expression also reveal the very early nature of the divergence in limbo-corneal and conjunctival lineages. The putative
involvement of several early genes, including gradients of PAX6 and differences in expression patterns for members of the Id or msh gene expression regulators are reviewed.
| |
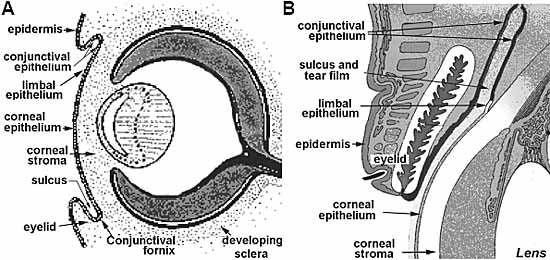
 Fig. 2. Connexin43 expression in the human limbocorneal
epithelium. Micrographs are negative images
of immunofluorescent stainings. (A) Differential interference
light micrograph of a frozen section depicting
the area of study. In this micrograph the corneal periphery
(Co) is located on the left side and the limbus is
located to the right. The prominent incursions of the
stroma into the plane of the epithelium are the Palisades
of Vogt (PV). To include several Palisades in each single
section, the frozen tissue was sectioned at an angle
oblique to the main limbo-corneal axis. This is indicated
by the black line (cutting plane) placed over in an en face
light micrograph of the intact limbo-corneal tissue (insert).
(B) Immunofluorescence micrograph of Cx43 distribution
in the right framed zone of A. The basement
membrane (BM) separating epithelial and subepithelial
zones is easily identifiable. Connexin staining in the
epithelium is extremely sparse and limited to some
suprabasal cells. Sub-epithelial endothelial vessels (End.),
including those within the Palisades are strongly Cx43-
positive. (C) Immunofluorescence micrograph of Cx43
distribution in the left framed (i.e., peripheral corneal)
zone of A. Basal and the proximal suprabasal cells are
intensively stained. The strong subepithelial stain seen
in the limbal zone is absent.
Fig. 2. Connexin43 expression in the human limbocorneal
epithelium. Micrographs are negative images
of immunofluorescent stainings. (A) Differential interference
light micrograph of a frozen section depicting
the area of study. In this micrograph the corneal periphery
(Co) is located on the left side and the limbus is
located to the right. The prominent incursions of the
stroma into the plane of the epithelium are the Palisades
of Vogt (PV). To include several Palisades in each single
section, the frozen tissue was sectioned at an angle
oblique to the main limbo-corneal axis. This is indicated
by the black line (cutting plane) placed over in an en face
light micrograph of the intact limbo-corneal tissue (insert).
(B) Immunofluorescence micrograph of Cx43 distribution
in the right framed zone of A. The basement
membrane (BM) separating epithelial and subepithelial
zones is easily identifiable. Connexin staining in the
epithelium is extremely sparse and limited to some
suprabasal cells. Sub-epithelial endothelial vessels (End.),
including those within the Palisades are strongly Cx43-
positive. (C) Immunofluorescence micrograph of Cx43
distribution in the left framed (i.e., peripheral corneal)
zone of A. Basal and the proximal suprabasal cells are
intensively stained. The strong subepithelial stain seen
in the limbal zone is absent. 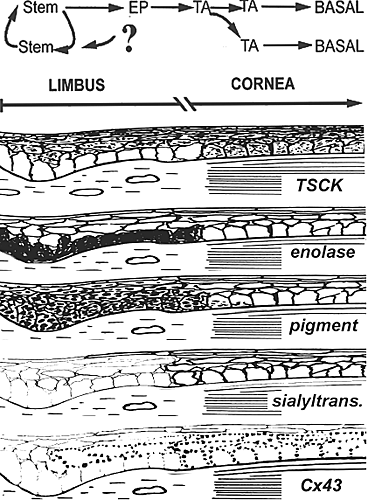 Fig. 3. Summary of some of the functional and expression features of the limbo-corneal epithelium. The upper frame describes the growth and differentiation plan. The basal cell layer of the limbal zone contains the stem cells and their early progenitors (EP). The return arrow and question mark have been introduced to indicate the possibility that some of these precursors could, given the proper environment, revert to a full stem cell phenotype. At he limbo-corneal demarcation, in unison with the transition to a distinct avascular environment there is a sharp differentiation change into the more differentiated but rapidly proliferating transient amplifying (TA) cells. The lower frames describe some known phenotypic transitions taking place at the limbo-corneal demarcation. (TSCK) The basal layer of the limbal epithelium does not express TSCKs, as indicated by the stain-free cytosol. TSCK expression begins at the limbo-corneal demarcation within the basal cell layer or, within the limbus, upon stratification. (Enolase) Under stationary conditions б-enolase is preferentially expressed in the cytosol of the limbal basal cells. (Pigment) In many pigmented species, the limbal basal cells acquire heavy pigmentation, most likely due to pigment granule transfer from melanocytes. (Glycosylation) In rabbit, cell membrane O-glycan linked б-2, 3 sialylation (indicated by the darkness of the membrane traces), is limited to the cornea. This change is due to the de novo expression of a б-2,3 sialylyltransferase within the basal cell compartment at the limbo-corneal demarcation. It coincides with the de novo expression of TSCKs. Unlike the case for the TSCK's this sialylation does not occur during intralimbal stratification. (Cx43) The limbal zone shows very little Cx43. In some cases the expression is present in the first layer of supra-basal cells. The density of Cx43 gap junctions and the size of individual plaques sharply increase at the limbo-corneal demarcation.
Fig. 3. Summary of some of the functional and expression features of the limbo-corneal epithelium. The upper frame describes the growth and differentiation plan. The basal cell layer of the limbal zone contains the stem cells and their early progenitors (EP). The return arrow and question mark have been introduced to indicate the possibility that some of these precursors could, given the proper environment, revert to a full stem cell phenotype. At he limbo-corneal demarcation, in unison with the transition to a distinct avascular environment there is a sharp differentiation change into the more differentiated but rapidly proliferating transient amplifying (TA) cells. The lower frames describe some known phenotypic transitions taking place at the limbo-corneal demarcation. (TSCK) The basal layer of the limbal epithelium does not express TSCKs, as indicated by the stain-free cytosol. TSCK expression begins at the limbo-corneal demarcation within the basal cell layer or, within the limbus, upon stratification. (Enolase) Under stationary conditions б-enolase is preferentially expressed in the cytosol of the limbal basal cells. (Pigment) In many pigmented species, the limbal basal cells acquire heavy pigmentation, most likely due to pigment granule transfer from melanocytes. (Glycosylation) In rabbit, cell membrane O-glycan linked б-2, 3 sialylation (indicated by the darkness of the membrane traces), is limited to the cornea. This change is due to the de novo expression of a б-2,3 sialylyltransferase within the basal cell compartment at the limbo-corneal demarcation. It coincides with the de novo expression of TSCKs. Unlike the case for the TSCK's this sialylation does not occur during intralimbal stratification. (Cx43) The limbal zone shows very little Cx43. In some cases the expression is present in the first layer of supra-basal cells. The density of Cx43 gap junctions and the size of individual plaques sharply increase at the limbo-corneal demarcation. 
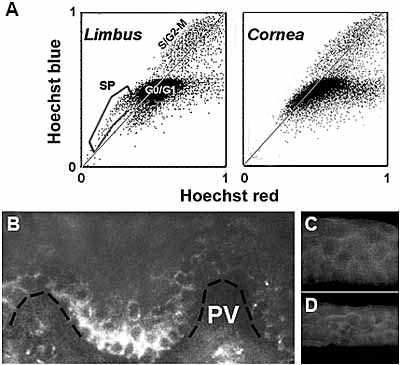 Fig. 4. SP cells and ABCG2 expression in the human limbo-corneal epithelium. Human corneas unsuitable for human transplant were obtained from the National Disease Research Interchange. (A) Flow cytometry blue/red emission dot plots of Hoechst 33342-loaded limbal and corneal human epithelial cells. Single cell suspensions were prepared by sequential digestion with Dispase and trypsin. Cells were incubated in culture medium containing 1.5 .g/ ml Hoechst for 90 min at 37.C, spun down and resuspended in ice-cold HBSS containing 2 % fetal calf serum and 2 .g/ml propidium iodide. The Hoechst-loaded cells were analyzed in a MoFlo flow cytometer equipped with UV and Argon lasers. Blue and red emissions
from the UV excitation are used to generate fluorescent emission dot plots.
Dead cells, labeled by propidium iodide, have been electronically excluded
("gated out") from these plots. Each dot in a plot represents the relationship between the Hoechst blue and Hoechst red emissions for each live cell. For most cells the blue/red ratio approaches or exceeds the normal ratio (represented by the light gray line). The main spot (G0/G1) gathers most cells containing one copy of DNA. The higher intensity zone (S/G2-M)along the gray line contains all cells with higher DNA content. This includes cells that are actively engaged in DNA synthesis (S) or cells that have completed the DNA duplication process but have not yet undergone or completed the cell division cycle (G2-M). In addition, the limbal population contains a cohort of cells, which both, displays lower blue and red emission intensities, and blue to red ratios that place them to the blue side of the gray line. These cells are known as side population (SP) cells. Note that such cells are not present in the corneal population. (B-D) Indirect immunofluorescence staining of cryosections of limbo corneal tissue for ABCG2. (B) Limbal Palisades of Vogt (PV). A broken black line has been added to indicate the location of the basement membrane. (C) Peripheral corneal zone. (D) Central cornea
Fig. 4. SP cells and ABCG2 expression in the human limbo-corneal epithelium. Human corneas unsuitable for human transplant were obtained from the National Disease Research Interchange. (A) Flow cytometry blue/red emission dot plots of Hoechst 33342-loaded limbal and corneal human epithelial cells. Single cell suspensions were prepared by sequential digestion with Dispase and trypsin. Cells were incubated in culture medium containing 1.5 .g/ ml Hoechst for 90 min at 37.C, spun down and resuspended in ice-cold HBSS containing 2 % fetal calf serum and 2 .g/ml propidium iodide. The Hoechst-loaded cells were analyzed in a MoFlo flow cytometer equipped with UV and Argon lasers. Blue and red emissions
from the UV excitation are used to generate fluorescent emission dot plots.
Dead cells, labeled by propidium iodide, have been electronically excluded
("gated out") from these plots. Each dot in a plot represents the relationship between the Hoechst blue and Hoechst red emissions for each live cell. For most cells the blue/red ratio approaches or exceeds the normal ratio (represented by the light gray line). The main spot (G0/G1) gathers most cells containing one copy of DNA. The higher intensity zone (S/G2-M)along the gray line contains all cells with higher DNA content. This includes cells that are actively engaged in DNA synthesis (S) or cells that have completed the DNA duplication process but have not yet undergone or completed the cell division cycle (G2-M). In addition, the limbal population contains a cohort of cells, which both, displays lower blue and red emission intensities, and blue to red ratios that place them to the blue side of the gray line. These cells are known as side population (SP) cells. Note that such cells are not present in the corneal population. (B-D) Indirect immunofluorescence staining of cryosections of limbo corneal tissue for ABCG2. (B) Limbal Palisades of Vogt (PV). A broken black line has been added to indicate the location of the basement membrane. (C) Peripheral corneal zone. (D) Central cornea 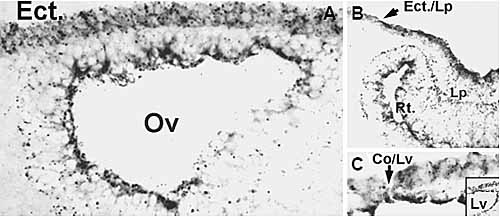 Fig. 5. Cx43 immunostaining in the head ectoderm
during early stage of oculogenesis. Micrographs
are negative images of immunofluorescent
stainings. (A) Section of the E9.5 rat head. The optic
vesicle (Ov) has approached the head ectoderm
(Ect.) and has flattened against it. Note that the
ectoderm is composed of two layers of uniformly
Cx43-positive round cells. (B) An E10.5 sample
showing the changes in Cx43 expression during
formation of the lens placode. Cx43 increases dramatically
in the elongating lens placode cells and
concentrates in the apical surface The distribution
of Cx43 seems to define the demarcation between
ectodermal and induced placodal cell (Ect. /Lp). The
developing retina (Rt.) is indicated. (C) The distribution of Cx43 during lens vesicle (Lv) excision from the surface ectoderm. Note the difference in Cx43 expression between the outer most cell of the excising lens vesicle, and the adjacent cell, that will not undergo excision, i.e, the future corneal epithelial cell. The insert shows a larger zone of the same micrograph.
Fig. 5. Cx43 immunostaining in the head ectoderm
during early stage of oculogenesis. Micrographs
are negative images of immunofluorescent
stainings. (A) Section of the E9.5 rat head. The optic
vesicle (Ov) has approached the head ectoderm
(Ect.) and has flattened against it. Note that the
ectoderm is composed of two layers of uniformly
Cx43-positive round cells. (B) An E10.5 sample
showing the changes in Cx43 expression during
formation of the lens placode. Cx43 increases dramatically
in the elongating lens placode cells and
concentrates in the apical surface The distribution
of Cx43 seems to define the demarcation between
ectodermal and induced placodal cell (Ect. /Lp). The
developing retina (Rt.) is indicated. (C) The distribution of Cx43 during lens vesicle (Lv) excision from the surface ectoderm. Note the difference in Cx43 expression between the outer most cell of the excising lens vesicle, and the adjacent cell, that will not undergo excision, i.e, the future corneal epithelial cell. The insert shows a larger zone of the same micrograph.
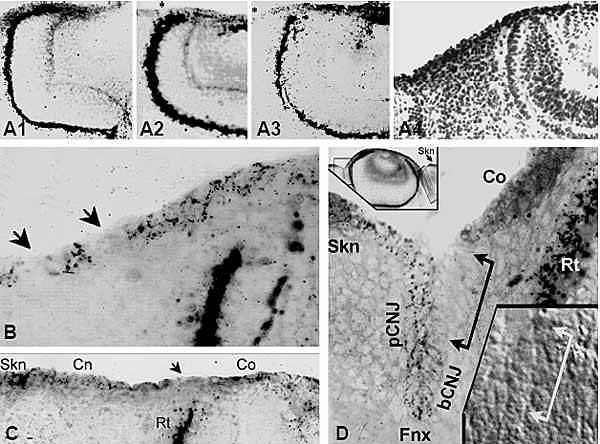
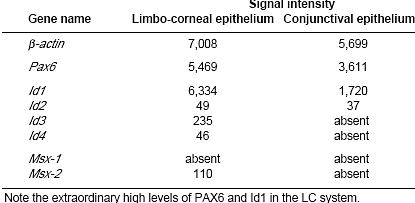 и важны для регуляции клеточных фенотипов у взрослых. Kee and Bronner-Fraser (2001) идентифицировали заплатку из Id type 4 (Id4)-позитивных эктодермальных клеток на головной эктодерме E2 кур (ст. развития 14). У целых эмбрионов заплатка проявляется в виде обода. окружающего развивающуюся ectoderm/neural зону аппозиции, т.е. до развития плакоды. На ст. E3, сопровождающейся инвагинацией плакодных клеток, Id4
экспрессия обнаруживается на презумптивной эпителиальной поверхности глаз, лежащей поверх Id4-негативного хрусталикового пузырька и эмбриональной сетчатки. Микрофотографии, представляющие msh и Id экспрессию подтверждают , что генный уровень для Msx-2 и Id4 изоформ наивысший в зоне, лежащей поверх верхушек развивающейся сетчатки, т.е. в области, которая станет или лимбом или конъюнктивой или обеими.
и важны для регуляции клеточных фенотипов у взрослых. Kee and Bronner-Fraser (2001) идентифицировали заплатку из Id type 4 (Id4)-позитивных эктодермальных клеток на головной эктодерме E2 кур (ст. развития 14). У целых эмбрионов заплатка проявляется в виде обода. окружающего развивающуюся ectoderm/neural зону аппозиции, т.е. до развития плакоды. На ст. E3, сопровождающейся инвагинацией плакодных клеток, Id4
экспрессия обнаруживается на презумптивной эпителиальной поверхности глаз, лежащей поверх Id4-негативного хрусталикового пузырька и эмбриональной сетчатки. Микрофотографии, представляющие msh и Id экспрессию подтверждают , что генный уровень для Msx-2 и Id4 изоформ наивысший в зоне, лежащей поверх верхушек развивающейся сетчатки, т.е. в области, которая станет или лимбом или конъюнктивой или обеими.
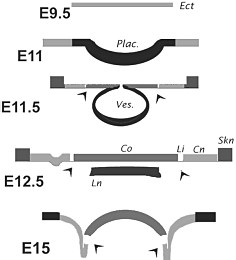 Fig. 7. Schematic representation of the fate of cells derived from the ectoderm between E9 and E15 in terms of Cx43 expression levels. Levels are represented by degrees of darkness. The ectodermal (Ect), corneal (Co), limbal (Li) and conjunctival (Cn) domains of the ocular surface,in addition to the skin (Skn) and lens (Ln) are indicated. Arrowheads point to a (putative) fixed location throughout development.
Fig. 7. Schematic representation of the fate of cells derived from the ectoderm between E9 and E15 in terms of Cx43 expression levels. Levels are represented by degrees of darkness. The ectodermal (Ect), corneal (Co), limbal (Li) and conjunctival (Cn) domains of the ocular surface,in addition to the skin (Skn) and lens (Ln) are indicated. Arrowheads point to a (putative) fixed location throughout development.