Аппарат Golgi представлен штабелем отдельных компартментов или цистерн, аранжированных от cis к trans. Cis сторона получает транспортные пузырьки от endoplasmic reticulum (ER), несущих вновь созданные мембраны и секретируемые белки. Этот груз затем перемещается через весь штабель на транс-сторону или trans-Golgi network (TGN), где он сортируется в носители, перемещающиеся к различным местам предназначения в клетке, включая плазматическую мембрану, лизосомы и в некоторых типах клеток компартменты хранения для регулируемой секреции. Транспорт от cis к trans стороне, как было предположено, осуществляется или за счёт целенаправленного перемещения пузырьков или за счёт образования целой цистерны на цис-стороне и затем прогресса до TGN, чтобы быть замещенной вслед за ней сформированной цистерной [1,2]. В обоих случаях пузырьки будут перемещаться ретроградным способом, чтобы осуществить рециклинг мембран или поддержать расположение резидентных мембранных белков внутри штабеля (stack)[3]. Активности мембранного трафика разных цистерн очень отличны. Т.о., цистерны в разных местах штабеля рекрутируют разные наборы покровных белков, чтобы сформировать разные типы пузырьков, которые возвращаются в ER, перемещаются внутри штабеля или обеспечивают транспорт к др. частям клетки. Кроме того, Golgi действует как акцепторный компартмент для пузырьков из ER, пузырьков, перемещающихся между цистернами, и для носителей, возвращающихся из эндосомной системы, чтобы обеспечить рециклинг рецепторов и компонентов trafficking machinery (кухни), которые покидают TGN. Эти носители сливаются только с субнабором цистерн, и очевидно, что растворимые белковые комплексы и суперскрученные белки рекрутируются, чтобы привязать пузырьки до их слияния и , следовательно, обеспечивают некоторые, если не все, специфичности мембранного трафика [4].
Т.о., Golgi представляет собой значительную организационную проблему для клетки, т.к. разные цистерны рекрутируют разные наборы факторов, привязывающих цитозольные оболочки т пузырьки. Более того, если цистерны созревают, то тогда паттерн рекрутирования д. быстро меняться в ~10-20 мин. в течение которых цистерны д. пройти путь от цис до транс (время, в течение которого груз пересекает штабель у млекопитающих). В таком случае рекрутирование этих периферических мембранных белков отражает распознавание активированных GTPases из семейств Rab и Arf или из специфических видов липидов. Это вызвало интерес, как генерируется корректный паттерн пространственных детерминант, так что предопределяется 'identity' разных цистерн. Этот вопрос важен не только для мембранного трафика, но и для др. процессов. Напр., некоторые белки периферических мембран специфически направляются в Golgi, чтобы поставить предшественники для биосинтеза липидов [5]. Кроме того, растут доказательства, что некоторые события передачи сигналов происходят на мембранах Golgi и обеспечиваются киназами и GTPases, специфически рекрутируемыми из цитоплазмы.
Activation of Rab family GTPases on the Golgi
GTPases семейства Rab играют ключевую роль во многих, но не во всех степенях мембранного трафика. Как и в случае с др. компартментами имеются определенные Rabs, которые обнаруживаются исключительно на специфических частях Golgi, где они рекрутируют суперскрученные белки, которые могут привязывать пузырьки или организовывать структуру Golgi, а также рекрутируют моторные белки, это позволяют мембранам Golgi перемещаться по цитоскелету. Вопрос о том, как Rabs направляются на специфические органеллы остаётся загадкой [6,7]. Эти GTPases прикрепляются к мембранам с помощью C-терминального хвоста, представленного гибкой 'hypervariable' областью вместе с двумя geranylgeranyl липидными группами. Инициальные исследования эндосомных Rabs указывают на то, что этот hypervariable регион действует как специфичный для органелл направляющий на цель сигнал [8]. Однако, недавние исследования широкого круга Rabs, включая две из Golgi, показали, что этот регион не необходим и недостаточен для органелл-специфичной локализации [9]. Вместо этого, по-видимому, множественные участки остальной части белка вносят вклад в специфичность к органеллам. Это может отражать распознавание Rab с помощью соответ. GTP exchange factor (GEF), т.к. эти Rab GEFs как только были идентифицированы обнаруживали специфичное для органелл распределение. Однако, ситуация, по-видимому, ещё сложнее, чем для Rabs из Golgi и в др. местах соединяются также с членами двух семейств хорошо законсервированных малых мембранных белков, YIP1 и PRA1/YIP3 семейств [6,7,10]. Такое суязывание может облегчать инициальную доставку Rab в соотв. органеллы с помощью GDP displacement inhibitor (GDI), белкового фактора, который переносит GDP-связанный (т.e. неактивный) Rab через цитозоль. GEF д. затем активировать Rab, предупреждая тем самым от удаления её с помощью GDI и следовательно, стабилизируя её ассоциацию с правильными мембранами. Интересно, что Yip1 взаимодействует с Golgi Rabs и как теперь установлено способствует рециклингу между ER и Golgi и в отличие от Golgi Rabs необходим для эффективного образования COPII пузырьков [11,12]. Это ведет к предположению, что Yip1 м. играть роль в координации образования производных ER пузырьков с последующим рекрутированием Rabs в cis-Golgi компартмент, который и получает эти пузырьки [11,12].
Activation of Arf family GTPases on the Golgi
Семейство Arf GTPases является центральным для организации и функции Golgi, как это чётко иллюстрируется тем фактом, что ингибирование Golgi Arf GEFs с помощью Brefeldin A (BFA) вызывает быстрый коллапс Golgi в ER.
Arf1 рекрутирует несколько везикулярных покровных белков, включая COPI, GGAs и AP1/clathrin [13]. Недавно было показано, что др. эффекторы также рекрутируются с помощью непосредственного связывания с Arf1, включая Rud3p (суперскрученный белок из дрожжевого cis-Golgi) и ARHGAP10 (GAP для Rho1) [14,15]. Эти находки показывают, что специфическая активация Arf1 на Golgi мембранах является критической, учитывая что эти мембраны обладают уникальными качественными особенностями. Это ставит вопрос о том, как Arf GEFs локализуются на Golgi мембранах, вопрос усложняется ещё присутствием. по крайней мере, двух классов Arf GEF на Golgi [16]. Два класса представлены родственными ~ в 200kD белками периферических мембран с центральным Sec7 доменом. который обладает GEF активностью у изученных белков. Так, один класс GBF1 (Gea1/2 у дрожжей), обнаруживается в cis-Golgi а второй класс, BIG1/BIG2 (Sec7 у дрожжей), в последних компартментах. GBF1, или его дрожжевые гомологи, соединяется с несколькими белками, включая p115 (Golgi coiled-coil белок), Gmh1 (мембранный белок с неизвестной функцией) и Drs2 (P-тип ATPase) [17-19]. Однако, ни одно из этих взаимодействий, по-видимому, не существенно для поставки в Golgi и поэтому механизм рекрутирования остаётся неизвестным. Интересно, что photobleaching GFP-GBF1 слитого белка указывает на его быструю замену в цитоплазме (t1/2=15-30s), a мембранная ассоциация стабилизируется соотв. мутациями или с помощью BFA, оба они способствуют взаимодействию с GDP-связанной формой Arf1 [20,21]. Когда ранние цистерны созревают и хотя они лишь кратко характеризуются качественными особенностями 'cis', то они затем быстро меняясь могут гарантировать, что рекрутирование GBF1 будет ограничено цистернами ранних частей штабеля. Более того, взаимодействие с Arf1-GDP открывает интересную возможность, что до активации Arf1-GDP рекрутируется в мембраны Golgi с помощью некоего фактора, отличного от GEF. Если это так, то локализация Arf1-GTP д. предопределяться с помощью др. факторов помимо распределения Arf GEFs.
Доказательства. что множественные белки могут контролировать локализацию Arf семейства GTPase также получены в исследованиях 'Arf-like' GTPase Arl1. Этот белок найден в trans-Golgi у широкого круга эукариот и необходим для ретроградного трафика в Golgi из частей эндосомной системы [22]. Arl1-GTP взаимодействует с несколькими эффекторами, лучше всего охарактеризованы длинные суперскрученные белки с C-терминальным GRIP доменом, мотив в 45-55 остатков, с которым непосредственно соединяется Arl1-GTP [23]. Исследования на дрожжах показали, что поставки в Golgi Arl1 зависят от второй Arf-like GTPase, Arl3 (ARFRP1 у людей), а небольшого 4 раза пронизывающего трансмембранного белка, Sys1 [24,25].
В отличие от белков Arf семейства, Arl3 не myristoylated
на N конце, но вместо этого ацетилируется и эта модификация необходима для Arl3, чтобы попасть в Golgi с помощью Sys1 (Figure 1). Предполагается, что Arl3-GTP активирует или рекрутирует ещё не идентифицированный GEF для Arl1. Этот необычный путь доставки делает возможной регуляцию активности Arl1 посредством Sys1 или acetylation.
PtdIns(4)P and Golgi membranes
Хотя Arf1 является ключевым маркерным белком, который позволяет оболочечным белкам и др. эффекторам локализоваться на Golgi мембранах, однако становится ясно, что рекрутирование этих эффекторов д. сопровождаться не просто непосредственным связыванием с Arf1-GTP. Это очевидно, потому что многие Arf1 эффекторы обнаруживают более ограниченное распределение в штабелях, чем самого Arf1. Кроме того, некоторые эффекторы, могут быть связаны с Arf семейством GTPases из др. мембран
in vitro, даже если эффекторы не локализованы на этих мембранах
in vivo. Очевидно, что связи Golgi
in vivo обеспечиваются с помощью комбинационного распознавания Arf1 и дополнительных детерминант. В случае покровных белков это в некоторых случаях может быть связано со взаимодействием с цитозольными хвостами грузовых белков [26]. Наиболее общим детерминантом качественных особенностей Golgi, который действует в сочетании с Arf1 является липид PtdIns(4)P. Этот липид обнаруживается в плазматической мембране, где он действует как субстрат
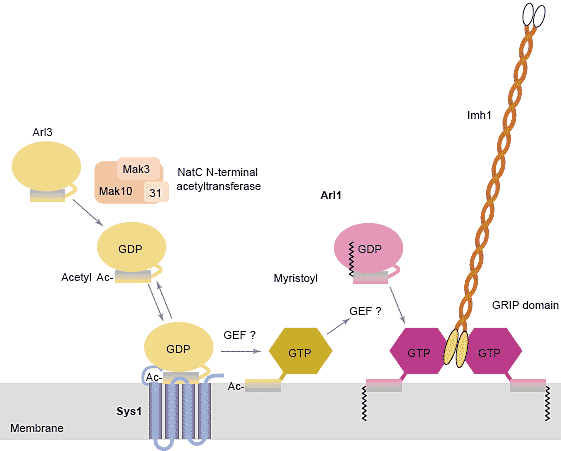 Рис. 1. Activation of the small GTPase Arl1 on Golgi membranes. Recruitment of yeast Arl1 to the trans-Golgi requires a second GTPase Arl3 (ARFRP1 in
mammals). Arl3 is acetylated (denoted by Ac) at its N terminus by the NatC complex, and this modification is essential for it to bind, perhaps directly, to the integral membrane protein Sys1 [24,25]. An as-yet-unidentified GTP exchange factor (GEF) then activates Arl3, and the GTP-bound form of Arl3 is thought to recruit or activate an unknown GEF for Arl1. This GEF converts Arl1 from the GDP-bound form, which is only weakly associated with membranes, to the GTP-bound form, which binds tightly to membranes via its amphipathic helix. The GTP-bound form of Arl1 is then recognized by GRIP-domain coiled-coil proteins (Imh1 in yeast) and other peripheral membrane proteins that need to bind to the trans-Golgi.
Рис. 1. Activation of the small GTPase Arl1 on Golgi membranes. Recruitment of yeast Arl1 to the trans-Golgi requires a second GTPase Arl3 (ARFRP1 in
mammals). Arl3 is acetylated (denoted by Ac) at its N terminus by the NatC complex, and this modification is essential for it to bind, perhaps directly, to the integral membrane protein Sys1 [24,25]. An as-yet-unidentified GTP exchange factor (GEF) then activates Arl3, and the GTP-bound form of Arl3 is thought to recruit or activate an unknown GEF for Arl1. This GEF converts Arl1 from the GDP-bound form, which is only weakly associated with membranes, to the GTP-bound form, which binds tightly to membranes via its amphipathic helix. The GTP-bound form of Arl1 is then recognized by GRIP-domain coiled-coil proteins (Imh1 in yeast) and other peripheral membrane proteins that need to bind to the trans-Golgi.
для синтеза PtdIns(4,5)P2; однако, он также синтезируется на Golgi, где он, по-видимому, не превращается в PtdIns(4,5)P2, а скорее непосредственно распознаётся некоторыми белками. Сюда входят OSBP, FAPP1 и CERT, набор липид-связывающих белков, с близко родственными pleckstrin homology (PH) доменами, которые связывают PtdIns(4)P и PtdIns(4,5)P2, но которые также нуждаются в Arf1 для доставки в Golgi [5,27-29]. Сходным образом, AP1/clathrin оболоска нуждается в этих двух детерминантах для соединения с trans-Golgi [30]. Т.о., присутствие Arf1-GTP и PtdIns(4)P в комбинации может быть характерным признаком TGN.
И снова встаёт вопрос, как Golgi пул из PtdIns(4)P синтезируется, т.к. с активацией Arfs ситуация становится более сложной, чем можно было ожидать и надеяться. Клетки млекопитающих и дрожжевые обладают двумя классами PtdIns 4-kinase, типа II и типа III (тип I, как известно, обладает иной активностью) [31]. Дрожжи имеют одну типа-II киназу, Lsb6, и две типа-III киназы, Pik1 и Stt4. Из них только Pik1, по-видимому, ответственна за синтез Golgi PtdIns(4)P [32,33]. В клетках млекопитающих имеются по две киназы каждого типа, из них, по-видимому, на Golgi находятся: типа-III киназа, гомолог
Pik1 PI4KIIIβ, и типа-II киназа, PI4KIIα [34,35]. Обе киназы являются белками периферических мембран, но как они сами по себе рекрутируются на мембраны Golgi ещё не установлено. Недавнее исследование показало, что PI4KIIIβ может взаимодействовать с Rab11, хотя эта
GTPase обычно рассматривается как эндосомная, а дрожжевая Rab11 гомолог Ypt31, по-видимому, не рекрутирует Pik1 [36,37].
В дополнение к роли PtdIns 4-kinases, недавно было показано, что внутриклеточное распределение PtdIns(4)P также специфицируется с помощью локальной деградации липидов. У дрожжей основной PtdIns(4)P-phosphatase является Sac1, резидентный мембранный белок ER, который законсервирован также и у людей [38]. Удаление Sac1 приводит к ~10-кратному увеличению общего уровня PtdIns(4)P и вызывает плейотропные дефекты в мембранном трафике и актиновом цитоскелете [39,40]. Этот избыток PtdIns(4)P, по-видимому, накапливается во многих местах, включая плазматические мембраны и вакуоли, а также ER [33,39]. Sac1, по-видимому, ограничивает распределение PtdIns(4)P с помощью рециклинга между ER и ранним Golgi и может оказывать эффект на плазматическую мембрану и вакуоли путём обеспечения контакта этих мембран из ER посредством соединений, в которых две мембраны тесно соприкасаются [41]. Кроме того было показано, что дрожжевая Sac1 перемещается из ER в Golgi, когда рост замедляется при ограничении пищи и это сопровождается одновременным снижением уровней PtdIns(4)P в Golgi [42]. Т.о., Sac1, по-видимому, ограничивает распределение PtdIns(4)P поздним Golgi и (на средних уровнях) плазматической мембраной путём деградации его в остальных местах в быстро растущих клетках и может сдвигать его локализацию, чтобы снизить уровни PtdIns(4)P в аппарате Гольджи, если это необходимо.
Diacylglycerol and Golgi function
Давно известно, что высокие уровни diacylglycerol (DAG) генерируются в Golgi, когда группы головных липидов удаляются для переноса на ceramide во время синтеза sphingolipid. Точная судьба этого DAG неизвестна, хотя недавнее клонирование Golgi sphingomyelin synthase д. открыть путь для понимания биологии этого процесса [43]. Тем не менее очевидно, что DAG необходим для выхода из TGN, и некоторые белки, по-видимому, используют DAG как средство для распознавания Golgi. В частности, часть клеточных пулов из трех родственных протеин киназ, PKD1 (PKCm), PKD2 и PKD3 (PKCn), направляется на мембраны Golgi посредством DAG-специфических богатых цистеином доменов и эти киназы, как известно, необходимы для эффективного образования basolaterally нацеленных носителей, покидающих TGN в поляризованных клетках [44-46]. Т.к. DAG генерируется также на плазматической мембране во время событий сигнальной трансдукции, то DAG-связывающие белки д. преимущественно распознавать др. компартмент-специфические маркеры, чтобы гарантировать корректную доставку. Недавно подтверждена важность уровней Golgi DAG, т.к. было показано, что Nir2/PITPNM1, член семейства белков переносчиков phosphatidylinositol, также необходим для генерации Golgi DAG и необходим для выхода белков из TGN в клетках культуры тканей млекопитающих [47]. Мыши, лишенные PITPNM1 погибают во время раннего развития, но нулевые аллели RdgB, единственного гомолога у
Drosophila, развиваются нормально и обнаруживают только нарушения передачи сигналов в сетчатке и обонянии, указывая тем самым, что семейство PITPNM может быть необходимо только для секреции в некоторых случаях [48].
Palmitoylation and the Golgi apparatus
GTPases и липиды вносят существенный вклад в качественные особенности Golgi мембран в общем-то одним и тем же способом - они формируют локальные лабильные детерминанты, которые связаны не-ковалентно с помощью цитозольных белков. Однако, это не единственный путь, с помощью которого белки периферических мембран могут поставляться в специфические органеллы. Давно известно, что многие периферические и интегральные мембранные белки содержат palmitoyl (C16:0) fatty acyl группы, прикрепленные к специфическим цистеиновым остаткам. Единственная palmitoyl группа не обеспечивает стабильного мембранного связывания, но в комбинации с др. ацильными группами или prenyl группой может прикреплять белок первоначально к бислою. Т.о., место действия palmitoyltransferase д. предопределять, с какой из клеточных органелл определенный белок будет ассоциировать в первую очередь. Конечно, будучи однажды ассоциированным белок может перемещаться на др. части клетки, если липидные модификации не необратимы, но если процесс palmitoylation обратим, то тогда белок может накапливаться в местах добавления липида или вступать в цикл между органеллой, к которой он был добавлен и нижестоящей органеллой, с которой он удаляется.
До последнего времени понимание динамики и биологии palmitoylation было затруднено из-за трудности выделения protein acyltransferases (PATs), ответственно за добавление palmitoyl [49]. В 2002 идентифицированы две PATs у дрожжей [50,51]. Обе PATs являются политопными мембранными белками, которые имеют общий 'DHHC' мотив. Этот мотив обнаружен во многих др. мембранных белках у дрожжей и млекопитающих и, следовательно, определяет семейство предполагаемых PATs, которые, по-видимому, имеют разное расположение и разные субстраты [50-52]. Недавно было показано, что, по крайней мере, некоторые PATs локализуются в Golgi и вполне возможно, что Golgi является одним из главных мест в клетке palmitoylation белков. В частности, недавно было установлено, что Golgi пул H-Ras и K-Ras поддерживается с помощью цикла palmitoylation и depalmitoylation (Figure 2). Белки Ras являются palmitoylated в Golgi,перемещаются с помощью везикулярного транспорта в плазматическую мембрану, а затем depalmitoylated и возвращаются назад в Golgi через цитозоль для repalmitoylation [53].
Эти наблюдения открывают возможность того, что Golgi способен рекрутировать др. белки с помощью такого 'acylation trapping', а недавно показано, что SNARE белок Ykt6 рекрутируется в Golgi и вакуоли с помощью обратимой palmitoylation [54,55]. Этот SNARE лишен трансмембранного домена, но вместо этого его С-терминальный хвост модифицируется с помощью prenyl и palmitoyl групп, последнее добавление необходимо для локализации в Golgi и функционирования Ykt6. Давно известно, что некоторые белки периферических мембран, включая eNOS (endothelial nitric
oxide synthase), SCG10 (a microtubule destabilizing protein)
и GAD65 (glutamic acid decarboxylase), рекрутируются в Golgi посредством короткой palmitoylated последовательности и распознавание этих белков с помощью Golgi-специфических PATs может объяснить эти наблюдения
[49].
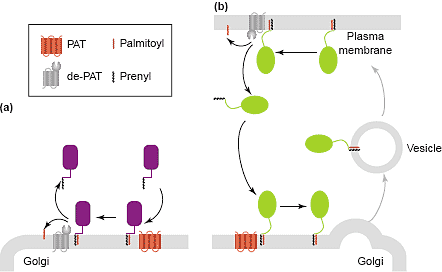 Control of protein localization by reversible palmitoylation. Protein acyltransferases (PATs) attach palmitoyl groups to cysteines on specific
cytosolic proteins. If the protein already has an intrinsic affinity for lipid bilayers, for instance if it has an attached prenyl group, then the palmitoylation will cause the protein to accumulate on the membrane that contains the PAT. The effect of this ‘acylation trapping’ on the localization of the protein will depend on if, and where, the palmitoyl group is removed. As shown in (a), a palmitoyl group attached in the Golgi could be removed in the same organelle, and hence the protein would have a transient association with only Golgi membranes. This is proposed to be the case for the SNARE Ykt6, with it being suggested that depalmitoylation may occur following SNARE complex assembly and membrane fusion [54,55]. Alternatively, the palmitoyl group may not be removed in the Golgi, but rather the anchored protein could leave from the trans-Golgi network (TGN) for the plasma membrane (b). Action of an acyl-protein thioesterase (de-PAT) at the plasma membrane would allow the protein to return to the Golgi to repeat the cycle. Such a cycle has been demonstrated for H-Ras and N-Ras, which have two and one palmitoyl attachments, respectively [53]. The nature of the thioesterase that acts on Ras is not clear, although cytosolic proteins with acyl-protein thioesterase activity have been identified [50]. In addition, several proteins are palmitoylated in the Golgi but then accumulate at the plasma membrane, perhaps because they are not depalmitoylated [49]. These systems may allow the cell to restrict the localization of particular proteins to a subset of organelles and the vesicles that connect them.
Control of protein localization by reversible palmitoylation. Protein acyltransferases (PATs) attach palmitoyl groups to cysteines on specific
cytosolic proteins. If the protein already has an intrinsic affinity for lipid bilayers, for instance if it has an attached prenyl group, then the palmitoylation will cause the protein to accumulate on the membrane that contains the PAT. The effect of this ‘acylation trapping’ on the localization of the protein will depend on if, and where, the palmitoyl group is removed. As shown in (a), a palmitoyl group attached in the Golgi could be removed in the same organelle, and hence the protein would have a transient association with only Golgi membranes. This is proposed to be the case for the SNARE Ykt6, with it being suggested that depalmitoylation may occur following SNARE complex assembly and membrane fusion [54,55]. Alternatively, the palmitoyl group may not be removed in the Golgi, but rather the anchored protein could leave from the trans-Golgi network (TGN) for the plasma membrane (b). Action of an acyl-protein thioesterase (de-PAT) at the plasma membrane would allow the protein to return to the Golgi to repeat the cycle. Such a cycle has been demonstrated for H-Ras and N-Ras, which have two and one palmitoyl attachments, respectively [53]. The nature of the thioesterase that acts on Ras is not clear, although cytosolic proteins with acyl-protein thioesterase activity have been identified [50]. In addition, several proteins are palmitoylated in the Golgi but then accumulate at the plasma membrane, perhaps because they are not depalmitoylated [49]. These systems may allow the cell to restrict the localization of particular proteins to a subset of organelles and the vesicles that connect them.
Интересным указанием является то, что palmitoylation в Golgi может выполнять дополнительную роль, далекую от непосредственного прикрепления белков на мембране, которое получено при изучении кристаллической структуры Bet3, субъединицы TRAPP. Этот растворимый комплекс действует на cis-Golgi как GEF для одного или более Golgi Rab белков. Как TRAPP рекрутируется в мембраны Golgi неизвестно, но рентгеновская структура Bet3 выявляет длинный гидрофобный карман, а в кристаллической бактериально экспрессируемый Bet3 этот карман содержит или palmitoyl или myristoyl
acyl цепочку [56,57]. Эти ацильные группы, по-видимому, не нужны для ковалетного прикрепления Bet3 у дрожжей, но мутации, которые блокируют карман, мешают выполнению функции Bet3, указывая тем самым, что распознавание palmitoyl группы на др. молекулах может помогать Bet3, и таким образом TRAPP соединяется с Golgi, и, следовательно, инициирует продукцию Rab белков, которые помогают предопределить качественные особенности cis-Golgi.
Conclusions
Small GTPases and specific lipids play a central role in
defining the identity of all the membranes of the secretory
and endocytic pathways. The complex structure and
roles of the Golgi apparatus probably account for the
particularly large number of such molecules found on
this organelle. If, as is now widely believed, the cisternae
of the Golgi form at the cis side and then mature to the
trans side, there may well be a hierarchy of recruitment
whereby the earliest determinants recruit the factors
responsible for generating later determinants. In addition,
the multiplicity of these determinants may be important
for the independent regulation of different transport steps
that impinge on a single cisterna. At present there is still
much to be learnt about the molecular mechanisms by
which GTPases and lipids are generated on particular
parts of the Golgi. So far it seems that many of the key
regulatory molecules, including GEFs and lipid kinases,
are themselves peripheral membrane proteins, which may
ensure that the identity of the cisternae can be rapidly
created following ER exit, and then altered if the cisternae
are maturing. However, recent studies have highlighted
several integral membrane proteins that also play
important roles, such as the YIP families (whose members
bind to Rabs), Sys1 (which binds Arl3/ARFPR1) and the
PATs. These membrane proteins may allow recruitment
of trafficking proteins from the cytosol to be coordinated with events inside the cisternae as the latter mature. In
addition, they may be of particular importance to vesicles
involved in transport, which must somehow be distinguished
from the compartment from which they have
budded to ensure that the target organelle fuses with the
vesicle and not its source. It is clear that as more is learnt
about how Golgi-specific GTPases and lipids are generated,
more will be revealed about the underlying organization
and logic of the Golgi.
Сайт создан в системе
uCoz
