Многие промоторы обладают функцией инсуляторов. Напр., у
Drosophila, 6 из 10 идентифицированных инсуляторов приходятся на промоторные области. Интересно, что первые инсуляторы, которые были идентифицированы, scs (specialized chromatin structure) и scs0, представляют набор дивергентно транскрибируемых промоторов [44-46].
Дальнейшие связи между промоторами и инсуляторами у Drosophila
выявлены при изучении комплекса bithorax, которые показали, что транскрипция участвует в предопределении доменов cis регуляторной активности [47]. Сходным образом, промоторы действуют как барьеры распространению репрессии у S. cerevisiae [17,48].
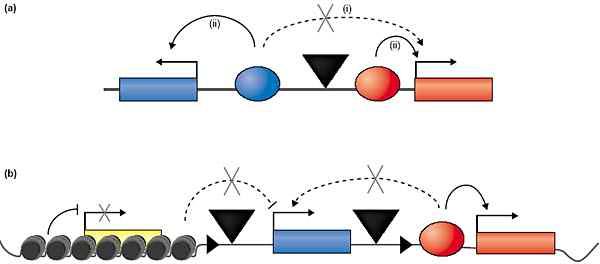
Инсуляторы, заключённые в промоторы, м. осуществлять регуляторную изоляцию с помощью многих механизмов. Одна из возможностей состоит в том, что промотор-связывающие факторы рекрутируют HATs или др. модифицирующие хроматин комплексы, которые препятствуют распространению белковых комплексов. Такой механизм м. объяснить, как 5' HS4 ,блокирует репрессию. Однако, этот способ не м. легко объяснить блокирование энхансеров с помощью инсуляторов, т.к. хроматин-модифицирующие комплексы обычно сцеплены с повышенной транскрипцией. Или напротив, промоторные области м. обеспечивать инсуляцию, т.к. они включают последовательности, которые залавливают энхансеры, тем самым захватывая в ловушку энхансер, удаляя его прочь от естественного промотора и приводя к тому , что этот естественный промотор теряет активность (Рис. 2a). Предполагается, что взаимодействия между энхансерами и залавливаемыми областями промоторов м.б. временными и не приводить к инактивации энхансера, т.к. эти взаимодействия м. воспроизводить естественную энхансер-промотор динамику. Недавние исследования подтверждают возможность того, что промоторные области содержат энхансер-связывающие элементы. Так, идентифицирован элемент внутри проксимальной области промотора гена Drosophila Sex combs reduced (Scr), который регулирует взаимодействия между энхансером и промотором внутри большой регуляторной области комплекса Antennepedia. Регуляция возникает в результате улавливания T1 энхансера и прикрепления его к промотору Scr [49]. Проксимальные связывающие элементы промотора м. также залавливают и сайленсеры, подтверждая тем самым, что механизм ловушек м. объяснить оба свойства инсулятора.
Connections between insulation and
topological domains
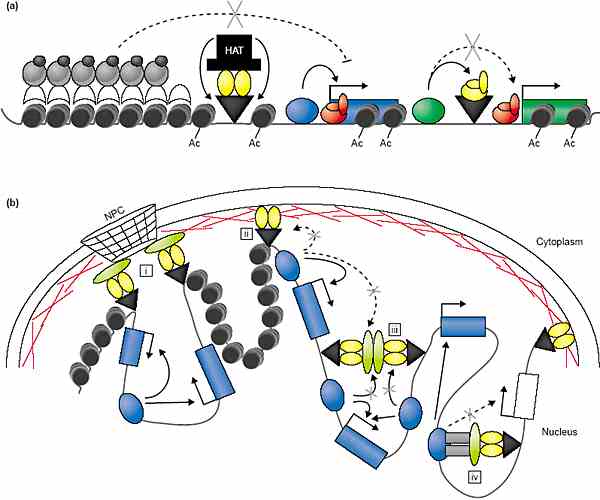
Связь между инсуляторами и топологией ДНК выявлена в исследованиях структуры хромосом. Анализ интерфазных хромосом указывает, что эухроматин организован в виде петель, которые расходятся в виде лучей из инертных областей хромосом [50,51]. Эти петлеобразные домены, как полагают, формируются благодаря ассоциации между специализированными нуклеопротеиновыми комплексами, которые закрепляют хромосомные области на ядерных субструктурах, таких как ядерный матрикс (Рис. 2b). Петлеобразные домены, как полагают, складываются в независимые высшего порядка хроматиновые структуры, которые облегчают регуляторные взаимодействия внутри домена, но предупреждают взаимодействия между доменами, чтобы осуществлять регуляторную автономию. Эта идея подтверждается недавним использованием 'boundarytrap' assay, который продемонстрировал, что физическое привязывание HML локуса к nuclear pore complex (NPC) блокирует распространение репрессии, формируя транскрипционно активный домен среди молчащей области (Рис. 2b [i];
[52]). Т.к. неясно, м. ли эндогенные анти-сайленсеры S. cerevisiae
функционировать путем прикрепления к NPC, то это исследование иллюстрирует связь между инсуляцией и возникновением топологически независимого домена.
Дальнейшие корреляции между образованием петлеобразных доменов и инсуляцией выявлены в исследованиях инсулятора Drosophila
gypsy. Функция инсулятора gypsy зависит от ДНК-связывающего белка, Su(Hw), который рекрутирует белок Mod(mdg4) (Modifier of mdg4) на хромосомы [53]. Эти белки ассоциируют с сотнями хромосомных мест в политенных клетках, которые м. представлять собой сайты эндогенных геномных инсуляторов, хотя это и не подтверждено экспериментально [23,24]. В диплоидных клетках, выявлено только 20-25 точек локализации gypsy insulator белков, это указывает на то, что эти белки объединяются, формируя структуры, обозначаемые как
'insulator bodies' [24,54]. Insulator тельца, как полагают, создают отдельные петлеобразные домены внутри генома. Петлеобразные домены м. формироваться благодаря взаимодействиям между gypsy инсуляторами или между этими инсуляторами и ядерным матриксом (Рис. 2b [ii,iii]). Преимуществом модели петлеобразных доменов функции инсуляторов является то, что и блокирование энхансеров и предупреждение позиционных эффектов м.б. объяснены одним механизмом.
Экспериментальные доказательства взаимодействий между gypsy инсуляторами получены при изучении трансгенов, где было установлено, что инсерция двух gypsy инсуляторов между энхансером и промотором позволяет энхансеру обойти инсулятор и активировать транскрипцию [55,56]. Эти наблюдения подтверждают предположение, что gypsy инсуляторные белковые комплексы взаимодействуют др. с др. Однако, взаимодействия между gypsy инсуляторными комплексами м. и не создавать топологически изолированных доменов, т.к. энхансеры и промоторы в двух отдельных gypsy-insulator-предопределяемых доменах общаются др. с др. Альтернативным способом действия инсулятора gypsy предполагается взаимодействие с транскрипционными регуляторными белками скорее, чем со вторым gypsy инсулятором (Figure 2b [iv]). Такие взаимодействия м. ограничивать способность энхансеров и промоторов к взаимодействию. Такая возможность согласуется с данными, которые показывают, что взаимодействия происходят между gypsy insulator белками и транскрипционными регуляторными белками, известными как facilitators [57,58]. Далее, сила энхансера и промотора влияют на эффективность инсулятора, указывая тем самым, что существует конкуренция между инсулятором и промотором за взаимодействие с энхансером [26,59].
Многие функциональные домены в геномах позвоночных ограничиваются с помощью элементов, участвующих в инсуляции. Напр.. сайты связывания для CTCF enhancer-блокирующего белка фланкируют локусы β-globin у цыплят, мышей и человека, а также Igf2/H19 импринтируемый домен у мышей и людей [20,21,60-63]. Эти наблюдения согласуются с возможностью того, что взаимодействия между элементами
CTCF границ генерируют регуляторную автономию с помощью образования петлеобразного домена. Однако, обойти энхансер не удается, когда пара инсуляторов позвоночных помещается между энхансером и промотором, как это показано для 5' HS4 и Igf2/H19 импринтируемой контрольной области [63,64]. Эти находки указывают на то, что не все инсуляторы взаимодействуют др. с др., делая неопределенной возможность модели петлеобразных доменов. Возможно, что пограничные CTCF элементы рекрутируют транскрипционные активаторы для установления независимого функционального домена. Эти исследования подчёркивают, что инсуляторы м. использовать множественные механизмы для ограничения действия элементов, контролирующих транскрипцию.
Connections between insulators and human
disease
Связи между инсуляторами и болезнями у людей указывают на то, что инсуляторы являются критическими компонентами генома эукариот. Важная роль, которую играют инсуляторы в поддержании транскрипционной автономии, подчёркивается открытием, что врожденные формы myotonic dystrophy ассоциируют с потерей функции DM1 инсулятора [65]. Инсуляторы обладают дополнительными онтогенетическими регуляторными функциями, на это указывает связь инсуляторов с геномным импринтингом и Х-инактивацией [18,61-63, 66,67].
Инсуляторы обладают высоким терапевтическим потенциалом. Недавние результаты испытаний генной терапии обратили внимание на инсуляторы благодаря их способности ограничивать регуляторные взаимодействия (Рис. 1b). Современные генотерапевтические технологии используют ретровирусные вектора, которые случайно вносят гены в хромосомы. Этот подход открывает возможность аберрантной экспрессии терапевтического гена и/или эндогенных генов в каждом сайте интеграции из-за несоответствия взаимодействия между регуляторными элементами внутри генома и ретровирусного вектора. Этот механизм м. объяснить недавние наблюдения лейкемия-подобных заболеваний у двух пациентов в результате генотерапии по поводу иммунодефицита [68,69]. Добавление инсуляторов к векторам генотерапии м. помочь в решении этой проблемы.
Conclusions
Insulators are fundamental components of eukaryotic
genomes. These elements represent a diverse class of
sequences that establish regulatory autonomy by multiple
molecular mechanisms. Emerging connections between
insulators and human disease demonstrate the importance
of understanding mechanisms of insulator action.
Insights into these processes could lead to the development
of improved strategies for gene therapy and treatment
of disease.
Сайт создан в системе
uCoz