Посещений:  Индукция Хрусталика
Индукция Хрусталика
Регуляторные Пути
|
|
Pathways regulating lens induction in the mouse Lang R.A.  Int. J.Dev. Biol. Int. J.Dev. Biol. V.48, No 8-9, P. 783-791 (2004). |
|
|
The embryological origin of the lens
Хрусталик происходит из головной эктодермы эмбрионов позвоночных (Рис. 1) первым морфологическим признаком образования хрусталика является образование хрусталиковой плакоды. Эта структура является утолщением области поверхностной эктодермы головы по соседству с оптическим пузырьком. Утолщенная хрусталиковая плакода появляется после того как оптические пузырьки эвагинируют из переднего мозга и приходят в тесный контакт с головной эктодермой. Взаимодействие между оптическим пузырьком и презумптивной хрусталиковой эктодермой чрезвычайно строгое и опосредуется с помощью цитоплазматических выпячиваний между двумя слоями тканей. Затем происходит скоординированная инвагинация хрусталиковой плакоды и наружного слоя оптического пузырька. Это ведет к образованию хрусталиковой ямки и оптического бокала. На этой стадии эпителий хрусталиковой ямки, ближайший к презумптивной сетчатке начинает утолщаться, первая степень дифференцировки клеток хрусталиковых волокон. При этом наружный слой оптического бокала опадает назад к проксимальному слою оптического пузырька, чтобы сформировать эпителий RPE и презумптивной сетчатки. Закрытие хрусталиковой ямки на поверхностном эпидермисе ведет к образованию хрусталикового пузырька. Тесная ассоциация между оптическим пузырьком и хрусталиковой плакодой указывает на на то, что оптический пузырек выполняет критическую роль в индукции хрусталика.
Lens induction is multi-step process
Группа R. Grainger выявила, по крайней мере, 4 стадии развития хрусталика (Grainger, 1996; Sullivan et al., 2004). Они соответствуют периоду компетентности к образованию хрусталика (Servetnick, Grainger, 1991) в эктодерме средней/поздней гаструлы, приобретению склонности к формированию хрусталика во всей головной эктодерме во время нейруляции (Grainger et al., 1997), спецификации судьбы клеток хрусталика в конце нейруляции и дифференцировки (Grainger, 1992).
Induction genes become differentiation genes
Bpctcnyj? что большинство путей, критических для индукции хрусталиков, важны также на поздних стадиях развития хрусталиков. Напр., путь передачи Fgf сигналов участвует как в индукции, так и в регуляции дифференцировки клеток хрусталиковых волок (McAvoy et al., 1999). Известно также, что транскрипционные факторы, критические для индукции, участвуют позднее в дифференцировке. Напр., у мышей Рах6 необходим для индукции хрусталиков, но он активирует также позднее αB-кристаллины в развивающемся хрусталике (Piatigorsky, 1998). Имеется таже связь между индукцией генами транскрипционных факторов, которые находятся иерархрчески ниже ( напр., Mafs и Prox1) и регуляцией генов дифференцировки, подобных генам кристаллинов (Cui et al., 2004).
Pax6 gene function and regulation
The Pax6 gene
Функция Рах6 важна для развития глаз на что указывает отсутствие глаз у людей, мышей и мух с мутациями потери функции в Рах6. У позвоночных экспрессии Рах6 обнаруживается в разных тканях, включая и те, которые участвуют в ранних фазах развития глаз. Рах6 впервые экспрессируется в передней части нервной пластинки, в области, в конченом итоге дающей сетчатку. Несколько позднее Рах6 экспрессируется также в широкой облати головной поверхностной эктодермы, включая домен, который дает хрусталик. Экспрессия Рах6 сохраняется в презумптивной сетчатке и пигментном эпителии сетчатки, когда формируется оптический бокал, а домен экспрессии в поверхностной эктодерме сокращается до области хрусталиковых плакод и непосредственно примыкающей к ней поверхностной эктодерме. Уровень экспрессии Рах6 увеличивается в хрусталиковой плакоде после тесного контакта с оптическим пузырьком (Grindley et al., 1995).
Мутации потери функции Рах6 также указывают на критическую роль Рах6 в развитии глаз. В лаб. Gehring было продемонстрировано, что неправильная экспрессия Рах6 Drosophila (ген eyeless) м. формировать эктопические глаза во множественных местах (Halder et al., 1995). Показано, что эта активность эволюционно законсервирована, у мух и мышей Рах6 м. индуцировать эктопические глаза. У holometabolous насекомых ситуация несколько сложнее, т.к. имеется два ортолога Рпах6, eyeless и twin of eyeless (Czerny et al., 1999). Оба они способны индуцировать эктопические глаза. Сходная ситуация у рыбок данио, у которых удвоенные Рах6.1 и Рах6.2 экспрессируются в отдельных, но перекрывающихся доменах (Nornes et al., 1998).
Эксперименты на Xenopus показали. что Рах6 м. индуцировать эктопические глаза у позвоночных (Chow et al., 1999). Такие эктопические глаз образуются только в головной области из-за ограничения домена глазной компетентности эктодермы у ранних эмбрионов Xenopus (Servetnick, Grainger, 1991ж Ягиук уе al., 2003). Эктопические глаза содержат все взрослые типы клеток.
Pax6 is necessary and sufficient for lens development
Установлено (Fujiwara et al., 1994), что комбинация оптического пузырька и презумптивного хрусталика дикого типа обеспечивает формирование хрусталика. Рекомбинация же оптического пузырька small eye и презумптивной эктодермы дикого типа также дает образование хрусталика. Напротив, комбинирование оптического пузырька дикого типа с презумптивной хрусталиковой эктодермой small eye не способно формировать хрусталик. Это указывает на то, что развитие хрусталика нуждается в функции Рах6 в поверхностной эктодерме, но не в оптическом пузырьке.
Сходное заключение сделано на основании экспериментов с получением химерных мышей (Quinn et al., 1996; Collinson et al., 2000). В этих условиях мутантные small eye клетки не вносили вклада в хрусталиковую плакоду на ст. Е9.5 и позднее в дифференцирующийся хрусталик. В этих экспериментах также было подтверждено
, что Рах 6 играет важную роль в регуляции адгезивных взаимодействий. Более прямая демонстрация потребности Рах6 в развитии хрусталиков осуществлена с помощью floxed аллеля гена Рах6, условно делетируемого в хрусталиковой плакоде (Ashery-Padan et al., 2000). В результате отмечается отсутствие развития хрусталика после ст. плакоды. Интересно, что хотя при этом сетчатка неправильно организована, но дифференцировка нейронов и ламинация происходят нормально.
При избыточной экспрессии Рах в экспериментах по получению эктопических глаз хрусталики возникают с высокой частотой (Altmann et al., 1997; Chow et al., 1999). Эти хрусталики экспрессируют хрусталик-специфичные маркеры. такие как β-кристаллины и многие имеют поляризованную морфологию нормальных хрусталиков. Некоторые имеют нормальную морфологию, размеры и экспрессируемые маркеры. Клональные исследования показывают, что эти эктопические хрусталики являются результатом клеточно автономного действия Рах6 (Altmann et al., 1997; Chow et al., 1999). Эти хрусталики образуется в отсутствие какой-либо ткани сетчатки.
Pax6 expression in the lens lineage is controlled by at least two enhancers
Выявлены элементы, контролирующие транскрипцию, в Рах6 (Williams et al., 1998; Kammandel et al., 1999; Xu et al., 1999). Сравнение генов Рах6 человека и мыши показывает, что регуляция транскрипции это гена сложна. Имеется свыше 40 высоко консервативных, не-кодирующих последовательностей
(http://trafac.cchmc.org).
Ряд этих консервативных последовательностей обладают транскрипционной энхансерной активностью. Примерно 3.5 т.п.н. выше Р0 промотора в Рах6 имеется консервативная область в 340 п.н., которая обладает активностью энхансера хрусталикового клона (Williams et al., 1998; Kammandel et al., 1999; Xu et al., 1999). Эта область обозначена как ЕЕ (ectoderm enchancer). Будучи внедрен в репортерный трансген ЕЕ обусловливает его экспрессию в развивающейся хрусталиковой плакоде и соседней эктодерме, начиная с Е8.75 у мышей (Williams et al., 1998; Kammandel et al., 1999; Xu et al., 1999). Затем активность ЕЕ распространяется на весь хрусталиковый пузырек, но после Е11.5 ограничивается хрусталиковым эпителием и эпителием слезных желез и конъюнктивой (Williams et al., 1998; Kammandel et al., 1999; Xu et al., 1999).
Энхансер хрусталикового клона, обозначенный как SIMO, выявлен при анализе природы мутаций у пациентов с Aniridia, связанным с точкой разрыва с последнем экзоне Рах6 (Kleinjan et al,2001). Было установлено, что имеется несколько высоко консервативных областей непосредственно дистальнее транслокационной точки разрыва. Установлено. что SIMO элемент обладает активность в хрусталиковом клоне. Возможно, что ЕЕ и SIMO действуют кооперативно, обеспечивая всю широту и уровень экспрессии Рах6 в презумптивной области хрусталика (Treisman, Lang, 2002; Lang, McAvoy, 2003).
There are two phases of Pax6 expression
Установлено, что существуют две самостоятельные фазы экспрессии Рах6 в презумптивной хрусталиковой эктодерме эмбрионов мышей (Grindley et al., 1995). Аллель Рах6Sey1Neu является точковой мутацией, дающей нефункциональный белок. Его анализ показал, что экспрессия Рах6 в поверхностной эктодерме головы сохраняется, но что экспрессия в хрусталиковой плакоде теряется. Это указывает на то, что имеются две фазы экспрессии Рах6 и что последняя зависит от первой фазы экспрессии. Эти две фазы экспрессии Рах6 составляют первую ступень в генетическом пути, описывающем индукцию хрусталиков у мышей (Рис. 2). Возможно, что EE и SIMO действуют совместно, чтобы дать ст. Рах6placode
EE is required for normal development of the lens
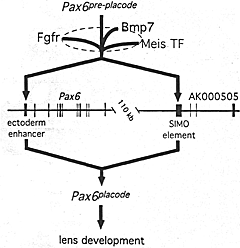 Fig. 2. Inductive signals regulate Pax6 expression in presumptive tons: a genetic model. The arrows indicate genetic interactions except in the case of the Meis transcription factor-enhancer interactions. At the apex of the hierarchy is the pre-placodal phase of Pax6 expression (Pax6pre-piacode) It is understood that the later phase of Pax6 expression in the lens placode (Pax6placode) is dependent upon earlier activity of Pax6. Pax6placode is apparently regulated by at least two enhancers that are represented by the green vertical bars on the schematic of the Pax6 gene (exons, red vertical bars). One is the so-called ectoderm enhancer and the other the SIMO element that is located in the final intron of the adjacent gene, AK000505, that is transcribed in the opposite direction to Pax6. The Meis transcription factors (Meis TF) are likely to regulate the expression of Pax6 directly by binding to the ectoderm enhancer, and possibly to the SIMO element. Since both placodal Pax6 is reduced in mouse embryos that express a dominant-negative Fgf receptor in the lens lineage it is likely that Pax6placode is genetically downstream of Fgf receptor activity. Given that an even lower level of Pax6 can be recorded in embryos that express the dominant-negative Fgf receptor and have half the normal level of Bmp7, we can suggest thai Fgf receptor and Bmp7 signaling cooperate to maintain the placodal phase of Pax6 expression. Previous analysis has shown that the early phase of Pax6 expression is unaffected in the Bmp7 null mice and ihus, FGF and Bmp7 signaling must converge on the pathway downstream of Pax6pre-placode. Fig. 2. Inductive signals regulate Pax6 expression in presumptive tons: a genetic model. The arrows indicate genetic interactions except in the case of the Meis transcription factor-enhancer interactions. At the apex of the hierarchy is the pre-placodal phase of Pax6 expression (Pax6pre-piacode) It is understood that the later phase of Pax6 expression in the lens placode (Pax6placode) is dependent upon earlier activity of Pax6. Pax6placode is apparently regulated by at least two enhancers that are represented by the green vertical bars on the schematic of the Pax6 gene (exons, red vertical bars). One is the so-called ectoderm enhancer and the other the SIMO element that is located in the final intron of the adjacent gene, AK000505, that is transcribed in the opposite direction to Pax6. The Meis transcription factors (Meis TF) are likely to regulate the expression of Pax6 directly by binding to the ectoderm enhancer, and possibly to the SIMO element. Since both placodal Pax6 is reduced in mouse embryos that express a dominant-negative Fgf receptor in the lens lineage it is likely that Pax6placode is genetically downstream of Fgf receptor activity. Given that an even lower level of Pax6 can be recorded in embryos that express the dominant-negative Fgf receptor and have half the normal level of Bmp7, we can suggest thai Fgf receptor and Bmp7 signaling cooperate to maintain the placodal phase of Pax6 expression. Previous analysis has shown that the early phase of Pax6 expression is unaffected in the Bmp7 null mice and ihus, FGF and Bmp7 signaling must converge on the pathway downstream of Pax6pre-placode.
Чтобы оценить роль ЕЕ в развитии хрусталиков получали ген с полным отсутствием ЕЕ. Мыши, гомозиготные по делеции ЕЕ, обнаруживали аномальное развитие хрусталиков (Dimanlig et al., 2001). Хрусталиковая плакода была тоньше, особенно на назальной стороне структуры. Пролиферация презумптивных хрусталиковых клеток также снижена и на всех стадиях развития хрусталиковая структура меньше, чем у мышей дикого типа. Это похоже на Peters' anomaly, наблюдаемую в некоторых случаях Рах6 гетерозиготности. ЕЕ гетерозиготные мыши обнаруживают персистенцию хрусталиковой ножки и неспособность хрусталикового пузырька отделяться от поверхностной эктодермы. Интересно, что на ст. Е9.5 Рах6 иммунореактивность все ещё обнаруживается в хрусталиковой плакоде, хотя и очень сильно пониженную с назальной стороны. Всё это указывает на то, что функция ЕЕ в обеспечении экспрессии Рах6 прежде всего на назальной строне плакоды. Наблюдение, что делеция ЕЕ не блокирует полностью развития хрусталика согласуется с идеей, что, по крайней мере, один дополнительный энхансер, вообще-то SIMO элемент, необхъодим для достижения полного уровня экспрессии Рах6 в хрусталиковой плакоде (Рис. 2).
Pax6 lens enchancers may be regulated be Meis transcription factors
Семейство Meis транскрипционных факторов у млекопитающих участвует в раннем развитии хрусталиков. Семейство Meis является TALE-класса гомеодоменовыми транскрипционными факторами (Burglin, 1997), гомологичными гену homothorax Drosophila (Bessa et al., 2002). Сайты связывания Meis идентифицированы в энхансере ЕЕ Рах6 (Zhang et al., 2002). Предполагается, что Рах6 м. регулироваться in vivo с помощью этого класса транскрипционных факторов. На это указывает: 1) иммуноидентификация Meis в комплексе с ЕЕ зондами в mobility shift подходе, 2) трансгенные мыши, обнаруживающие, что активность ЕЕ зависит от от сайта связывания Meis? 3) генетическое взаимодействие между Meis2 трансгеном и аллелем Рах6Sey1Neu и 4) демонстрация, что супрессорная форма Meis1 м. подавлять экспрессию Рах6, если временно экспрессируется в хрусталиковой плакоде (Zhang et al., 2002). Установлено, что Meis1 нулевые мыши имеют дефекты в хрусталиках, хотя легкие и на поздних стадиях развития (Hisa et al., 2004)/
Регуляция Рах6 с помощью Meis транскрипционных факторов требует, чтобы они функционировали и в ЕЕ и SIMO элементах (Lang, McAvoy, 2003). Идентификация сайтов связывания Meis в элементе SIMO представляет существенный интерес. Т.к. экспрессия генов Meis независима от Рах6 , то они лучше всего укладываются в модель генетической регуляции индукции хрусталиков в качестве вышестоящего импульса для элементов ЕЕ и SIMO (Рис. 2).
Signalling pathways involved in lens induction
Bone morphogenetic proteins have important in lens development
Предполагается, что Bmp4 и Bmp7 играют важную роль в раннем развитии хрусталиков. Bmp4 и Bmp7 экспрессируются в ранних глазных тканях и имеют перекрывающиеся паттерны экспрессии (Dudley, Robertson, 1997; Furuta, Hogan, 1998; Wawersik et al., 1999). Bmp7 экспрессируется в презумптивной хрусталиковой эктодерме и презумптивном RPE, а также дорсальной части оптического пузырька. Экспрессия Bmp7 в презумптивной ткани хрусталика затухает на ст. Е11.5. Делеция гена Bmp7 дает варьирующую пенетрантность дефектов развития глаз, от легкой микрофталмии до анофталмии (Dudley et al., 1995; Luo et al., 1995). Хрусталиковая плакода не способна формироваться у тяжело затронутых животных и что интересно теряется экспрессия Рах6 в хрусталиковой плакоде (Wawersik et al., 1999). Это указывает на то, что Bmp7 генетически стоит выше энхансеров. которые контролируют экспрессию Рах6 в хрусталиковой плакоде (Рис. 2).
Т.к. гомозиготные Bmp4 мутантные эмбрионы не выживают после Е10.5, то формирование хрусталика из презумптивной хрусталиковой эктодермы нулевых мутантов м. восстановить с помощью рекомбинации его с оптическим пузырьком дикого типа (Furuta, Hogan, 1998). Это указывает на то, что экспрессия Bmp4 в презумптивной хрусталиковой эктодерме не нужна для развития хрусталика. Однако, рекомбинантный Bmp4 недостаточен для восстановления образования хрусталика, когда презумптивная хрусталиковая эктодерма от нулевых мышей. Вместе эти данные указывают на то, что Bmp4 действует сочетанно с, по крайней мере, одним дополнительным сигналом. Интересно, что отсутствие Bmp4 не влияет на экспрессию Рах6, но предупреждает обычное усиление активности Sox2, Sry-родственного транскрипционного фактора, обычно экспрессирующегося в презумптивных хрусталике и сетчатке. Предполагается, что Bmp4 и Sox2 м. функционировать в параллельных ветвях пути индукции хрусталика (Рис. 2). Несмотря на перекрывающиеся паттерны экспрессии Bmp4 и Bmp7 м. выполнять не перекрывающиеся функции в раннем развитии глаз. Демонстрация, что Рах6 и Sox2 формируют комплекс в регуляции кристаллиновых генов (Kamachi et al., 2001) указывает на то, что эти пути м. комбинироваться, что регулировать поздние ступени дифференцировки клеток хрусталиковых волокон.
FGF receptor signaling is required for lens induction
Пути передачи сигналов Fgf выполняет важные функции на многих стадиях развития глаз. Напр., передача сигналов Fgf необходима и достаточна для дифференцировки клеток хрусталиковых волокон (McAvoy et al., 1991; 1999; Lang, McAvoy, 2003). Установлено, что активность Fgf рецепторов играет важную роль в индуктивной фазе развития хрусталиков.
Эксплантации зачатков глаз в присутствии низкомолекулярных ингибиторов активности рецепторной киназы Fgf снижает уровни Рах6 в хрусталиковой плакоде (Faber et al., 2001). Учитывая критическую hjm Hf[6 в развитии хрусталика, это указывает на то, что активность Fgf рецепторов находится иерархически выше и является фактором индукции хрусталиков. Когда доминантно-негативный FgfR1 экспрессируется в презумптивном хрусталике, то выявляются ранние дефекты в формировании хрусталиковой плакоды и в инвагинации хрусталиковой ямки. Важно, что уарони экспрессии Рах6 снижены (Faber et al.m 2001). Доказательства активности Fgf рецепторов в индукции хрусталиков получены и с помощью определения, м. ли Bmp7, известный индуктор хрусталика (Wawersik et al., 1999), кооперировать с активностью Fgf рецепторов. В самом деле, скрещивания между Bmp7 нулевыми (Dualey et al., 1995) и Tfr7/Tfr7 мышами (гомозиготы по трансгену, экспрессирующие доминантно-негативный FgfR1 в хрусталиковой плакоде) дают компаундный генотип с более тяжелыми дефектами развития хрусталиков (Faber et al., 2001). В частности, Tfr7/Tfr7, Bmp7+/- мыши обнаурживают очень маленькие хрусталиковые ямки и неспособны отделять и закрывать хрусталиковый пузырек. Кроме того уровни экспрессии Рах6 в хрусталиковой плакоде были самими низкими уровнями у Tfr7/Tfr7, Bmp7+/- мышей. Это указывает на то, что передача сигналов Bmp7 и Fgf рецепторов конвергирует выше, чтобы обеспечить полный уровень экспрессии Рах6 в фазе плакоды (Рис. 2). Пока не идентифицированы лиганды для Fgf рецепторов, необходимые для индукции хрусталиков.
Transcription factors genetically downstream of Pax6
FoxE3
FoxE3 является транскрипционным фактором класса forkhead? который у мышей обнаруживает ограниченную экспрессию в развивающейся нервной трубке и хрусталике (Blixt et al., 2000; Brownell et al., 2000). У людей мутации в FOXE3 ассоциируют с дисгенезом переднего сегмента глаз (Semina et al., 2001). У мышей экспрессия FoxE3 начинается на Е8.75 в презумптивной эктодерме хрусталика (Brownell etal., 2000) и представляет субдомен Рах6 позитивной презумптивной хрусталиковой эктодермы. Это совпадение доменов продолжается и на ст. Е9.5 (когда формируется хрусталиковая плакода) и на Е10.5, когда инвагинирует хрусталиковая ямка. Мыши dysgenetic lens (dyl), носители мутаций FoxE3 (Blixt et al., 2000; Brownell et al., 2000). Расширенный домен экспрессии Prox1 в хрусталиковом эпителии мышей FoxE3dyi/dyl подтверждает, что в этом месте FoxE3 является супрессором Prox1 (Рис. 3).
На фоне Pax6Sey/Sey экспрессия FoxE3 отсутствует, указывая тем самым, что FoxE3 находится генетически ниже Рах6 (Рис. 3) (Brownell et al., 2000). Гибридизация in situ FoxE3 у Pax6ΔEE/ΔEE эмбрионов ( которые несут гомозиготную делецию в энхансере ЕЕ) показала. что экспрессия FoxE3 необнаружима (Dimanlig et al., 2001). Это указывает на то, что FoxE3 локализуется ниже плакодной фазы экспрессии Рах6 в генетическом пути регуляции развития хрусталика (Рис. 2).
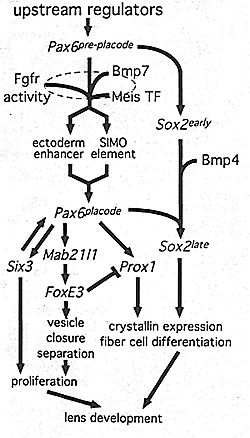 Fig. 3. An expanded model for the genetic pathways regulating lens induction. See fig. 2 for description of the central elements of this model Based on the absence of FoxE3 expression in mice carrying a deletion of the Pax6 ectoderm enhancer (Pax6ΔEE/ΔEE) FoxE3 is downstream of Pax6placode. The similar phenotypes {reduced lens lineage proliferation and lens vesicle closure and separation failure) of the dysgenetic lens (FoxE3) and Pax6ΔEE/ΔEE mutant mice argue that FoxE3 is upstream of these cellular responses. Similarly, the loss of FoxE3 expression in Mab21I1 mutant mice and the loss of Mab2111 expression in Pax6Sey/Seyy embryos suggests the Pax6-Mab21I1-FoxE3 gene order indicated. The homeodomain transcription factor Six3 lies genetically downstream of Pax6 placode as mice that do not express placodal Pax6 also do not express placodal Six3. This is also true for Proxi. Since FoxE3dyl/dyl mice show an expansion of the Proxi expression domain in the lens epithelium, this suggests that FoxE3 normally suppresses Proxi atlater stages of lens development In Pax6Sey/Sey embryos, Sox2 expression is not unregulated in the lens placode suggesting that the late phase of Sox2 expression is dependent on Pax6. Similarly, since Sox2 (but not PaxB) expression is notup-regulated in the lens placode of Bmp4 null mice, Bmp4 signaling likely contributes to the pathway between Sox2early and SOX2late. Fig. 3. An expanded model for the genetic pathways regulating lens induction. See fig. 2 for description of the central elements of this model Based on the absence of FoxE3 expression in mice carrying a deletion of the Pax6 ectoderm enhancer (Pax6ΔEE/ΔEE) FoxE3 is downstream of Pax6placode. The similar phenotypes {reduced lens lineage proliferation and lens vesicle closure and separation failure) of the dysgenetic lens (FoxE3) and Pax6ΔEE/ΔEE mutant mice argue that FoxE3 is upstream of these cellular responses. Similarly, the loss of FoxE3 expression in Mab21I1 mutant mice and the loss of Mab2111 expression in Pax6Sey/Seyy embryos suggests the Pax6-Mab21I1-FoxE3 gene order indicated. The homeodomain transcription factor Six3 lies genetically downstream of Pax6 placode as mice that do not express placodal Pax6 also do not express placodal Six3. This is also true for Proxi. Since FoxE3dyl/dyl mice show an expansion of the Proxi expression domain in the lens epithelium, this suggests that FoxE3 normally suppresses Proxi atlater stages of lens development In Pax6Sey/Sey embryos, Sox2 expression is not unregulated in the lens placode suggesting that the late phase of Sox2 expression is dependent on Pax6. Similarly, since Sox2 (but not PaxB) expression is notup-regulated in the lens placode of Bmp4 null mice, Bmp4 signaling likely contributes to the pathway between Sox2early and SOX2late.
Sox2
Возможно, что Bmp4 функционирует в индукции хрусталика на пути, который использует транскрипционный регулятор Sox2, HMG box транскрипционный фактор, родственный пол-детерминирующему фактору SRY (Kamachi et al., 1995). Sox2 и члены семейства Sox1 и Sox3 участвуют в развитии хрусталика, регулируя, как предполагается, кристаллиновые гены (Kamachi et al., 1995;1998). В частности Sox2?, как известно, регулирует экспрессию δ-кристаллинов у кур в комплексе с Рах6 (Kamachi et al., 2001). Т.о., наблюдения, что экспрессия Sox2 в хрусталиковой линии не усиливается как обычно у Bmp4 нулевых эмбрионов указывает на то, что Bmp4 стимулирует экспрессию Sox2 при подготовку регуляции кристаллиновых генов с помощью комплекса Sox2-Рах6 (Рис. 3). Это вместе с фактом, что Sox2 не усиливает свой активности, как обычно, у Pax6Sey/Sey эмбрионов (Furuta, Hogan, 1998) позволяет предположить , что Sox2 стоит ниже Pax6pre-placode и участвует с Bmp4 в предполагаемом параллельном пути (Рис. 3).
Mab21I1
Ген Mab21I1 мыши является ортологом mab-21 C.elegans (Mariani et al., 1998;1999; Yamada et al., 2003). Интересно, что у червей mab-21 находится на том же самом генетическом пути, что и mab-18, ортолог Рах6 позвоночных (Zhang, Emmons, 1995). Это подтверждает идею, что Рах6 и Mab21I1 м. участвовать в одном и том же онтогенетическом процессе, в зачатке глаз (в презумптивном хрусталике и сетчатке), начиная с ранних стадий развития (Mariani et al., 1998; Yamada et al., 2003). В частности Mab21I1 экспрессия усиливается приблизительно на ст. Е9.5, указывая тем самым, что она м.б. чувствительна к сигналам индукции хрусталика (Yamada et al., 2003).
Получение нулевых Mab21I1 мышей подтверждает, что Mab21I1 играет важную функциональную роль в развитии хрусталика. Нулевые Mab21I1 мыши обнаруживают дефекты развития хрусталиков (неспособность образования инвагинации хрусталиковой плакоды) на ст. Е9.5, что приводит к драматической микрофталмии (Yamada et al., 2003). Изучение экспрессии Mab21I1 у Pax6Sey/Sey мышей указывает на неспособность к нормальному усилению активности на ст Е9.5. Это указывает на то, что Mab21I1 иерархически стоит ниже Рах6. Детекция экспрессии FoxE3 и Рах6 у Mab21I1 нулевых мутантов указывает на то, что Рах6 экспрессия нормальна, а экспрессия FoxE3 отсутствует на ст. Е9.5 (Yamada et al., 2003). Всё это указывает на то. что Mab21I1 находится между плакодной фазой экспрессии Рах6 и FoxE3 в модели регуляции индукции хрусталика (Рис. 2). Этот анализ подтвердил, что имеется прямая аналогия между путем mab-21 - mab18 у червей и Pax6, Mab21I1 путем у мышей.
Six3
Six3 является членом six-гомоедоменового семейства с sine oculis Drosophila в качестве основателя. Six3 участвует в развитии хрусталика. У мышей Six3 экспрессируется в хрусталиковом эпителии во время ст. дифференцировки, но впервые экспрессируется в хрусталиковой плакоде (Oliver et al., 1995). У Medaka паттерн экспрессии несколько иной, он присутствует в презумптивной хрусталиковой эктодерме, но подавляется в хрусталиковой плакоде перед дифференцировкой хрусталика (Loosli et al., 1998). Т.к. у мышей, куриный Six3 экспрессируется в презумптивной хрусталиковой эктодерме и персистирует в хрусталиковой плакоде, а позднее локализуется в эпителии хрусталика (Bovolenta et al., 1998).
Функциональные доказательства вовлечения Six3 в индукцию хрусталика первоначально были получены в исследованиях по несответствующей экспрессии, в результате чего формировались эктопические хрусталики у Medaka. В противоположность Рах6-индуцированному формированию эктопических хрусталиков у Xenopus, Six3-индуцированные эктопические хрусталики, по-видимому, возникают как результат трансформации отического пузырька (Oliver et al., 1996) Кроме того, установлено, что Six3 м. управлять образованием эктопических хрусталиков клеточно неавтономным способом. Это привело авт. к предположению, что экспрессия в несоотв. месте Six3 м. индуцировать растворимый фактор, который меняет склонность отической плакоды в направлении приобретения судьбы хрусталика (Oliver et al., 1996).
Имеются доказательства, указывающие на то, что Six3 и Рах6 действительно активируются на транскрипционном уровне. Как упоминалось выше специфичная для хрусталиковой плакоды условная делеция floxed аллеля Рах6 вызывает неспособность развития хрусталика (Ashery -Padan et al., 2000)/ Установлено, что у этих животных экспрессия Six3 теряется. Более того, было показано, что трансген α-кристалинновый промотр- Six3 м. усиливать экспрессию Рах6 и устранять дефект хрусталиков, возникающие у мышей Pax6lacZ/+ (Goudreau et al., 2002). В комбинации с биохимическими экспериментами, показавшими, что связывающие Six3 сайты расположены в ЕЕ энхансере Рах6 и что сайты связывания Рах6 обнаруживаются в гене Six3 (Goudreau et al., 2002), всё это указывает на то, что Рах6 и Six3 действительно трансактивируются. Эта информация м.б. включена в генетическую модель индукции хрусталиков у мышей (Рис. 3). Прямая оценка роль Six3 в развитии хрусталика и его способности давать петлю позитивной обратной связи на Рах6 следует из условной делеции floxed аллеля в хрусталиковой плакоде.
Prox1
Prox1 является гомологом у позвоночных гена prospero Drosophila, который кодирует дивергентный гомеодоменовый белок (Tomarev et al., 1998). Он экспрессируется в презумптивном хрусталике и сетчатке мышей с ранних стадий развития. Получение Prox1 нулевых мышей показало, что что этот транскрипционный фактор является важным для дифференцировки клеток хрусталиковых волокон (Wigle et al., 1999). Интересно, что имеются доказательства на Drosophila и мышах (Duncan et al., 2002), что prospero и Prox1 меняют свою субклеточную локализацию на стадии развития, когда их активность критическая.
Удалось поместить Prox1 в модели генетической регуляции индукции хрусталика. Во-первых, было показано. что когда Рах6 условно делетируется из хрусталиковой плакоды, то экспрессия Prox1 в этом месте теряется (Ashery -Padan et al., 2000). Более того, у dysgenetic lens мышей, которые несут мутацию в FoxE3, экспрессия Prox1 в эпителии хрусталика активируется. Всё это указывает на то, что Prox1 располагается иерархически ниже Pax6placode и что FoxE3 обычно ответственен за супрессию экспрессии Prox1 (Рис. 3). Остается установить, представляют ли эти взаимодействия многие ступени или имеется возможность прямой регуляции транскрипции.
Speculation: is Pax6 auto-regulation the result of MAPK-mediated activation?
Установлено, что Рах6 авторегулируется. Мы предполагаем, что плакодная фаза экспрессии Рах6 зависит от функционального Рах6 белка в головной эктодерме (Рис. 2, 3). подтверждено, что генетические взаимоотношения м.б. результатом прямого регуляторного взаимодействия, при котором Рах6 соединяется с ЕЕ и активирует Рах6 (Aota et al., 2003). Доказательства этому получены в подходе со сдвигом мобильности, при котором посредством своего paired домена Рах6 м. соединяться специфически с ЕЕ последовательностями, и в экспериментах по трансфекции, в которых экспрессия ЕЕ-зависимой конструкции активируется с помощью Рах6 (Aota et al., 2003). Однако, если Pax6placode непосредственно регулируется с помощью Pax6pre-placode, то возникает проблема, как эти две фазы экспрессии всегда самостоятельны. Существуют две возможности, что уровень экспрессии отличен в этих двух фазах или что необходим еще один сигнал. Напр., без сомнения многие транскрипционные факторы м. функционировать кооперативно с Рах6 в ЕЕ ( возможно Meis белки, Sox2 или 3 и Six3).
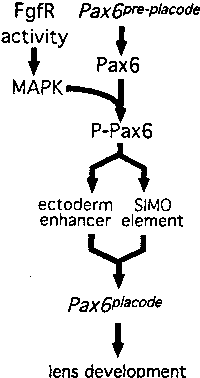 Fig. 4. Is Pax6 phosphorylation a step in lens induction?
Phosphoryiation of Pax6 by MAP kinase (MAPK) enhances transactivation. Since MAP kinases are downstream of Fgf receptors (FgfR) this raises the possibility that Pax6 phosphoryiation is an important step in Pax6 auto-regulation in the lens placode and therefore, lens development
Fig. 4. Is Pax6 phosphorylation a step in lens induction?
Phosphoryiation of Pax6 by MAP kinase (MAPK) enhances transactivation. Since MAP kinases are downstream of Fgf receptors (FgfR) this raises the possibility that Pax6 phosphoryiation is an important step in Pax6 auto-regulation in the lens placode and therefore, lens development
Однако, существует еще одна механистическая возможность, что Рах6 м.б. активирован пост-трансляционно (Mikkola et al., 1999). Трансактивационный домен Рах6 рыбок данио имеет серию потенциальных мест фосфорилирования. Из них серин 423 (Ser 413) эволюционно консервативен от морского ежа до человека. Интересно, что Ser 413 м.б. фосфорилирован in vitro с помощью mitogen fctivated protein kinases (MAPKs), extracellular-signal regulated kinase (ERK) и р38 киназы, но не Jun N-terminal kinase (JNK). Мутации в Ser 413, по-видимому. сходны с фосфорилированными остатками энхансеров в отношении трансактивационного потенциала Рах6. Сходным образом мутации Ser 413 ограничивают трансактивацию (Mikkola et al., 1999). Наконец, в клетках NIH3T3 м.б. показано, что фосфорилирование Ser 413 происходит в ответ на стимуляцию сывороткой, условием. которое активирует МАР киназу и что это фосфорилирование м.б. предотвращено с помощью ингибитора МАР киназы PD 98059.
Чётко было показано, что путь передачи сигналов Fgf необходим для индукции хрусталиков. Путь Fgf включается в качестве одной из сигнальных ветвей, в путь Ras-Raf-MAP kinase (Goldfarb, 2001). Вместе с наблюдением, что МАР киназа м. усиливать трансактивацию Рах6, м. предположить, что плакодная фаза экспрессии Рах6 является результатом обусловленной Fgf путь-МАР киназой активации Рах6, которая доступна с фазы Pax6pre-placode (Рис. 4). Это предположение целиком согласуется с генетическим анализом, указывающим на то. что Рах6 и Fgf пути конвергируют выше Pax6placode. Т.к. это м. объяснить все доступные данные, то осталось проверить это экспериментально.
Lens InductionHisato Kondoh  (Apr 2010) In: eLS. John Wiley & Sons Ltd, Chichester. http://www.els.net [doi: 10.1002/9780470015902.a0001142.pub2]

Рисунки к статье
Ткань хрусталика развивается из эмбриональной головной эктодермы посредством взаимодействия с зачатком сетчатки, зрительным пузырьком. Этот механизм развития служит в качестве примера эмбриональной тканевой индукции. Использование современной техники для генных манипуляций и мониторинга генной активности в развивающихся эмбриональных тканях было выявлено два механизма, зависимых от зрительного пузрька, которые лезат в основе процесса индукции хрусталика: локальная активация кооперативных транскрипционных факторов SOX2 (SRY-related-HMG-box 2) и PAX6 (paired box 6) в головной эктодерме; и элиминация влияния цефалической части нервного гребня, которое является ингибирующим для развития хрусталика. Индукция хрусталика, со своей стороны, влияет на развитие зрительного пузырька и организует оптический бокал с центральным положением хрусталика. Действие SOX2 и PAX6 является также общим для др. процессов, участвующих в генерации хрусталика, включая регенерацию хрусталика из дорсальной части радужки в глазу тритона и трансдифференцировку хрусталика из зачатка гипофиза, наблюдаемое у некоторых мутантных эмбрионов.
Продемонстрировано, что тканевая индукция является процессом образования новых типов клеток из ткани посредством взаимодействия с др. тканью.
Транскрипционные факторы являются белками, которые регулируют транскрипцию путем соединения с ген регулирующими регионами ДНК.
Сигнальные молекулы, которые часто являются белками, секретируются группой клеток, связываются рецепторами др. группы клеток и вызывают изменения в клетках, которые связывают молекулы.
|
Сайт создан в системе
uCoz Fig. 2. Inductive signals regulate Pax6 expression in presumptive tons: a genetic model. The arrows indicate genetic interactions except in the case of the Meis transcription factor-enhancer interactions. At the apex of the hierarchy is the pre-placodal phase of Pax6 expression (Pax6pre-piacode) It is understood that the later phase of Pax6 expression in the lens placode (Pax6placode) is dependent upon earlier activity of Pax6. Pax6placode is apparently regulated by at least two enhancers that are represented by the green vertical bars on the schematic of the Pax6 gene (exons, red vertical bars). One is the so-called ectoderm enhancer and the other the SIMO element that is located in the final intron of the adjacent gene, AK000505, that is transcribed in the opposite direction to Pax6. The Meis transcription factors (Meis TF) are likely to regulate the expression of Pax6 directly by binding to the ectoderm enhancer, and possibly to the SIMO element. Since both placodal Pax6 is reduced in mouse embryos that express a dominant-negative Fgf receptor in the lens lineage it is likely that Pax6placode is genetically downstream of Fgf receptor activity. Given that an even lower level of Pax6 can be recorded in embryos that express the dominant-negative Fgf receptor and have half the normal level of Bmp7, we can suggest thai Fgf receptor and Bmp7 signaling cooperate to maintain the placodal phase of Pax6 expression. Previous analysis has shown that the early phase of Pax6 expression is unaffected in the Bmp7 null mice and ihus, FGF and Bmp7 signaling must converge on the pathway downstream of Pax6pre-placode.
Fig. 2. Inductive signals regulate Pax6 expression in presumptive tons: a genetic model. The arrows indicate genetic interactions except in the case of the Meis transcription factor-enhancer interactions. At the apex of the hierarchy is the pre-placodal phase of Pax6 expression (Pax6pre-piacode) It is understood that the later phase of Pax6 expression in the lens placode (Pax6placode) is dependent upon earlier activity of Pax6. Pax6placode is apparently regulated by at least two enhancers that are represented by the green vertical bars on the schematic of the Pax6 gene (exons, red vertical bars). One is the so-called ectoderm enhancer and the other the SIMO element that is located in the final intron of the adjacent gene, AK000505, that is transcribed in the opposite direction to Pax6. The Meis transcription factors (Meis TF) are likely to regulate the expression of Pax6 directly by binding to the ectoderm enhancer, and possibly to the SIMO element. Since both placodal Pax6 is reduced in mouse embryos that express a dominant-negative Fgf receptor in the lens lineage it is likely that Pax6placode is genetically downstream of Fgf receptor activity. Given that an even lower level of Pax6 can be recorded in embryos that express the dominant-negative Fgf receptor and have half the normal level of Bmp7, we can suggest thai Fgf receptor and Bmp7 signaling cooperate to maintain the placodal phase of Pax6 expression. Previous analysis has shown that the early phase of Pax6 expression is unaffected in the Bmp7 null mice and ihus, FGF and Bmp7 signaling must converge on the pathway downstream of Pax6pre-placode.  Fig. 3. An expanded model for the genetic pathways regulating lens induction. See fig. 2 for description of the central elements of this model Based on the absence of FoxE3 expression in mice carrying a deletion of the Pax6 ectoderm enhancer (Pax6ΔEE/ΔEE) FoxE3 is downstream of Pax6placode. The similar phenotypes {reduced lens lineage proliferation and lens vesicle closure and separation failure) of the dysgenetic lens (FoxE3) and Pax6ΔEE/ΔEE mutant mice argue that FoxE3 is upstream of these cellular responses. Similarly, the loss of FoxE3 expression in Mab21I1 mutant mice and the loss of Mab2111 expression in Pax6Sey/Seyy embryos suggests the Pax6-Mab21I1-FoxE3 gene order indicated. The homeodomain transcription factor Six3 lies genetically downstream of Pax6 placode as mice that do not express placodal Pax6 also do not express placodal Six3. This is also true for Proxi. Since FoxE3dyl/dyl mice show an expansion of the Proxi expression domain in the lens epithelium, this suggests that FoxE3 normally suppresses Proxi atlater stages of lens development In Pax6Sey/Sey embryos, Sox2 expression is not unregulated in the lens placode suggesting that the late phase of Sox2 expression is dependent on Pax6. Similarly, since Sox2 (but not PaxB) expression is notup-regulated in the lens placode of Bmp4 null mice, Bmp4 signaling likely contributes to the pathway between Sox2early and SOX2late.
Fig. 3. An expanded model for the genetic pathways regulating lens induction. See fig. 2 for description of the central elements of this model Based on the absence of FoxE3 expression in mice carrying a deletion of the Pax6 ectoderm enhancer (Pax6ΔEE/ΔEE) FoxE3 is downstream of Pax6placode. The similar phenotypes {reduced lens lineage proliferation and lens vesicle closure and separation failure) of the dysgenetic lens (FoxE3) and Pax6ΔEE/ΔEE mutant mice argue that FoxE3 is upstream of these cellular responses. Similarly, the loss of FoxE3 expression in Mab21I1 mutant mice and the loss of Mab2111 expression in Pax6Sey/Seyy embryos suggests the Pax6-Mab21I1-FoxE3 gene order indicated. The homeodomain transcription factor Six3 lies genetically downstream of Pax6 placode as mice that do not express placodal Pax6 also do not express placodal Six3. This is also true for Proxi. Since FoxE3dyl/dyl mice show an expansion of the Proxi expression domain in the lens epithelium, this suggests that FoxE3 normally suppresses Proxi atlater stages of lens development In Pax6Sey/Sey embryos, Sox2 expression is not unregulated in the lens placode suggesting that the late phase of Sox2 expression is dependent on Pax6. Similarly, since Sox2 (but not PaxB) expression is notup-regulated in the lens placode of Bmp4 null mice, Bmp4 signaling likely contributes to the pathway between Sox2early and SOX2late.
 Fig. 4. Is Pax6 phosphorylation a step in lens induction?
Phosphoryiation of Pax6 by MAP kinase (MAPK) enhances transactivation. Since MAP kinases are downstream of Fgf receptors (FgfR) this raises the possibility that Pax6 phosphoryiation is an important step in Pax6 auto-regulation in the lens placode and therefore, lens development
Fig. 4. Is Pax6 phosphorylation a step in lens induction?
Phosphoryiation of Pax6 by MAP kinase (MAPK) enhances transactivation. Since MAP kinases are downstream of Fgf receptors (FgfR) this raises the possibility that Pax6 phosphoryiation is an important step in Pax6 auto-regulation in the lens placode and therefore, lens development