Помимо кристаллинов рах6 регулирует разнообразный спектр генов, включая транскрипционные регуляторы ( напр., Six 3, c-Maf, Prox1) (Ashery-Padan et al., 2000; Goudreau et al., 2002; Sakai et al., 2001) и специфические молекулы адгезии (напр., α5β1 интегрины, R-кадхерин и L1CAM (Duncan et al., 2000b; Simpson, Price, 2002; Andrews, Mastick, 2003). Paralemmin, molybdopterin, synthase sulfurylase, молекулы клеточной адгезии JAM1 и neogenin и транскрипционные факторы Brg1, Pitx3 и Etv6 - новые кандидаты на роль генов-мишеней , управляемых Рах6.
Кристаллины считаются водорастворимыми белками, экспрессируемые на высоком уровне в хрусталиках. Они подразделяются на два семейства: повсеместно-экспрессируемые кристаллины, представленные α- и βγ-семействами и taxon-специфические кристаллины, представленные белками только в хрусталиках специфических phyla животных. Большинство таксон-специфических кристаллинов обладает ферментативной активностью и названы энзиматическими кристаллинами. Два члена α-семейства, αA и αB, являются родственными структурно и функционально малым хитшоковым белкам (Horwitz, 2002; Bhat/ 2003). Экспрессия вне хрусталиков α-кристаллинов м. обеспечивать защиту от различных форм стрессов. Специфически, как было установлено, αB-кристаллины ингибируют как митохондриальные, так и death рецепторные про-апоптические пути (Kamradt et al., 2001). Напротив, 14 βγ-кристаллин, по-видимому, имеет удаленное сходство с др. белками. Роли βγ-кристаллинов вне хрусталиков еще предстоит определить. Большинство данных по регуляции генов базируются на исследованиях генов у мышей и кур. Однако, некоторые важные различия между хрусталиками мышей и кур кристаллинов указывают на молекулярные механизмы регуляции генов кристаллинов. Во-первых, семейство генов кристаллинов в хрусталиках мышей представлено кристаллинами αA, αB, γA-F, γS, βA1-4 и βB1-3/ Хрусталики кур не экспрессируют кластер γA-F кристаллинов или он отсутствует в геноме кур. В дополнение к γS-кристаллину хрусталики кур содержат два таксон-специфических δ1 и δ2-кристаллина. Во-вторых, δ1-кристаллин впервые появляется в хрусталиковой плакоде кур, сопровождаемый экспрессией β- и αA-кристаллинов на стадии хрусталикового пузырька. У мышей αB-кристаллин обнаруживается в хрусталиковой плакоде, к нему присоединяется αA-кристаллин во время перехода от хрусталиковой ямки к хрусталиковому пузырьку.
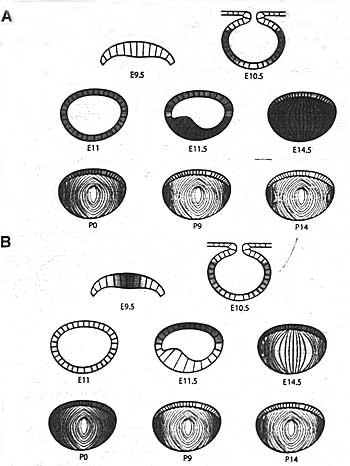 Fig.3. Schematic representation of transcript levels encoding αA- ana αB-crystallins in mouse embryonic, neonatal and postnatal lens. (A) Expression of αA-crystallin. (B) Expression αB-crystallin.
Fig.3. Schematic representation of transcript levels encoding αA- ana αB-crystallins in mouse embryonic, neonatal and postnatal lens. (A) Expression of αA-crystallin. (B) Expression αB-crystallin.
β- и γ-кристаллины экспрессируются на высоком уровне в дифференцированных клетках хрусталиковых волокон. В-третьих, регуляторные области мышиных и куриных кристаллинов менее эволюционно консервативны, чем ожидалось. Напр., область из 77 нуклеотидов выше ТАТА-бокс содержащих множественных
цис-действующих элементов мышиного α-кристаллина только на 63.3% законсервирована у мышей и кур. Тем не менее гены δ1- и δ2 кур были изучены на трансгенных мышах и обнаружили удивительно высокие уровни экспрессии в хрусталиках и низкий уровень экспрессии в сетчатке, роговице и мозжечке, воспроизводя экспрессию эндогенного δ-кристаллиновых генов у эмбрионов и взрослых кур. В др. исследованиях было подтверждено, что геномы мышей и кур м. содержать уникальные гены, регулирующие кристаллины, напр., L-Maf ген у кур. Установлено, что ген MafA мышей и человека является гомологом L-Maf (Benkhelifa et al., 2001; Olbrot et al., 2002; Kataoka et al., 2002). MafA/L-Maf имеют более широкие паттерны экспрессии у эмбрионов reh(Lecoin et al., 2004), распространяющиеся за пределы хрусталиков и головного мозга (Ogino, Yasuda, 1998).
Role of Pax6 in tissie-restricted and tissue-specific gene expression
Специфические гены регулируются за счет комбинации нескольких транскрипционных активаторов, ко-экспрессирующихся и присутствующих в активной форме в данной ткани. Экспрессия Рах6 существенна во всех тканях, формирующих глаз, переднем мозге и заднем мозге/мозжечке, спинном мозге, поджелудочной железе и гипофизе, указывая тем самым, что ряд ограниченных тканями факторов необходим для специфичной для хрусталиков экспрессии 15 генов кристаллинов. Сегодня известны регуляторные факторы для кристаллинов с ограниченным паттерном экспрессии, Рах6, с-Maf, MafA/L-Maf, MafB, NRL, Sox2, Sox1, RARβ/RXRβ, RORα, Prox1, Six3, γFBP-B и РЫА2 (Рис. 2). Эти факторы дифференциально экспрессируются в эпителиальных клетках хрусталика, первичных и вторичных хрусталиковых волокнах (Рис. 2А). Они отличаются по своему началу экспрессии в развивающемся хрусталике. Кроме того, некоторые регуляторные сайты в кристаллиновых промоторах м. взаимодействовать с повсеместно экспрессируемыми АР-1, CREB, TFIID и USF транскрипционными факторами (Рис. 2В). Некоторые из этих факторов (АР-1 и USF) регулируются с помощью окислительно-восстановительного потенциала в клетке, клетки хрусталиков, как известно, обладают высоко reducing средой. Регуляция ткане-специфической и ткане-предпочтительной экспрессией с помощью Рах6 в др. глазных и не глазных тканях следует тому же самому комбинационному принципу. Партнеры Рах6 м. включать те же самые или отличающиеся транскрипционные факторы, подобно АР-2α в регуляции промотора gelatinase B в эпителии роговицы (Sivak et al., 2004).
Эти специфические ДНК-связывающие транскрипционные активаторы собираются в ансамбли на кристаллиновых промоторах и на более дистальных регуляторных областях и выполняют ряд специфических ролей. Их две первичные функции заключаются в преодолении репрессивного влияния хроматина и в рекрутировании общих транскрипционных факторов, включая РНК полимеразу II . В некоторых случаях они также противодействуют действию повсеместно или ткане-специфически экспрессирующихся репрессорных молекул, включая γFBP-B и δEF1. Хроматином обусловленная репрессия транскрипции облегчается с помощью обратимого ацетилирования и метилирования гистоновых хвостов за счет ремоделирования хроматина и/или с помощью устранения нуклеосом. Экспериментальные доказательства подтверждают, что общий ко-активатор CBP/p300 (Рис. 2А) обладающий histone acetylase activity (HAT) участвует в экспрессии кристаллиновых генов (Chen et al., 2002). Экспрессия фактора, ре-модулирующего хроматин, Brg1, каталитической субъединицы комплекса SWI/SNF млекопитающих, выявлена в хрусталиках эмбрионов и новорожденных (Chauhan et al., 2002c). ASC-2? наз. также AIB3, TRBP, RAP250, NRC и PRIP (Рис. 2А), являются ко-активаторами, взаимодействующими с histone H3-lysine 4-specific methyltransferase, а её функция необходима также
in vivo для αA-, γВ- и γF-кристаллинов (Kim et al., 2002). Некоторые из ДНК-связывающих факторов, напр., Prox1, м. регулироваться на уровне ядерно/цитоплазматической локализации. Наконец, дифференцировка клеток хрусталиковых волокон запускается за счет выхода из клеточных циклов, это регулируется с помощью ретинобластомного белка pRb (Рис. 2В) вместе с ДНК-связывающим фактором из семейства E2F. Отсуствие экспрессии pRb в хрусталиках нарушает дифференцировку клеток хрусталиковых волокон и экспрессию кристаллиновых генов. Наконец, некоторые из этих специфических ДНК-связывающих транскрипционных факторов связаны с путями специфической передачи сигналов (FGF, TGFβ и BMP), которые контролируют развитие хрусталиков и дифференцировку клеток хрусталиковых волокон (Beebe et al., 2004; Chen et al., 2004). Экспериментальные данные подтверждают фосфорилирование MafA и Рах6.
Regulation of crystallin gene expression by Pax6 in combination with a small family of specific transcription factors in ocular lens
Кристаллины стали первыми известными генами, регулируемыми Рах6 (Cvekl, Piatigorsky, 1996). C того времени выявлена сложная регуляция кристаллиновых генов у позвоночных (Duncan et al., 2004). Установлено, что ген РахВ медузы является родоначальным геном, регулирующим экспрессию промотора J3-кристаллина беспозвоночных (Kozmik et al., 2003; Piatigirsky and Kozmik, 2004). До сих пор мы не имеет полного представления обо всех аспектах регуляции генов кристаллинов у позвоночных. Было установлено: 1. геномная организация кристаллиновых локусов, которые находятся в определенной геномной области, достаточна для управления экспрессией эндогенных генов на уровне, сравнимом с эндогенными генами, управляемыми у трансгенных животных. 2. Идентификация регуляторных областей генов и их роль в в эмбриональном, неонатальном и взрослом хрусталике. Эти области контролируют ткане-специфичность, временной и пространственный паттерн экспрессии и количественные аспекты экспрессии. 3. Выявление этих регионов в индивидуальные
цис-регуляторные элементы и выявление их роли. 4. Идентификация полного набора транскрипционных активаторов и репрессоров, взаимодействующих с
цис-элементами. 5. Характеристика процессов ремоделирования хроматина, ассоциированных с активацией и репрессией кристаллиновых генов. 6. Выявление количественных аспектов транскрипции кристаллиновых генов, связанная с измерениями оборота мРНК кристаллинов и детерминацией количеств мРНК на эпителиальную и хрусталикового волокна клетку. 7. Идентификация и вычленение путей сигнальной трансдукции в клетках хрусталиков и их ассоциации с экспрессией кристаллиновых генов. Здесь мы рассмотрим механизмы транскрипционной регуляции αA, αB, γF- и ζ-кристаллинов.
Мышиный αA-кристаллин преимущественно экспрессируется в хрусталике. Однако, иммунологические исследования выявили белок в низких количествах в тимусе, селезенке, мозжечке, коже, тонком кишечнике, печени и почках крыс. Значительная экспрессия αA-кристаллина выявлена в сетчатке мышей (ганглиолярные клетки, наружный и внутренний слой фоторецепторов (Li et al., 2003). При гибридизации
in situ (Рис. 3А) выявлена транскрипция αA-кристаллина в хрусталиковой ямке 10-10.5-дневных эмбрионов мыши в равных количествах в передней и задней части хрусталикового пузырька.
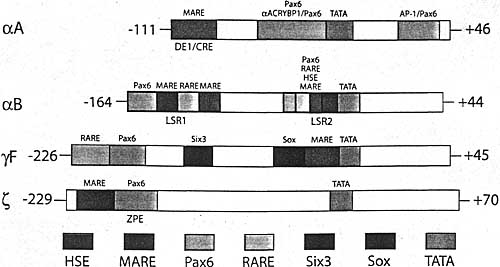 Fig4. Diagrammatic representation of four crystallin promoters/enhancers and their regulatory sites and factors. The numbering corresponds to the mouse αA-, αB- and γF-, together with guinea pig ζ-crystallin promoter fragments. Thr regions are not shown to scale.
Fig4. Diagrammatic representation of four crystallin promoters/enhancers and their regulatory sites and factors. The numbering corresponds to the mouse αA-, αB- and γF-, together with guinea pig ζ-crystallin promoter fragments. Thr regions are not shown to scale.
С началом дифференцировки клеток хрусталиковых волокон на ст. Е11.5 мышей удлиняющиеся клетки задней части хрусталика увеличивают экспрессию этого гена. М. существовать координация между увеличением экспрессии αA-кристаллина и путями сигнальной трансдукции, запускающими дифференцировку клеток волокон (Beebe et al., 2004; Chen et al., 2004). Задние клетки хрусталикового пузырька подвергаются воздействию разных ростовых факторов, включая членов семейств FGF и TGFβ/BMP, и сигнального пути Wnt/β-catenin, исходящих от развивающейся сетчатки. Механизм не известен, но возможны два варианта. Первая возможность рассматривает последовательное воздействие; ростовые факторы вынуждают клетки дифференцироваться посредством циклинов и и модулирующих их киназ, что д. сопровождатьcя полной активацией транскрипционной кухни, отвечающей за транскрипцию кристаллиновых генов. Вторая возможность допускает параллельные эффекты ростовых факторов на регуляторные компоненты ленточного цикла и транскрипционную кухню.
Когда клетки первичных хрусталиковых волокон достигают переднего эпителия, то эмбриональный хрусталик считается сформированным. Параллельно формируется передняя камера, т.к. радужка образуется из периферического края оптического бокала (Cvekl, Tamm, 2004). Образование радужки разделяет полость между хрусталиком и роговицей на переднюю и заднюю камеры и м. приводить в результате к перераспределению градиентов ростовых факторов и к созданию митотической зоны в области экватора хрусталика. Эпителиальные клетки хрусталика в экваториальной области подвергаются терминальной дифференцировке, обусловленной их экспозицией специфическими сигналами к дифференцировке. В результате хрусталик продолжает рост путем добавления новых слоёв "вторичных" хрусталиковых волокон в экваториальной области хрусталика. Во вторичных волокнах транскрипты αA-кристаллин экспрессируются на высоком уровне в течение всего оставшегося развития хрусталика и у взрослых.
Регуляция гена αA-кристаллина мышей на уровне промотора была изучена в системах культивирования хрусталиков и на трансгенных мышах (Bhat, 2003; Duncan et al., 2004). Трансгенные исследования показали, что фрагменты промотора мышиного αA-кристаллина от позиций -366, -111 и -88 до +46 слиты с репортерным геном chloramphenicol acetyltransferase (CAT), все они были высоко активными в клетках хрусталиковых волокон. Эти трансгены обнаруживали изменчивость экспрессии уровня 3-х порядков величин из-за расположения и количества копий. Множественные сравнения геномных последовательностей мышей, человека, крыс, хомячков и кур, содержащих ген αA-кристаллина, выявили эволюционно консервативные области, это указывает на возможность того, что эти 5' и 3' области содержат новые удаленные контролирующие области (Cvekl et al.,2002).
Сайты, связывающие транскрипционные факторы в промоторе гена αA-кристаллина мышей, были идентифицированы в виде двух областей, 13 п.н
цис-элемент -110 по -98 и область в 48 п.н. между -87 и -40. Первая область содержала сайт MARE для большого количества членов семейства Maf, т.е. c-Maf (Ring et al., 2000), перекрывающейся функционально с cAMP responsive element (CRE). Соединение транскрипционных факторов с областью -87 -40 менее изучено. Выявлены взаимодействия с ядерными белками. Первым идентифицированным белком, соединяющимся
in vitro с этой областью, был повсеместно экспрессирующийся large zinc finger транскрипционный фактор αA-CRYBP1/PRDII-BFI/MBP-1. Сайт связывания Рах6 был найден выше ТАТА-бокса, а сайт связывания АР-1 расположен ниже ТАТА-бокса. Данные для установления специфического действия Рах6, крупных Maf белков, αA-CRYBP1 и АР-1 факторов
in vivo сегодня доступны только для с-Maf. Исследования с-Maf нулевых мышей показали достоверно уменьшение транскриптов αA-кристаллина, что было связано с присутствием MARE (-110 -98) в промоторе (Табл. 1). Однако делеции и мутагенез этого сайта не устраняли хрусталик-специфической экспрессии у трансгенных мышей. Или разные крупные Maf белки, напр., MafA и NRL, м.б. вовлечены в этот процесс или др. MARE сайт м. существовать внутри фрагмента от -88 до +46 или новый дистантный контролирующий регион. DNase I footprinting эксперименты с использованием Рах6 белка показали присутствие двух дополнительных связывающих сайтов внутри фрагмента -111 по +46 и, по крайней мере, один вышестоящий связывающий сайт (Cvekl et al., 2002).
Имеющиеся данные позволяют предположить сл. модель. Относительно низкая экспрессия гена αA-кристаллина в хрусталиковой ямке и хрусталиковом пузырьке обусловливается транскрипционными факторами в эпителии хрусталика, включая Рах6 и MafB, с возможной ролью и др. факторов, включая CREB. В дифференцирующихся хрусталиковых волокнах MafB замещается MafA, c-Maf и NRL с постепенным подавлением Рах6 (Lecoin et al., 2004) в результате происходит существенное усиление активности гена αA-кристаллина. Рекрутирование ко-активаторов CBP/p300 с помощью ДНК-связывающего фактора с-Maf и скорее всего др. крупных Maf факторов и Рах6 обеспечивает связь между активацией и репрессией локуса αA-кристаллина на уровне хроматина. Интересно, что ASC-2 нулевые хрусталики обнаруживают пониженную экспрессию αA-, но не αB-кристаллина (Табл.1). ASC-2 является транскрипционным фактором, который функционирует в хрусталике (Kim et al., 2002).
Хотя αВ-кристаллин, подобно αA-кристаллину, преимущественно экспрессируется в хрусталиках, его экспрессия вне хрусталиков достигает значительного уровня в сердце, скелетных мышцах и лёгких и ощутимая экспрессия обнаруживается в головном мозге и почках. Кроме того, αВ-кристаллин экспрессируется также в роговице, цилиарном теле, зрительном нерве, extraocular мышце и трабекулрной сети. Выявлена специфическая экспрессия αВ-кристаллина в сетчатке мышей. Экспрессия αВ-кристаллин обнаружена в ганглиолярных клетках, внутреннем и наружном слоях фоторецепторов и пигментном эпителии сетчатки (Li et al., 2003). Гибридизация
in situ (Рис. 3D) выявила транскрипцию αВ-кристаллина в хрусталиковой плакоде у Е9.5 эмбрионов мышей с одинаковым уровнем экспрессии в передней и задней части хрусталикового пузырька на ст. Е10.5-11. На последующих стадиях развития транскрипты αВ-кристаллин более многочисленны в хрусталиком эпителии по сравнению с αА-кристаллином (Рис. 3). Экспрессия αВ-кристаллина увеличивается в дифференцирующихся первичных хрусталиковых волокнах, а также во вторичных хрусталиковых волокнах. Его экспрессия в хрусталиковом эпителии персистирует дольше, чем экспрессия αА-кристаллина.
Трансгенные исследования гена αВ-кристаллина выявили фрагмент в 4 т.п.н. 5' фланкирующих последовательностей гена αВ-кристаллина мыши, слитый с lac Z репортерным геном, который достаточен для воспроизведения онтогенетического паттерна эндогенного гена. Промоторные фрагменты от -164 и - 115 до +44 быди достаточны, чтобы активировать экспрессию репортера САТ в трансгенных хрусталиках. Напротив фрагмент -68 +44 оказался неактивным. Эффект от позиции и количества копий указывает на то, что дополнительные регуляторные области необходимы. Две регуляторные области, LSR1 и LSR2 обнаружены в 5'-фланкирующей области (Рис. 4). Оба элемента содержат Рах6-сайт и RAREs. LSR1 содержит также два предполагаемых MAREs (Chauhan et al., 2004b; Yang et al,2004). LSR2 содержит также Рах6 сайт, перекрывающийся с предполагаемым MARE и heat shock responsive element (HSE)/ Подтверждена роль Рах6 и с-Maf в транскрипционной регуляции локуса αВ-кристаллина (Табл.1). И Рах6 гетерозиготные и с-Maf гомозиготные хрусталики содержат пониженные количества транскриптов αВ-кристаллина. Регуляция αВ-кристаллина с помощью RARβ/RXRβ м. функционировать между Е9.5 и Е12.5, т.к. передача сигналов ретиноевой кислоты и ретиноидов теряется в хрусталиках после Е12.5 и это зависит от Рах6 (Enwright, Grainger, 2000).
Интересно, что локусы αВ-кристаллинов млекопитающих содержат ген HspB2, кодирующий белок, структурно сходный с αВ-кристаллином. Транскрипция этог гена, хотя и не обнаружена в хрусталике, инициируется в положении -940 относительно стартовой точки транскрипции αВ-кристаллина мыши и в противоположном направлении. Т.к. αВ-кристаллин содержит энхансер (-427 по -255 MLH энхансер), активирующий его экспрессию в хрусталиковых и не хрусталиковых тканях ( напр., скелетных мышцах и сердце), то было бы интересно определить, как этот "энхансер" оперирует с αВ-кристаллиновым промотором. Выявлена направленность MHL энхансера и предположено существование геномного пограничного элемента, инсулятора (Swamynathan, Piatigorsky, 2002).
Изучение транскрипционного контроля 7 γ-кристаллиновых генов млекопитающих в основном концентрировалось на регуляции γF-кристаллина. Выявлена экспрессия некоторых членов βγ-кристаллинов в эпителии хрусталика, в разных клетках сетчатки, в головном мозге и семенниках (Magabo et al., 2000). У млекопитающих γ-кристаллиновые гены экспрессировались на высоком уровне в дифференцирующихся первичных волокнах. Геномный фрагмент от -759 по +45 мышиного γF-кристаллина слитый с
lacZ в основном воспроизводит экспрессию эндогенного гена. Более короткие фрагменты -171 по +45 и -67 по +45 экспрессируются в центральных хрусталиковых волокнах. Идентифицированы две энхансер-подобные области, -392 по -278 и -226 по -121 и несколько
цис-элементов в области -67 по +45. Чувствительный к ретиноевой кислоте элемент RARE выявлен в области -210 по -190 для взаимодействия с RARβ/RXRβ гетеродимеров, и родственный рецептору ретиноевой кислоты орфановый ядерный рецептор RORα . Рядом с RARE найдены сайты для связывания Рах6 и Рах6(5а); связывание Рах6 для индуцированной ретиноевой кислотой активации γF-промотора (Kralova et al., 2002; Chauhan et al,m 2004b). Сайт связывания рецептора, способного взаимодействовать с Six3, найден между промотором и сайтом связывания Рах6 (Lengler et al., 2001). Репрессия промотора γF-кристаллина с помощью Six3 скорее всего обусловлена привлечением транскрипционного ко-репрессора Grg4 и Grg5 (Zhu et al., 2002). Возможно, что ранняя экспрессия Рах6 и Six3 ингибируют экспрессию промотора γF-кристаллина, это опосредуется с помощью Sox1/2 и крупных Maf белков (Civil et al., 2002), взаимодействующих с тандемом из соседствующих связывающих сайтов 5'-ее от ТАТА-бокса (Yang et al., 2004). И Sox1 и с-Maf нулевые хрусталики почти лишены транскриптов γF-кристаллина (Табл. 1).
| |
|
Table 1
SUMMARY OF DIFFERENTIALLY EXPRESSED CRYSTALLINS IN LENSES OF LOSS-OF-FUNCTION AND TRANSGENIC MODELS
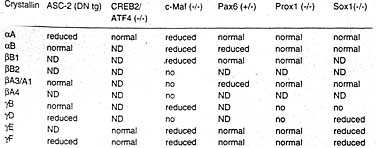
ВТ tg, dominant negatives transgenics; +/-, heterozygous lenses; ND, not determined
|
Хотя гомология последовательностей между 7 γ-кристаллиновыми генами указывает на то, что они скорее всего регулируются с помощью общих факторов, но Prox1 нулевые хрусталики (Табл.1) содержат только редуцированные количесива γB- и γВ-кристаллинов, но не γE- и γF-кристаллины.
Наконец, изучение экспрессии гена энзима ζ-кристаллина выявило хрусталик-специфическую 5'-фланкирующую область, которая, по-видимому, содержит только одиночный сайт связывания Рах6. Мутагенез этого сайта связывания устранял хрусталик-специфическую экспрессию у трансгенных мышей. Др. важный регуляторный сайт - это MARE, непосредственно выше Рах6-связывающего сайта (ZPE), функционально взаимодействует с крупным Maf белком, NRL и вообще с крупными Mafs. У морской свинки ζ-кристаллин отличается от мышиного гомолога в геномной области, укрывающей MARE и Рах6 сайт, которая, по-видимому, вставлена в результате инсерции транспозона между двумя повторами в 9 п.н.
Molecular interactions of Pax6 provides clues into tissue-specific roles of Pax6
Ткане-специфическое действие Рах6 зависит от комбинации, по крайней мере, двух принципов. Регуляторные области промоторов кристаллинов организованы в виде последовательностей специфических сайтов связывания, иногда с использованием повторяющихся мотивов, чтобы усилить строгость регуляции. В ряде промоторов кристаллинов, включая мышиные αB- и куриные βB1-кристаллины, Рах6-связывающие сайты перекрываются с MAREs (Chahan et al., 2004b; Cai et al., 2004; Yang et al., 2004). Каждый из αB-кристаллиновых LSR1 и LSR2 содержит сайт связывания Рах6 , MARE и RARE. Куриный δ1-кристаллиновый "core" энхансер содержит, по крайней мере, три Рах6 связывающих сайта (Muta et al., 2002), прерванных, по крайней мере, одним Sox-связывающим сайтом (Kamachi et al., 2001). Соседний и/или перекрывающийся сайт связывания для Рах6, крупных Maf белков и др. белков, указывает на образование непосредственных межбелковых взаимодействий между этими ДНК-связывающими транскрипционными факторами. Изучение этих взаимодействий в хрусталиковый и др. клетках, экспрессирующих Рах6, выявили большое количество белков, взаимодействующих с Рах6. Биохимически подтверждены прямые межбелковые взаимодействия между Рах6 и Cdx-2/3 в β-клетках поджелудочной железы, обеспечиваемые с помощью р300, между Рах6 и Sox2 в клетках хрусталиков, Рах6 и с-Maf в β-клетках панкреас, Рах6 и MITF в нейросетчатке, Рах6 и pRb в хрусталиках, Рах6 и ЕАШШВ в хрусталиках и Рах6 и АР-2α в эпителии роговицы. Кроме того, Рах6 HD способен функционально взаимодействовать с рядом HD-содержащих белков, экспрессирующихся вместе с Рах6 в глазных и не глазных тканях, включая Six3, Lhx2, Chx10, Prox1, Optx2/Six6, Msx2 и Otx2 (Mikkola et al., 2001a; Chauhan et al., 2004b).
Идентификация транскрипционный факторов, не связывающихся с ДНК, включая транскрипционные ко-активаторы и комплексы, ремоделирующих хроматин, взаимодействующие с Рах6, крупными Maf и др. белками в хрусталиках, нуждается в особом внимании. Ко-активаторы CBP/p300 непосредственно соединяются с с-Maf, тем самым открывается возможность образования четвертичных Pax6/p300/c-Maf комплексов, сходных с комплексами Pax6/Cdx2/p300, обнаруженными в β-клетках поджелудочной железы. Функциональные данные подтверждают прямое или непрямое взаимодействие между Рах6 и ядерными рецепторами ретиноевой кислоты RARβ и RXRβ, Pax6 и Рах6(5а) и белками Рах6 с MafA/c-Maf (Рис. 5).
Полученные данные демонстрируют, что Рах6 регулирует экспрессию широкого спектра специфических ДНК-связывающих транскрипционных факторов (напр., Six3, Pax2, Prox1, c-Maf, MafA, FoxE3, ngn2, Mash1 и Mash5), формируя функциональные комплексы с некоторыми из них (напр., с -Maf и MafA), авторегулируя свой собственный промотор в хрусталиковом клоне, контролируя передачу сигналов ретиноевой кислоты в эмбриональном хрусталике и контролируя экспрессию компонентов путей передачи сигналов, включая α5β1 интегрины и Necab. Т.о., Рах6 участвует в деликатной сети процессов на множественных генетических и биохимических уровнях (Рис. 5В). Т.к. развитие хрусталика и экспрессия специфических кристаллиновых генов, включая αB-кристаллины, чувствительные к дозе гена Рах6, то дальнейшие исследования молекулярных механизмов экспрессии генов кристаллинов в нормальных и аномальных хрусталиках позволят лучше понять заболевания у людей, вызываемые мутациями в локусе РАХ6.
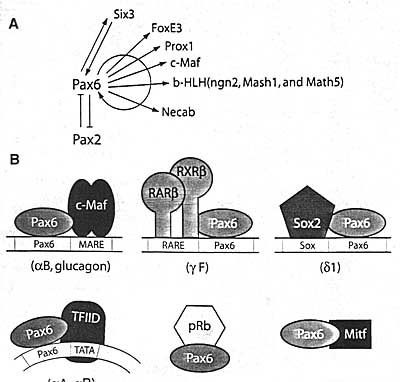 Fig.5. Pax6 regulates transcription of a variety of DNA-binding transcription factors and some of these biochemically interact with Pax6 proteins. (A) A summary of currently known genes encoding specific DNA-binding transcription factors regulated by Pax6/ (B) Protein-protein contacts between Pax6 and other transcription factors important in gene regulation by Pax6.
Fig.5. Pax6 regulates transcription of a variety of DNA-binding transcription factors and some of these biochemically interact with Pax6 proteins. (A) A summary of currently known genes encoding specific DNA-binding transcription factors regulated by Pax6/ (B) Protein-protein contacts between Pax6 and other transcription factors important in gene regulation by Pax6.
Interactiond between Pax6 и retinoblastoma protein pRb
Используя синхронизированную культуру мышиных αTN4-1 хрусталиковых клеток было установлено образование Pax6/pRb комплексов, чувствительных у клеточному циклу, т.к. его образование отмечалось во время фазы G1 клеточного цикла. Было также установлено, что Рах6 HD вносит существенный структурный вклад во взаимодействие. Др. Рах белки Рах3 и Рах5/BSAP, также связывают pRb. Используя мышиный фрагмент промотора αA-кристаллина -111 по +46, содержащий, по крайней мере один сайт связывания Рах (Рис. 4). Синтетический промотор, управляемый 4 E2F связывающими сайтами выше Е4 ТАТА-бокса (Рис. 6А) использовали в качестве позитивного контроля репрессии pRb. Ко-трансфекция мышиного αA-кристаллинового промотора с РАХ6 давало 3.3-кратное увеличение активации, тогда как ко-трансфекция с pRb не влияла на активность промотора в С-33А клетках, дефицитных по эндогенному pRb и Рах6. Ко-трансфекция РАХ6 с pRb давала дозово-зависимую репрессию транскрипции. Эти результаты были подтверждены прямой идентификацией специфических комплексов их РАХ6 и гипофосфорилированного pRb. Затем сходные исследования были проведены с 7 мутантными РАХ6 белками человека (Chauhan et al., 2004a). 5 из этих мутаций содержали одиночные аминокислотные замены, а 2 были нонсенс-мутациями. Они д. укладываться аномально и это д.б. влиять на чувствительность ассоциации с др. белками, напр., pRb. Было установлено, что специфические РАХ6 мутации, а именно G64V, R317X, R26G, R242T, теряют свою способность быть репрессированными с помощью pRb. Исход эксперимента зависел от последовательности добавления Рах6 и pRb. Когда Рах6 первым связывался с ДНК, то pRb не м. ни формировать четвертичного комплекса - ДНК/Рах6/pRb - ни разрушать бинарный комплекс ДНК-Рах6. Итак, полученные данные указывают на то, что уровень экспрессии Рах6 генов мишеней м.б. модулирован за счёт взаимодействий Рах6 с pRb, ключевым регулятором кухни клеточного цикла. Предполагается. что некоторые Рах6 гены мишени м. регулироваться в зависимости от клеточного цикла. Т.к. pRb существенен для терминальной дифференцировки
in vivo клеток хрусталиковых волокон, то перекрещивание Рах6- и pRb-зависимых путей д. пролить новый свет на процессы формирования хрусталика и регуляции генов кристаллинов.
Concluding remarks
Although molecular studies to understand lens-preferred expression of crystaHin genes, including the mechanism of their temporal and spatial patterns of expression, have been performed for more then two decades, we are just beginning to reveal the details of these processes. Ultimately, studies aimed to elucidate external signals triggering fiber cell differentiation have to merge with nuclear studies addressing the structural/functional organization of individual crystaHin loci and the identification of specific DNA-binding proteins associated with promoters, enhancers and other regulatory regions (i.e. silencers and insulators). Another important aspect of crystaHin gene regulation is to understand which co-activators and chromatin remodeling complexes are recruited by specific DNA-binding factors to regulate crystaHin promoters. Some of the factors presently known (Pax6, c-Maf, MafA/L-Maf, MafB, NRL, Sox2, Sox1, RAR(3/RXRp, RORa, Proxi, Six3, γFBP-B, HSF2, AP-1, CREB, TFIID and USF) are the ultimate downstream targets of signaling pathways active in lens cells (e.g. c-Maf), while the activities of some of these factors (e.g. AP-1 and USF) are regulated by the redox state of the cell. Co-activators CBP/p300 and ASC-2 regulate specific gene activity at the chromatin level and pRb may regulate accessibility and activity of Pax6 and other DNA-binding factors. Availability of innovative genetic and biochemical tools to further dissect lens differentiation will result in understanding the temporally and spatially regulated expression of diverse crystallin genes ib the embryonic, neonatal and adult lens at the molecular level.
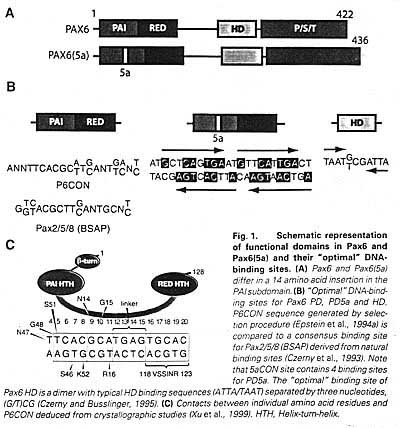
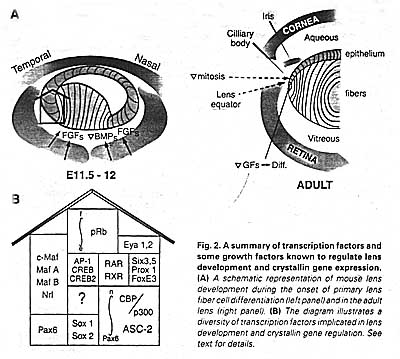
 Fig.3. Schematic representation of transcript levels encoding αA- ana αB-crystallins in mouse embryonic, neonatal and postnatal lens. (A) Expression of αA-crystallin. (B) Expression αB-crystallin.
Fig.3. Schematic representation of transcript levels encoding αA- ana αB-crystallins in mouse embryonic, neonatal and postnatal lens. (A) Expression of αA-crystallin. (B) Expression αB-crystallin.  Fig4. Diagrammatic representation of four crystallin promoters/enhancers and their regulatory sites and factors. The numbering corresponds to the mouse αA-, αB- and γF-, together with guinea pig ζ-crystallin promoter fragments. Thr regions are not shown to scale.
Fig4. Diagrammatic representation of four crystallin promoters/enhancers and their regulatory sites and factors. The numbering corresponds to the mouse αA-, αB- and γF-, together with guinea pig ζ-crystallin promoter fragments. Thr regions are not shown to scale. 
 Fig.5. Pax6 regulates transcription of a variety of DNA-binding transcription factors and some of these biochemically interact with Pax6 proteins. (A) A summary of currently known genes encoding specific DNA-binding transcription factors regulated by Pax6/ (B) Protein-protein contacts between Pax6 and other transcription factors important in gene regulation by Pax6.
Fig.5. Pax6 regulates transcription of a variety of DNA-binding transcription factors and some of these biochemically interact with Pax6 proteins. (A) A summary of currently known genes encoding specific DNA-binding transcription factors regulated by Pax6/ (B) Protein-protein contacts between Pax6 and other transcription factors important in gene regulation by Pax6.