Полученные результаты демонстрируют также, что LTi клетки взаимодействуют с и активируют мезенхимные клетки, присутствующие в зачатках лимфатических узлов и Пейеровых бляшек, как это было предположено ранее
. Мы достигали активации мезенхимы с помощью экспрессии адгезивных молекул ICAM-1 и VCAM-1. У E16.5 плодов эти молекулы экспрессировались на высоком уровне только в зачатках лимфатических узлов и Пейеровых бляшек, а также в тимусе и селезенке, что согласуется с центральной функцией этих адгезивных молекул в развитии лимфатических узлов и Пейеровых бляшек. Пороговое количество LTi клеток необходимо для этого процесса, что возможно отражает 'community effect' образующих кластеры LTi клеток
.
Мезенхимные клетки экспрессируют LTβR
11, тогда как LTi клетки экспрессируют их лиганды, члены LTα1β2 (refs. 3,5). Существенная функция взаимодействия LTα1β2-LTβR в развитии лимфатических узлов и Пейеровых бляшек была продемонстрирована отсутствием лимфатических узлов и Пейеровых бляшек у LTα-дефицитных мышей
13. Развитие лимфатических узлов и пейеровых бляшек может быть восстановлено у LTα-дефицитных мышей путем воздействия на эмбрионов агонистом mAb к LTβR
12. Однако, обработка RORγt-дефицитных мышей с помощью этих mAb не восстанавливала развитие лимфатических узлов и Пейеровых бляшек. Сходным образом, агонист mAb не восстанавливал развития лимфатических узлов у TRANCE-дефицитных мышей, а трансгенная экспрессия TRANCE (в клетках, отличных от LTi клеток) не восстанавливала развитие лимфатических узлов у LTα-дефицитных мышей
6. Эти данные показывают, что функция клеток LTi в индукции развития лимфатических узлов и Пейеровых бляшек не ограничивается предоставлением LTα1β2 для активации мезенхимы. Др. факторы, экспрессируемые LTi клетками, такие как TRANCE
33, может быть необходимым арсеналом из факторов, продуцируемых с помощью LTi клеток во время развития лимфатических узлов. Т.к. TRANCE не участвует в развитии Пейеровых бляшек, то дополнительные факторы, предоставляемые LTi клетками, ещё предстоит определить. Зачатки могут быть результатом активного рекрутирования циркулирующих в крови клеток или благодаря экспансии резидентных LTi клеток или CD45+ клеток предшественников. В пользу первой возможности мы нашли, что клетки LTi не пролиферируют и только редкие гематопоэтические клетки пролиферируют в зачатках лимфатических узлов и Пейеровых бляшек. Кроме того, IL-7Rβ, TRANCE, TNF-R-I и BLC (CXCL13) участвуют в раннем рекрутировании LTi клеток в зачатки лимфатических узлов и Пейеровых бляшек. Индивидуальная функция каждого из этих факторов не очевидна, а недавние сообщения показали, что BCL (CXCL13) формирует перекрывающуюся систему с IL-7Rβ и CCR7 для развития определенных лимфатических узлов
27,38. Рекрутированию LTi клеток в зачатки лимфатических узлов и Пейровых бляшек м. способствовать позитивная петля обратной связи, генерируемая с помощью активации мезенхимы LTi клетками посредством LTα1β2-LTβR взаимодействия
39.
Ligation LTβR индуцирует экспрессию ряда хемокинов в эмбриональных фибробластах и в B клетках, включая, BLC (CXCL13), ELC (CCL19) и SLC (CCL21)
40,41. BLC и ELC экспрессируются также ICAM-1+ VCAM-1+
мезенхимными клетками в зачатках Пейеровых бляшек
11 Кроме того, рецепторы для BLC (CXCR5) и ELC и SLC (CCR7) экспрессируются LTi клетками и передают хемотактические сигналы в LTi кдетки
in vitro11. LTi клетки могут , следовательно, мигрировать в зачатки лимфатических узлов и Пейеровы бляшки в ответ на базовые уровни экспрессии хемокинов мезенхимных клеток и цитокины. Следовательно, LTi клетки активируют мезенхиму посредством LTα1β2-LTβR взаимодействия, индуцируя дальнейшую экспрессию хемокинов и увеличивая рекрутирование LTi клеток. Однако, если даже мезенхима зачатков лимфатических узлов и Пейеровых бляшек не способна активироваться в LTα-дефицитных плодах, количество присутствующих LTi клеток не меняется. Это указывает на то, что позитивная петля обратной связи может оперировать эффективно только на поздних стадиях развития лимфатических узлов и Пейеровых бляшек; т.е. после E16.5. На этой стадии может присутствовать пороговое количество LTi клеток, способное создавать 'community effect' и индуцировать активацию мезенхимы. LTα1β2-LTβR взаимодействие, по-видимому, также необходимо для продолжительного рекрутирования или выживания LTi клеток в зачатках лимфатических узлов, т.к. немного LTi клеток обнаруживается при рождении в зачатках лимфатических узлов LTα-дефицитных мышей
33.
В заключение, ядерные гормональные рецепторы RORγt предопределяют границы с помощью своей экспрессии одиночных популяций плодных клеток, LTi клеток. Функция RORγt в генерации LTi клеток неизвестна. Предыдущие находки по рекрутированию RORγt в дважды позитивные тимоциты указывают на то, что они могут контролировать выживаемость LTi клеток19. Однако, форсирование экспрессии анти-апоптического белка Bcl-xL на месте RORγt не способно восстанавливать генерацию LTi клеток (данные не показаны). Это может быть использовано для идентификации мишеней для RORγt d LTi клетках. Анализ таких генов позволит пролить свет на механизмы развития лимфатических узлов и Пейеровых бляшек.
Сайт создан в системе
uCoz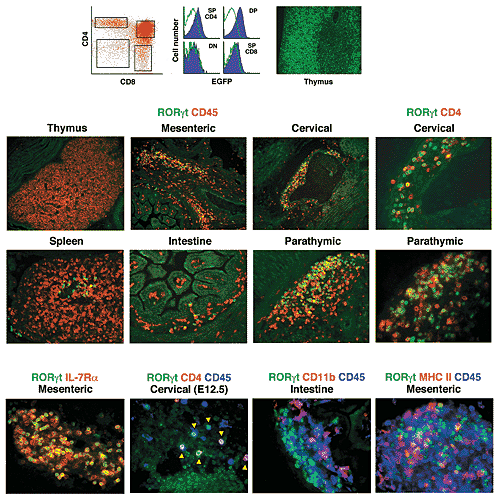 Figure 1. In the fetus, RORγt is exclusively expressed in LTi cells. (a) Left: CD4 and CD8 expression in thymocytes from 6- to 8-week-old Rorc(γt)+/GFP mice.
Boxed areas indicate cell populations analyzed for EGFP expression. Center: blue histograms, thymocytes from Rorc(γt)+/GFP
mice; green lines, thymocytes from Rorc(γt)+/+
mice. SP, single-positive; DP, double-positive; DN, double-negative. Right: staining of Rorc(γt)+/GFP thymus with anti-EGFP. Cortex and medulla were defined by nuclear DAPI staining (data not shown). Data are representative of at least five independent experiments. (b–f) Sections from whole Rorc(γt)+/GFP fetuses at age E16.5 (b–
d,f) or E12.5 (e) were stained as indicated by color of lettering above sections. Thymus, spleen, intestine and lymph node anlagen in designated regions are shown here. Green autofluorescence was used to visualize tissue structure. Arrowheads in e point to EGFP+ cells. Pink cells in f are stained for both red (CD11b or MHC class II) and blue (CD45). Original magnifications:b, x100 (top) and x200 (bottom); c–f, x400.
Sections are representative of at least ten individual sections and three to ten independent experiments.
Figure 1. In the fetus, RORγt is exclusively expressed in LTi cells. (a) Left: CD4 and CD8 expression in thymocytes from 6- to 8-week-old Rorc(γt)+/GFP mice.
Boxed areas indicate cell populations analyzed for EGFP expression. Center: blue histograms, thymocytes from Rorc(γt)+/GFP
mice; green lines, thymocytes from Rorc(γt)+/+
mice. SP, single-positive; DP, double-positive; DN, double-negative. Right: staining of Rorc(γt)+/GFP thymus with anti-EGFP. Cortex and medulla were defined by nuclear DAPI staining (data not shown). Data are representative of at least five independent experiments. (b–f) Sections from whole Rorc(γt)+/GFP fetuses at age E16.5 (b–
d,f) or E12.5 (e) were stained as indicated by color of lettering above sections. Thymus, spleen, intestine and lymph node anlagen in designated regions are shown here. Green autofluorescence was used to visualize tissue structure. Arrowheads in e point to EGFP+ cells. Pink cells in f are stained for both red (CD11b or MHC class II) and blue (CD45). Original magnifications:b, x100 (top) and x200 (bottom); c–f, x400.
Sections are representative of at least ten individual sections and three to ten independent experiments.