Предпринята попытка выявления генов-мишеней, дифференциально регулируемых или в кровеносных или лимфатических эндотелиальных клетках путём анализа массивов. Было установлено, что в самом деле специфические генные профили ассоциируют или с кровеносными или лимфатическими эндотелиальными клетками (17). Более того, кровеносные эндотелиальные клетки, которые заставили избыточно экспрессировать
переключали свою молекулярную signature на ту, что более подходящая для лимфатического профиля (17,18). Более того анализ
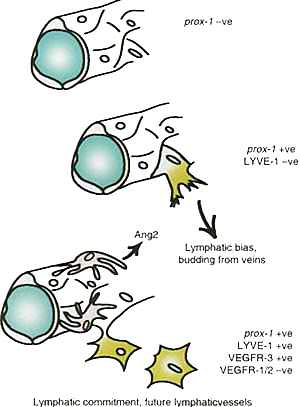
-нулевых мышей выявил, что преждевременно арестованные лимфатические эндотелиальные клетки, которые присутствовали, не экспрессировали лимфатических маркёров, таких как VEGFR-3, SLC, LYVE-1 (Рис. 2) (19). Имеющиеся данные указывают на то, что распространение лимфатического эндотелия у взрослых осуществляется из предсуществующих лимфатических сосудов (20), поэтому представленные выше данные указывают на потенциал генетического репрограммирования терминально дифференцированных кровеносных эндотелиальных клеток.
VEGFR-3 один из первых молекулярных идентифицированных маркёров, специфически экспрессирующихся во взрослом лимфатическом эндотелии. Ранняя онтогенетическая экспрессия маркёров VEGFR-3 м.б. выявлена действительно во всех эндотелиальных клетках; однако, по ходу развития паттерн его экспрессии становится всё более ограниченным отпочковывающимися лимфатическими сосудами. Его лиганд VEGF-C/D экспрессируется в соседней ткани, указывая на паракринный способ передачи сигналов (21,22). Сегодня значительное количество мышиных моделей разработано для выяснения роли VEGFR системы в лимфатическом развитии. Важность активности VEGFR-3 демонстрируется на примере
Chy мышей (23). Фенотип
Chy характеризуется накоплением chylous ascites и отёками нижних конечностей в результате гетерозиготной инактивирующей мутации с киназном домене (24), по механизму, сходному с таковым при болезни Milroy's (25,39). Избыточная экспрессия VEGF-C в кератиноцитах, управляемого
К-14 промотором, индуцирует лимфатическую гиперплазию (26), а аденовирусом обусловленная экспрессия VEGF-C в ушах мышей вызывает лимфангиогенез, подтверждая роль VEGFR-3 в лимфатическом развитии (27). Учитывая, что VEGF-C м. также ассоциировать с VEGFR-2, специфическая роль VEGFR-3 в развитии лимфатической системы характеризована с использованием созданных мутантов VEGF-C, которые ассоциируют только с VEGFR-3 (VEGF-C156S). Было установлено, VEGFR-3 м. независимо обеспечивать лимфангиогенную. пролиферацию (28). Важно, что
К-14 VEGF-C156S:Chy мыши, обнаруживают в результате нормализацию Chy фенотипа (24), подтверждая, что VEGFR-3 возможно м. ослаблять лимфатическую дисфункцию при болезни, подобной Milroy. В согласии с этим и трансгенные мыши, экспрессирующие растворимую форму VEGFR-3, слитую с IgG-Fc доменом, причем она м. действовать как ловушка, когда экспрессируется в коже мышей, индуцируя lymphedema (29). Предполагается, что
К-14 VEGFR-3-Fc трансгенный фенотип, подобно Chy мышам, воспроизводит патологию, наблюдаемую при б-ни Milroy (30), характеризуясь лимфатическим отёком конечностей, повышенным накоплением жидкости и дермальным фиброзом. Разработка и дальнейшая характеристика этих мышиных моделей м. играть важную роль в терапии соотв. лимфатических заболеваний.
Сходные результаты наблюдаются с VEGF-D, трансгенная избыточная экспрессия этого лиганда. управляемого К-14 промотором вызывает лимфатическую гиперплазию (28). Недавно аденовирусный перенос VEGF-D в скелетные мышцы задних конечностей кроликов вызывал строгую лимфангиогенную реакцию (31). Однако, в роговице кроликов эта методика избыточной экспрессии лиганда вызывала гиперплазию кровеносного эндотелия (32), указывая тем самым, что множественные факторы, зависимые от лиганда, и клеточный контекст специфически модулируют биологическую реакцию на VEGF-D.
FOXC2
Классифицированное как первичное лимфатическое нарушение, аутосмоно-доминантно наследуемое lymphedema distichiasis (LD), характеризуется лимфатическими отёками нижних конечностей, ассоциируемой с осложнениями, такими как расщепление нёба, кардиальные и глазные аномалии. Картирование хромосомной области, ассоциированной с LD, связано с транслокацией t(Y;16)(q11.2;q24.3), при которой точка разрыва приходится на хромосому 16. Дальнейший анализ выявил область в 20 kb, которая ассоциирует с LD (33). В этой области один из генов winged helix forkhead транскрипционный фактор FOXC2, затрагивается рядом мутаций. которые нарушают его функцию (34,35). Идентифицировано более 30 мутаций в FOXC2, большинство из них даёт укороченный белок в результате преждевременного окончания транскрипции. Важно, что генетические нарушения FOXC2 у мышей вызывают ряд фенотипов, отражающих патологию у человека (36-38), однако, помимо лимфатического отёка, ничто др. не воспроизводится у модельных мышей. Гетерозиготные FOXC2 мыши обнаруживают ряд едва заметных дефектов, соответствующих дефектам лимфатических сосудов, таким как lymphatic endothelium и lymph node hyperplasia, retrograde движение лимфы и черепно-лицевые и глазные дефекты (36). Таким мыши рассматриваются как модель LD (36); однако, учитывая различия в тяжести лимфатических отёков конечностей, м. думать, что др. факторы м. играть роль в предеопределении этой б-ни у людей. Возможно, что общие физиологические различия ,между людьми и мышами м. объяснить эти различия или что молекулярные повреждения в FOXC2 м. генерировать доминантно негативные эффекты, которые м. сопровождать фенотипические проявления у людей по сравнению с мышами.
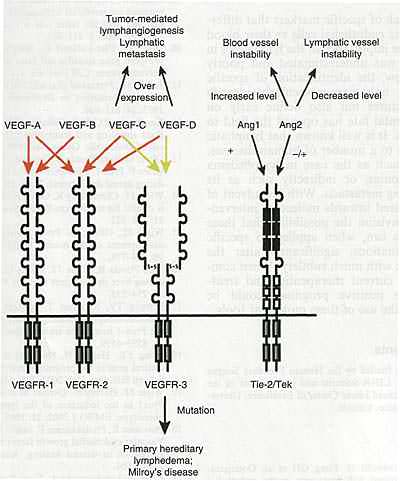
Fig. 3. Molecular mechanisms involved in lymphangiogenesis and disease. Blood and lymphatic vessel development requires the coordinated efforts of two receptor systems, the VEGFR and Tie-2/Tek receptor tyrosine kinases. Their activation by specific ligands leads to downstream cascades critical for normal development. A number of human diseases have been found to involve the deregulation of normal lymphatic function, leading to lymphedema, lymphangiomas, or metastasis. Significantly, some of these pathologies are linked to the known molecular pathways that regulate lymphangiogenesis. Mutations in the VEGFR-3 receptor are found to correlate with Milroy's disease. Mutations in the transcription factor I OXC2 (not shown) was found to correlate with lymphedemia distichiasis. Overexpression of ligands VEGF-C/D and Ang2 has been found to augment metastatic progression in a number of mouse models, while loss of function mutations of Ang2 in mice leads to the arrest of lymphatic development, resulting in immature lymphatics postnatally. While the complete picture is still unclear, the implicitly understood balance between ligand and receptor function within these two systems suggests the possibility of manipulating the balance between ligand and receptor in order to alleviate a number of human pathologies associated with the lymphatic system.
Lymphatics and disease
Lymphedema
Т.к. инициация лимфатических отёков хорошо охарактеризована на клиническом уровне, но молекулярные механизмы, связанные с прогрессированием лимфатической болезни, всё ещё неясны. Лимфатический отёк характеризуется или как первичный или как вторичный, первый ассоциирует с неопределенными ещё генетическими изменениями, ведущими к неправильной регуляции лимфатической функции. Второй ассоциирован с физическими альтерациями, вызванными такими событиями как радиационная терапия, хирургия, травма и инфекция. Две первичные lymphatic б-ни, Milroy's disease и LD, имеют четко определенные молекулярные повреждения. Болезнь Milroy's в некоторых семьях ассоциирована с дисрегуляцией VEGFR-3. VEGFR-3 миссенс мутации идентифицированы внутри каталитической петли киназной области (39) в результате чего снижается аутофосфорилирование рецептора, ингибируется активность рецепторов и уменьшается передача сигналов (40). LD ассоциирует с геном FOXC2, который страдает от множественный инсерций и делеций, ведущих к дефектам связывания ДНК и активации транскрипции (41). Молекулярная роль FOXC2 в передаче лимфатических сигналов неясна; однако, внутри др. систем, таких как инсулиновыми рецепторами и Shh-обусловленная передача сигналов, FOXC2, по-видимому, передаёт сигналы посредством цАМФ-РКА пути и модулирует Tbx1 транскрипционную трансактивацию, соотв. (42,43).
Cancer and metastasis
Очевидно, что опухолевые клетки из первичного места своего возникновения, достигннув лимфатических сосудов, транспортируются ко вторичным местам. Сегодня неясно, играют ли внутри-опухолевые лимфатические сосуды в противоположность около-опухолевым более важную роль в обсеменении опухолевыми клетками. Некоторые полагают, что внутри-опухолевые лимфатические сосуды не играют роль в потенциировании метастазов (44,45) из-за высокого давления. обнаруживаемого внутри опухоли (46). У экспериментальных мышиных моделей найдено, что опухоли содержат повышенные уровни VEGF-C и обладают высокой метастатической способностью, но не метастазируют посредством внутри-опухолевых лимфатических сосудов, т.к. эти внутренние структуры нефункциональны по сравнению с сосудами, окружающими опухоль (47). Напротив, детальный анализ лимфатических структур из сквамозных клеток карциномы головы и шеи человека показывает, что внутри-опухолевые лимфатические сосуды играют существенную роль в предопределении появления рецидивов, тяжести болезни и чувствительности к терапии (48,49). Присутствие внутри-опухолевых лимфатических сосудов создаёт прямую дорогу опухолевым клеткам для достижения удаленных мест.; однако присутствие около-опухолевых лимфатических сосудов столь же эффективно м. служить для их транспорта. Они менее подвержены стрессам, сдавливанию и обеспечивают больший объём тока (50). Более того, клеточный перенос между лимфатическими и кровеносными сосудами является общераспространённым феноменом (51); , следовательно, присутствие или отсутствие внутри-опухолевых сосудов м. не быть критическим для метастазирования с помощью лимфатических сосудов.
Накапливаются доказательства в пользу эффекта VEGFR-3/VEGF-C/D системы рецептор-лиганд в лимфангиогенезе и раке. В самом деле, эта система обнаруживается во многих первичных опухолях у людей с высокой степенью агрессивности в отношении вторичных мест (52-56). Т.к. роль VEGF-C установлена в качестве индуктора лимфангиогенеза, но прямые доказательства его роли в способствовании метастазированию неочевидны. Наконец, трансгенные мыши, экспрессирующие VEGF-C в β-клетках, управляемый rat insulin promotor (Rip), скрещивались с Rip-SV40 T-antigen мышами, у которых возникали панкреатические опухоли, которые были не матастазируемыми. Определенно присутствие VEGF-C способствовало увеличению лимфатических сосудов вокруг первичных опухолей и соотв. увеличению склонности Tag-экспрессирующих β-клеток к метастазированию в лимфатические узлы, подтверждая, что VEGF-C м. способствовать течению лимфы (extravasation) ко вторичным местам (57). Сходные результаты наблюдались на xenograft моделях, когда избыточная экспрессия лигандов VEFG-C и VEGF-D вызывала увеличение лимфангиогенеза в окружающей опухоли массе, а также увеличение метастазирования (58, 59). Это также указывает на то, что метастазирование м.б. обеспечено лимфатическими сосудами, окружающими опухоль. Однако, всё ещё неизвестно, могут ли VEGF-С/D вызывать сходные реакции при озлокачествлении и у людей.
Potential therapeutics
Современный клинический режим лечения лимфатических отёков связан с контролем осложнений: подниманием ног, применением давления, контроль инфекции, диуретики, лимфо-венозным шунтированием и удалением ткани (60). Основным при лечении опухолей является хирургическое вмешательство, облучение и химиотерапия. Разрабатываются пути лечения, нацеленные на специфические молекулярные пути.
Динамику лимфангиогенеза м. представить себе как баланс между присутствием и отсутствием специфических рецепторов, лигандов или внутриклеточных сигнальных молекул. Уменьшение передачи сигналов VEGFR-3 м. транслироваться в снижение лимфатического развития, напр., такого как это наблюдается при б-ни Milroy's. Напротив, высокие уровни VEGF-3 или его лигандов м. индуцировать гиперпролиферацию лимфатических сосудов, это м. приводить или к формированию доброкачественных опухолей, таких как лимфангиомы или злокачественных опухолей, таких как лимфангиосаркомы. Косвенно опухоли, которые продуцируют высокие уровни VEGF и/или VEGFR-3 на клеточной поверхности, коррелируют с метастазированием посредством лимфатических сосудов (52,54,55). Xenograft животные модели подтверждают активную роль опухолевых клеток в обеспечении метастазирования посредством лимфатических сосудов (58,59,61,62) (Рис. 3).
Усиление передачи сигналов VEGFR клинически м. оказаться благоприятным в случае Milroy's б-ни, LD, или рака молочных желез, когда возможны пост-оперативные лимфатические осложнения после удаления лимфатических узлов, дренирующих грудь. В самом деле, введение VEGF-C демонстрировало усиление лимфангиогенеза с ослаблением лимфатических отёков в двух животных моделях (24, 63). Экспериментально подтверждена возможность индуцированных лимфатических сосудов соединяться и расти в функциональные соединяющие структуры протоков (64); этот процесс м.б. усилен добавлением VEGF-C/D. Вышеприведенная возможность м.б. более проблематичной, учитывая, что VEGF-C также м. усиливать ангиогенез (65). Наконец, использование специфических мутантов VEGF-C, таких как VEGF-C156S? для усиления передачи сигналов VEGFR-3 м. оказаться клинически оправданным (66). Клинически пока неясно, как эндогенная лимфатическая система будет реагировать, если манипулировать уровнями лигандов или рецепторов. Напр., эксперименты указывают, что избыточная экспрессия VEGFR-3-Fc вызывает регрессию сосудов в ткани одного типа, тогда как не оказывает воздействия на др., это необходимо учитывать при разработке оптимальной терапии (29). Напротив, ослабление передачи сигналов VEGFR в ситуациях, таких как рак, чтобы ингибировать распространение опухолевых клеток посредством лимфатических сосудов. Молекулярные инструменты, такие как растворимый внеклеточный домен VEGFR-3, действующий как западня для рецепторов (61), нейтрализация рецепторов с помощью моноклональных антител к VEGFR-3 и/или VEGF-C/D (58,67) или ингибирование киназной активности рецепторов (68,69) м. стать способом лечения лимфатических болезней.
Сайт создан в системе
uCoz