Dynamics of nuclear pore complex organization through
the cell cycle Current Opinion in Cell Biology 2004, 16:314321 | |
|
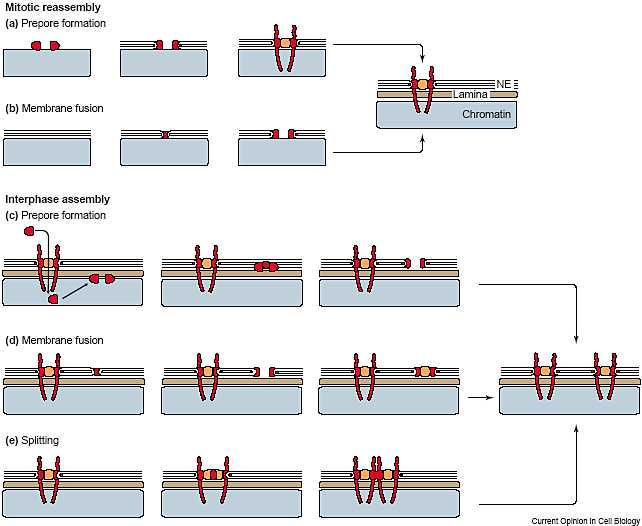
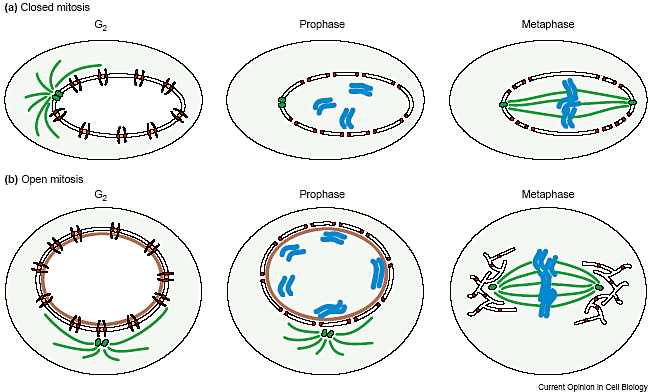
In eukaryotic cells, all macromolecules that traffic between the nucleus and the cytoplasm cross the double nuclear membrane through nuclear pore complexes (NPCs). NPCs are elaborate gateways that allow ef.cient, yet selective, translocation of many different macromolecules. Their protein composition has been elucidated, but how exactly these nucleoporins come together to form the pore is largely unknown. Recent data suggest that NPCs are composed of an extremely stable scaffold on which more dynamic, exchangeable parts are assembled. These could be targets for molecular rearrangements that change nuclear pore transport properties and, ultimately, the state of the cell.
 Рис.1. | Ядерные поры  Рис.2. | Транспорт рибосом | |