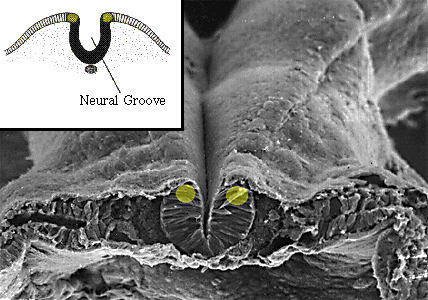
В точности неизвестно, как N-терминальная область Slug и Snail м. функционировать в качестве специфической доминантно негативной мутации. Хотя высоко дивергентные по своим N-концам Slug и Snail оба имеют SNAG мотив, домен репрессии транскрипции, который, как полагают, функционирует путём поставки активности гистоновой деацетилазы (Nakayama et al., 1998; Peinado et al., 2004). Интересно, что хотя домен SNAG законсервирован среди всех членов семейства Snail у позвоночных, он отсутствует в Snail у дрозофил и асцидий. Вместо этого коротко-действующая транскрипционная репрессивная активность Snail дрозофилы обеспечивается посредством рекрутирования транскрипционного ко-репрессора CtBP (Nibu et al.,, 1998) и это же верно и для Snail асцидий. Т.о., приобретение домена SNAG представляется важным событием в эволюции НГ. Несмотря на тот факт, что клетки дефинитивного НГ уникальны для позвоночных, одиночный гомолог
обнаружен у беспозвоночных хордовых, таких как асцидии и amphioxus, который также экспрессируется в развивающихся нейральных складках, напоминая экспрессиию, обнаруживаемую у позвоночных (Рис. 3) (Corbo et al., 1997; Langeland et al., 1998). Это указывает на то, что НГ м. произойти как популяция Snail-экспрессируемых клеток внутри нервной трубки у общих родоначальников современных позвоночных (Baker, Bronner-Fraser, 1997). Потребность в функции Slug/Snail во время формирования предшественников НГ, следовательно, отражает исходную роль, выполняемую Snail в дорсальной части нервной трубки родоначальных предпозвоночных хордовых. Эти клетки смогли затем приобрести миграторную способность, вообще-то вследствие появления дополнительных мишеней для Snail-обусловленной репрессии транскрипции. Миграторная способность позволила этим клеткам диспергировать по всему эмбриону и в обязательном порядке привела к возникновению новых производных, включая те, которые стали формировать "new head" позвоночных (Northcutt, Gans, 1983).
В самом деле, отдельно от их роли в формировании клеток предшественников НГ, Snail-родственные факторы, как было показано, играют существенную роль в начале миграции НГ у эмбрионов птиц и
Xenopus (Nieto et al.,, 1994; Carl et al., 1999; La Bonne, Bronner-Fraser, 2000). Интересно, что экспрессия
Slug и/или
Snail ассоциирует с рядом типов эмбриональных клеток, не происходящих из НГ, которые также подвергаются ЕМТ, включая мезодерму во время гаструляции (Nieto et al., 1994). Было также установлено, что экспрессия
Snail в линиях эпителиальных клеток достаточна для индукции этик клеток к ЕМТ и приобретению инвазивных свойств (Cano et al., 2000). Эта находка подтверждает, что роль в обеспечении EMTs является законсервированной функцией Slug/Snail. Более того, Snail участвует в приобретении инвазивности во время прогрессии опухолей; хотя экспрессия
Snail не обнаруживается в хорошо дифференцированных неинвазивных карциномах, этот фактор строго экспрессируется в большинстве инвазивных карцином, а также в ряде мышиных и метастатических человечьих линиях карциномных клеток (Batlle et al., 2000; Cano et al., 2000; Blanco et al., 2002).
E-Cadherin участвует в качестве ключевой мишени для Snail репрессии во время EMTs. В согласии с этим
Snail экспрессия обратным образом коррелирует с экспрессией
E-Cadherin в линиях опухолевых клеток (Batlle et al., 2000; Cano et al., 2000). Мишени для Slug- и Snail-обусловленной репрессии во время формирования НГ, ещё не идентифицированы, хотя считается, что они д. функционировании как репрессоры, чтобы оказывать позитивный эффект на экспрессию др. ранних маркёров НГ.
Group У Sox Factors
Идентифицированы два Sox семейства , Sox9 и Sox10? в качестве ранних регуляторов формирования предшественников НГ у
Xenopus (Spokony et al., 2002; Aoki et al., 2003; Honore et al., 2003). Вместе с Sox8, который участвует в развитии НГ в др. системах (Bell et al., 2000; Sock et al., 2001), эти факторы представляют собой подгруппу Sox "E" (Bowles et al., 2000). Белки семейства Sox, каждый из которых содержит в 79-аминокислот high mobility group (HMG)- типа ДНК-связывающий домен, в дальнейшем были подразделены на группы A-J на базе гомологии последовательностей. В дополнение к HMG домену Sox8-10 содержат С-терминальный активационный домен (Kamachi et al., 2000). и два домена, законсервированные среди членов группы Е, которые участвуют в в межбелковых взаимодействиях (Bowles et al., 2000). HMG домены разных Sox белков имеют довольно сходные ДНК-связывающие свойства
in vitro, их консенсусные связывающие последовательности состоят из стрежневого элемента в 6 п.н.
А/
Т А/
Т САА
А/
Т (Harley, Goodfellow, 1994; Bell et al., 1997; Bridgewater et al., 1998). Однако, было предположено, что
in vivo Sox белки м.б. не способны формировать стабильные комплексы белок-ДНК сами по себе, а вместо этого нуждаются в присутствии фактора-партнёра (Kamachi et al., 2000). Разные Sox белки, по-видимому, используют самостоятельных партнёров для связывания ДНК и один и тот же Sox белок м. использовать разных партнёров в разных типах клеток. Интересно, что Sox10 обнаруживается в кооперации с Рах3 при регуляции как MITF промотора во время формирования меланоцитов (Bondurand et al., 2000), так и с-RET промотора во время формирования энтерических ганглиев (Lang et al., 2000) Область Sox10 , которая обеспечивает взаимодействие с Рах3, законсервирована среди белков группы Е Sox, указывая тем самым, что это м. б. модуль межбелкового взаимодействия (Bondurand et al., 2000). Т.к. сигналы Wnt также непосредственно необходимы для транскрипции с промотора MITF, то экспрессия
Sox10 клетками предшественниками НГ в ответ на обусловленный Wnt индуктивный сигнал д.б., следовательно, одним из способов, с помощью которого реакция этих клеток на последующее воздействие Wnt м.б. изменена.
У
Xenopus экспрессия Sox9 в областях, формирующих НГ, м.б. выявлена на ст. 12, приблизительно в то же время, когда начинается экспрессия
Slug в этой области (Spokony et al., 2002). Напротив, экспрессия Sox10 в областях, формирующих НГ, не выявляется до стадии 14. На ст. 15 и Sox9 и Sox10 строго экспрессируются во всех краниальных предшественниках НГ и начинают экспрессироваться в областях спинного мозга (Spokony et al., 2002; Aoki et al., 2003; Honore et al., 2003). Относительное время экспрессии этих двух факторов законсервировано у эмбрионов птиц (Cheung, Briscoe, 2003). У
Xenopus эти два фактора в дальнейшем отличаются на ст. нейрулы тем, что экспрессия Sox9, но не Sox10 наблюдается в отических пузырьках (Spokony et al., 2002; Aopki et al., 2003; Honore et al., 2003), хотя позднее оба фактора экспрессируются в развивающемся ухе. Интересно, что т.к.
Sox9 и Sox10 оба первоначально экспрессируются во всех предшественниках НГ, затем они всегда оказываются ограниченными отдельными субнаборами производных НГ, экспрессия
Sox10 обнаруживается прежде всего в меланобластах и глие, а
Sox9 в НГ эктомезенхиме бранхиальных дуг (Aoki et al., 2003).
Обусловленная morpholino oligo деплеция Sox9 у эмбрионов
Xenopus ведет к потере экспрессии ранних маркёров НГ, так их как
Slug, Pax-3, Twist и вызывает общую потерю предшественников НГ у таких эмбрионов (Spokony et al., 2002). Учитывая эти находки, оказывается неожиданным то, что черепнолицевые хрящи, будучи аномальными, не полностью отсутствуют у Sox9-истощенных эмбрионов. Для сравнения с-myc-истощенные эмбрионы лишены всех черепнолицевых хрящей и др. производных НГ (bellmeyer et al., 2003). Образование клеток предшественников НГ м. б. восстановлено у Sox9-истощенных эмбрионов на поздних стадиях, вообще-то благодаря компенсаторной активности др. членов группы E Sox семейства, таких как Sox8 и Sox10. В согласии с этой идеей избыточная экспрессия Sox10 у
Xenopus м. усиливать экспрессию ранних маркёров НГ, таки х как
Slug (Aoki et al., 2003; Honore et al., 2003). На поздних стадиях эмбрионы, которым инъецировали Sox10, обнаруживают массивную эктопическую экспрессию маркёра меланоцитов Trp-2 (Aoki et al., 2003). Более того, Sox10 м. непосредственно индуцировать экспрессию Trp-2 на анимальном полюсе эксплантов (Aoki et al., 2003). Т.к., как полагают, MITF необходим для экспрессии Trp (Fang, Setaluri, 1999) и т.к. сигналы Wnt/β-catenin необходимы для MITF экспрессии (Dorsky et al., 2000), то эта находка указывает на то, что экспрессия Sox10 достаточна для инициации регуляторного каскада, который включает оба эти фактора, в обязательном порядке приводя к формированию меланоцитов. В согласии с этим и избыточная экспрессия Sox9 у эмбрионов птиц, приводящая к эктопической экспрессии, по крайней мере, одного канонического члена семейства Wnt, Wnt3a (Cheung, Briscoe, 2003). Более того, форсирование экспрессии Sox9 у эмбрионов кур не только ведет к избыточной продукции клеток НГ, но также склоняет эти клетки становиться меланоцитами и глией (Cheung et al., 2003). В соответствии с такой ролью белков группы Е Sox во время диверсификации НГ, было установлено, что вирусная неправильная экспрессия Sox10 у мышей в стволовых клетках НГ предупреждает нейральную дифференцировку, но оказывается пермиссивной для глиальной дифференцировки (Kim et al., 2003). Это указывает на то, что Sox10 м. играть роль в поддержании мультипотентности клеток предшественников НГ. Итак, группа белков Е Sox семейства находится среди наиболее важных регуляторов как образования предшественников НГ, таки и последующей диверсификации клонов НГ.
FoxD3
Ещё одним транскрипционным фактором, экспрессируемым в ранних клетках предшественниках НГ, является
FoxD3, член forkhead семейства транскрипционных регуляторов. Интересно, что Fox3D необходим для поддержания плюрипотентными клетки inner cell mass (ICM) у ранних эмбрионов мышей, это указывает на то, что этот фактор м.б. вобще участвовать в формировании и поддержании популяций стволовых клеток (Hanna et al., 2002).
FoxD3 является ранним маркёром клеток предшественников НГ у
Xenopus, кур, мышей и рыбок данио (Odenthal, Nusslein-Volhard, 1998; Dottori et al., 2001; Kos et al., 2001; Pohl, Knochel, 2001; Sasai et al., 2001)и, как полагают, функционирует как репрессор транскрипции (Sutton et al., 1996; Pohl, Knochel, 2001). У
Xenopus этот фактор экспрессируется в дорсальной губе бластопора и в задней части нейральной эктодермы ещё до начала своей экспрессии в НГ. На ст. нейральной пластинки, чуть позднее после начала экспрессии Slug
FoxD3 наиболее активно экспрессируется в клетках предшественниках НГ, хотя он также экспрессируется в подлежащей параксиальной мезодерме (Pohl, Knochel, 2001; Sasai et al., 2001)(E. Heeg-Truesdell, C.LaBonne, неопубл.).
Изучение избыточной экспрессии у
Xenopus выявило конфликтную до некоторой степени ситуацию о роли FoxD3 в развитии НГ (Pohl, Knochel, 2001) Хотя этот фактор, как сообщалось, и индуцирует экспрессию маркёров как ЦНС, так НГ при анализе анимальной шапочки, он, по-видимому, действует так только в эксплантах шапочки от эмбрионов на ст. гаструлы и в культуральной среде с низким содержанием кальция и магния (Sasai et al., 2001). Будучи избыточно экспрессирован в интактных эмбрионах, Fox3D расширяет экспрессию маркёров нейральной пластинки и уменьшает экспрессию маркёров НГ (Pohl, Knochel, 2001). Эктопическая экспрессия маркёров НГ м.б. выявлена вследствие экспрессии Fox3D в более латеральных областях эктодермы (Sasai et al., 2001), но остаётся неясным, является ли это вторичным по отношению к индукции эктопической нервной ткани. Избыточная экспрессия предполагаемого доминантно негативного Fox3D, лишенного ДНК-связывающего домена, ведет к потере экспрессии маркёров НГ (Sasai et al., 2001), это указывает на то, что функция Fox3D необходима для формирования НГ у
Xenopus. Однако, механизм, с помощью которого это специфическое мутантное укорочение функционирует как доминантно негативное, неясен, особенно учитывая, что избыточная экспрессия
Fox3D полной длины, несущего мутацию, которая устраняет связывание ДНК, не оказывает эффекта на формирование НГ (Pohl, Knochel, 2001).
Избыточная экспрессия Fox3D у эмбрионов птиц ведёт к повышенной деламинации клеток НГ из нервной трубки (Dottori et al., 2001; Kos et al., 2001), хотя это не вызывает эктопической экспрессии
Slug (Dottori et al., 2001; Kos et al., 2001). Morpholino-обусловенная деплеция Fox3D ведет к преждевременной миграции клеток НГ вдоль дорсолатерального пути, как полагают, ограниченным специфицированными меланобластами (Kos et al., 2001). Однако, электропортация этого morpholino не ведёт к потере образования или миграции клеток НГ , хотя степень, с которой morpholino оказывается успешным в деплеции белка Fox3D не была изучена в этой работе.
Amphioxus, как было показано, обладают одиночным FoxD гомологом, но в отличие от
AmphiSnail этот ген не экспрессируется клетками границы нейральной пластинки (Yu et al., 2002). Учитывая способность Fox3D способствовать миграции клеток НГ у эмбрионов кур (Dottori et al., 2001), было предположено, что приобретение клетками границы нейральной пластинки экспрессии Fox3D м.б. существенным для развития дефинитивного НГ у первых позвоночных (Yu et al., 2002). Недавно было подтверждено на рыбках данио, что Fox3D не обязателен для формирования клеток предшественников НГ или их последующей миграции (D.Raible, персон. сообщ.). Вместо этого, morpholino-обусловленная деплеция Fox3D у рыбок данио в условиях, при которых иммунореактивность к антителам Fox3D устранена, ведет к дефектам сегрегации определенных клонов НГ, аналогично тому, что наблюдается у эмбрионов кур.
АР-2
Семейство АР-2 basic-helix-span-helix транскрипционных факторов участвует в развитии и НГ и эпидермиса. У мышей это семейство транскрипционных активаторов представлено, по крайней мере, 5 членами, AP-2α, AP-2β, AP-2γ, AP-2δ, AP-2ε (Cheng et al., 2002; Zhao et al., 2001; Feng, Williams, 2003). Некоторые члены семейства экспрессируются в НГ, роль АР-2α в развитии НГ изучена лучше всего. Дефекты НГ наблюдаются у рыбок данио, несущих нулевые мутации в АР-2α, включая уменьшение числа меланоцитов, малые краниальные ганглии, черепно-лицевые дефекты и потерю энтерической нервной системы (Holzschuh et al., 2003; Knight et al., 2003). Эти дефекты согласуются с теми, что наблюдаются у мышей с Wnt1-Cre обусловленным условным нокаутом АР-2α (Brewer et al., 2004). Важно, что в обоих условных нокаутах у мышей и при ранее полученных традиционных нокаутах (Schorle et al., 1996; Zhang et al., 1996; Brewer et al., 2004), предшественники НГ формируются и мигрируют соотв. образом, указывая тем самым, что активность АР-1α существенна прежде всего для более поздних аспектов развития НГ, таких как диверсификация клонов.
В противоположность находкам у рыбок данио и мышей, результаты экспериментов по деплеции АР-2α с помощью morpholino у
Xenopus указывают на то, что этот фактор необходим для формирования предшественников НГ (Luo et al., 2003). Однако, очень высокие дозы morpholinos инъецировались при этих экспериментах для подавления ранних маркёров НГ, таких как
Slug и Sox9 (Luo et al., 2003). Т.к. специфичность деплеции не проверялась, то возможно, что эти дозы morpholino деплетировали и др. изоформы АР-2. Это м. объяснить потерю образования предшественников Нг у
Xenopus в этих экспериментах, но не у АР-2α-дефицитных рыб и мышей. Интересно, что АР-2α экспрессируется в не-нейрональной эктодерме до своей экспрессии на границе нейральной пластинки, а в ранних исследованиях были получены указания на
Xenopus, что этот фактор существенен и является прямым регулятором эпидермального развития (Luo et al., 2002). принимая во внимание, что взаимодействия эпидермы с нейральной пластинкой играют роль в индукции НГ, то вполне возможно, что эффекты истощения АР-2α в НГ являются косвенными. Роль АР-2 в эпидермисе м. предшествовать его функции в НГ, т.к. одиночные члены семейства АР-2 у amphioxus экспрессируются строго в не-нейрональной эктодерме и не экспрессируются по краю нейральной пластинки (Meulemans, Bronner-Fraser, 2002). Т.о., как и в случае Fox3D, предполагается, что приобретение экспрессии АР-2 клетками края нейральной пластинки у позвоночных м.б. критическим событием в эволюции позвоночных.
CONCLUSION
Помимо рассмотренных целая куча др. факторов также, скорее всего, играет роль в индукции и последующем развитии клеток НГ, включая белки семейства Zic (Nakata et al., 1997; 2000), Id2 (Martinsen, Bronner-Fraser, 1998), meis (Maeda et al., 2002), Nbx (Kurata, Ueno, 2003) и Twist (Hopwood et al., 1989; Soo et al., 2002). Значение каждого из этих факторов ещё предстоит выяснять. Важно понять, как эти факторы действуют совместно, как компоненты регуляторной сети. Выявляется, что большинство ранних реакций на сигналы, индуцирующие НГ, устанавливают и позитивные и негативные петли обратной связи, чтобы поддерживать домены экспрессии на границе нейральной пластинки. Напр., подавление или Slug или Sox9 ведет к потере экспрессии др. генов, это осложняет нашу способность выявлять индивидуальные роли этих факторов. Геномные подходы, имеющие целью идентифицировать прямые транскрипционные мишени, для каждого из этих факторов, д.б. приспособлены для этих целей.
Др. задачей является полное выяснение индивидуальных и коминированных ролей внеклеточных сигналов, участвующих в индукции НГ, включая BMPs, FGFs, Notch и Wnts. Необходимо понять, когда и каким образом комбинации этих сигналов воспринимаются и как транскрипционные реакции на эти сигналы меняют компетентность чувствительных клеток, чтобы отвечать на повторное действие этих сигналов. Первой ступенью могло бы быть понимание регуляции индивидуальных промоторов разных классов отвечающих генов. таких как Msx-1, c-myc и Slug. Сравнивая регуляцию таких факторов, безусловно, м. выявить, как широкие домены компетентности прогрессивно ограничиваются специфическими популяциями предшественников. Проводить исследования необходимо на всех широко используемых модельных организмах, особенно на amphioxus, чтобы пролить свет на эволюцию. выяснение механизмов, с помощью которых эти факторы регулируют нормальное развитие позволит понять и их роль в канцерогенезе. понимание как клетки НГ генерируются и мигрируют и дифференцируются безусловно прольёт свет на источники многих врожденных заболеваний.
Сайт создан в системе
uCoz