мРНК экспрессируется в энтодерме третьего глоточного кармана (Manley, Capecchi, 1995). В данной работе продемонстрировано, что ген
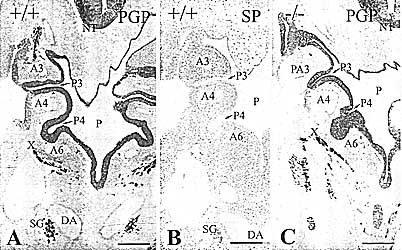
необходим для инициации образования паращитовидного рудимента. У эмбрионов мышей дикого типа дифференцировка третьего лоточного кармана начинается на Е11.5. Паращитовидный рудимент, иммунореактивный по SP-1/сhromogranin A, формируется в краниальной дорсальной части энтодермы третьего кармана и м.б. отличён от тимуса на этой стадии развития. У гомозиготных по
мутантов третий глоточный карман сохраняется в виде высокого цилиндрического эпителия, а выпячивания для зачатков паращитовидной железы и тимуса не образуется на стадии Е11.5. Не выявляются Sp-1/сhromogranin A-иммунореактивные клетки в третьем глоточном кармане. Следовательно, третий глоточный карман не способен дифференцироваться и в конце концов исчезает у
гомозигот. Внутренне присущая способность третьего глоточного кармана формировать паращитовидные железы нарушается при отсутствии гена
Некоторые кандидаты на роль сигнальных молекул участвуют в органогенезе паращитовидных желез. Glial cells missing (Gcm) 2, мышиный гомолог Gcm
Drosophila , является транскрипционным фактором, выявляемы в паращитовидных железах на поздних стадиях плодного развития (Kim et al., 1998). Gcm2-дефицитные мыши лишены паращитовидных желез, но обнаруживают нормальное развитие тимуса (Gunter et al., 2001). Экспрессия Gcm2 начинается на стадии Е9.5 в каудальной части глоточных карманов и постепенно ограничивается энтодермой третьих глоточных карманов (Gordon et al., 2001). В противоположность экспрессии Gcm SP-1/сhromogranin A иммунореактивность локализуется только в паращитовидном рудименте глоточных карманов.
Pax1 и Pax9 близко родственные члены paired box семейства генов.
Pax1 экспрессируется в третьем глоточном кармане, а также в эпителиальных клетках тимуса (Wallin et al.,1996). Потеря функции
Pax1; Su et al., 2001) ведет к гипоплазии тимуса из-за недостаточности развития тимоцитов (Wallin et al.,1996; Su et al., 2001). Хотя сообщалось также о гипоплазии паращитовидных желез, но это трудно идентифицировать (Su et al., 2001).
Pax9 мутантные мыши лишены производных третьего и четвёртого карманов, т.е. тимуса, паращитовидных желез и ultimobranchial желез (Peters et al., 1998). Eye absent (
Eya) 1 ген экспрессируется в тимусе, паращитовидных и ultimobranchial железах во время развития, и зачатки органов для этих структур отсутствуют у эмбрионов Eya1
-/- (Xu et al., 2002). У
Hoxa3 мутантов
Pax1 подавлен в третьем глоточном кармане (Manley, Capecchi, 1995) и отсутствует экспрессия
Gcm (Su et al., 2001). В энтодерме
Eya1-/- карманов экспрессия
Hoxa3, Pax1 и Pax9 не нарушена (Xu et al., 2002). Предполагается, что
Gcm2 экспрессия в паращитовидных железах регулируется с помощью
Hoxa3-Pax2/9-Eya1 пути (Xu et al., 2002). Следовательно,
Hoxa3, по-видимому. является ключевым регулятором дифференцировки энтодермы третьего глоточного кармана.
Синдромы делеции 22q11 у людей характеризуются гипопластичными или апластичными тимусом и паращитовидными железами (Scambler, 2000).
Tbx1 является T-box транскрипционным фактором, расположенным в локусе 22q11, а гомозиготные по Tbx1 нулевому аллелю особи лишены тимуса и паращитовидных желез (Jerome, Papaioannou, 2001).
Fgf8 мутантные мыши имеют фенотип, обнаруживаемый у людей с 22q11 делеционным синдромом, включая аплазию и гипоплазию тимуса и паращитовидных желез (Frank et al., 2002). Взаимоотношения этих генов с
Hoxa3 пока не выяснены.
У
Hoxa3 гомозигот, скрещенных с Cx43-lacZ трансгенными мышами, клетки нервного гребня, иммунореактивные по β-galactosidae, плотно оккупируют фарингальные дуги как и у эмбрионов дикого типа. Миграция мезенхимных клеток нервного гребня в третью дугу не нарушена у
Hoxa3 гомозигот. У птиц клетки нервного гребня проникают в тимус и паращитовидные железы и дают железистую соединительную ткань (Le Lievre, Le Douarin, 1975). C др. стороны, в данной работе продемонстрировано на эмбрионах мышей, что ни энтодермальныйf эпителий третьего глоточного кармана, на зачатки тимуса и паращитовидных желез не получают клетки нервного гребня. Более того, было показано, что у мышей маркированные по генам Wnt1-Cre и R26R мезенхимные клетки нервного гребня окружают, но не проникают в паренхиму тимуса (Jiang et al., 2000). Зачатаки тимуса, паращитовидных и ultimobranchial желёз развиваются из глоточных карманов и мигрируют к местам своего финального предназначения. Эти органы плотно заключены в мезенхимные клетки нервного гребня во время перемещения к местам своего назначения. Клетки нервного гребня, распределенные в фарингальных дугах м.б. вовлечены в миграцию зачатков органов у мышей эмбрионов. Кроме того, конденсация мезенхимных клеток нервного гребня во время развития органов, происходящих из глоточных карманов, по-видимому, сопровождается усилением активности экспрессии некоторых факторов роста и транскрипционных факторов (Clouthier et al., 2000). Соотв. взаимодействия между эпителием кармана и соседними мезенхимными производными клеток нервного гребня м. б. необходимы для нормального развития тимуса, паращитовидных и ultimobranchial желез.
Hoxa3 мРНК экспрессируется в клетках нервного гребня, занимающих третью глоточную дугу (Watari et al., 2001). Отсутствие передачи сигналов
Hoxa3, по-видимому, влияет на пролиферацию и дифференцировку постмиграторных клеток нервного гребня в третьей дуге.
Энтодермальный эпителий глоточных карманов у эмбрионов дикого типа и гомозигот
Hoxa3 обнаруживает множество апоптических клеток. Дифференцировка и рост органов, производных глоточных карманов, по-видимому, контролируется с помощью апоптоза. В частности, увеличение апоптических клеток выявляется в эпителии третьего глоточного кармана, обнаруживающего задержку развития на Е11.5-12.0 у мутантов. Следовательно, энтодерма третьего кармана неспособна дифференцироваться в отсутствие гена
Hoxa3 и в конечном счёте теряется с помощью апоптоза. Хотя паращитовидный рудимент никогда не обнаруживается, рудиментарные доли тимуса изредка встречаются у нулевых мутантов на стадии Е12.5-14.5. Тимус формируется энтодермой третьего кармана, слитой с эктодермальными клетками третьей щели (Cordier, Haumont, 1980). Эктодермальные клетки м. б. не изменены у мутантов
Hoxa3 и м. сохранять способность формировать нестабильные доли тимуса.
В противоположность третьему глоточному карману развитие и дифференцировка четвёртого кармана осуществляется нормально у нулевых мутантов Hoxa3. Билатеральные ultimobranchial тела, происходящие из четвертого глоточного кармана всегда образуются и соединяются со щитовидными железами на Е13.5. На стадии Е14.5 С-клетки, иммунореактивные по PGP 9.5 начинают диспергировать внутрь паренхимы щитовидных желез у мутантов Hoxa3, точно также как и у дикого типа. В обоих случаях SP-1/сhromogranin A иммунореактивность выявляется в С-клетках на поздних стадиях плодного развития. Более того, появление calcitonin иммунореактивности в С-клетках происходит очень поздго, т.е. при рождении. В соотв. с нашими данными Xu et al., (2002) сообщали, что capcitonin иммунореактивность впервые выявляется у новорожденных мышей.
Сайт создан в системе
uCoz