Opsins являются семейством связанных с мембранами, heptahelical
G-protein-coupled receptors (GPCRs), характеризующихся своей способностью ковалентно связывать retinaldehyde chromophore посредством Schiff base сцепления, используя лизиновые остатки, локализованные в 7 трансмембраных α-спиралях (Рис. 2). В естественной среде vitamin-A-based chromophore позвоночных образует или 11-cis-retinal (A1) или 11-cis-3, 4-didehydroretinal (A2). Opsin-based фотопигменты, конъюгирующие с A1 хромософорами, собственно названы rhodopsins, тогд как те, что конъюгируют с A2 хромофорами, названы porphyropsins (Lythgoe 1979). В этом обзоре термин 'opsin' будет использоваться скорее, чем rhodopsin, т.к. часто обычно и ошибочно он используется a priori независимо от того, какой из retinaldehyde chromophore используется. Это потенциальный источник расхождений, т.к. многие группы позвоночных используют или A1 chromophore, A2 chromophore, или конкурирующую смесь обоих (cf. Provencio et al. 1992). Обычно opsin , использующий A2 chromophore, обладает максимальной абсорбционной способностью (Λ
) при больших длинах волн, чем тот же самый опсин, утилизирующий A1 chromophore (Lythgoe 1979). В интересах ясности и непротиворечивости будет использована номенклатура, базирующаяся на том, где опсины экспрессируются, напр.,
-opsin.
Первичными событиями детекции картины в сетчатке позвоночных является появление наружных сегментов rod и cone клеток. Опсины располагаются в этих ламеллярных стеках и названы по типам соотв. клеток. Так
rod-opsin располагается в наружных сегментах палочек, а
cone-opsin в наружных сегментах колбочек. Абсорбция фотонов света с помощью chromophore в ретинальных связывающих карманах опсина вызывает его фотоизомеризацию из 11-cis в all-trans конформацию. Это изменение хромофора ведет к конформационному изменению окружающих его опсиновых молекул, делая возможными соединение с и активацию transducin (G-protein) в фототрансдукционном каскаде (Burns and Baylor 2001; Menon et al. 2001). Первая полная последовательность опсина позвоночных (телячьего
rod-opsin) описана в 1983 (Nathans and Hogness 1983), и этот опсин стал с тех пор numeration матрицей для критических остатков, которые законсервированы у всех опсинов (см. Табл. 1).
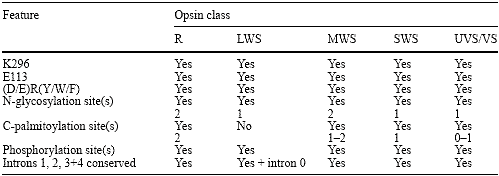 Table 1 Conserved features of vertebrate visual opsins modified after Ebrey and Koutalos (2001). Numbering according to bovine rod-opsin (Nathans and Hogness 1983). Aspartate (D113) counterion in Xenopus laevis UVS/VS opsin (Starace and Knox 1998). For details
see text
Table 1 Conserved features of vertebrate visual opsins modified after Ebrey and Koutalos (2001). Numbering according to bovine rod-opsin (Nathans and Hogness 1983). Aspartate (D113) counterion in Xenopus laevis UVS/VS opsin (Starace and Knox 1998). For details
see text
Геномная структура телячьего
rod-opsin состоит из 5 экзонов, разделенных 4 интронами (Nathans and Hogness 1983),эта структура законсервирована во всех
rod-opsins (R-opsins), включая и те, что у примитивных Agnatha (Zhang and Yokoyama 1997) (Рис. 3), за исключением
rod-opsin у костистых рыб, которые не имеют интронов (Fitzgibbon et al. 1995).
На молекулярном уровне номенклатура типов
cone-opsin несколько противоречива, к ней приложимо несколько схем. Все классификации согласны, что чуществует 4 класса
cone-opsin, но их названия варьируют в разных системах (cf. Bowmaker and Hunt 1999; Ebrey and Koutalos 2001). В данном обзоре мы выбрали номенклатуру, предложенную Hunt et al. (2001), которая коррелирует со спектральной чувствительностью (λ
max) с идентичностью аминокислотных последовательностей. Как будет показано ниже и в Табл. 2,
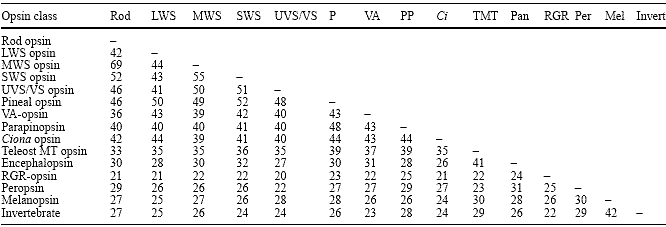 Table 2 Table showing the amino acid identity (%) encompassing transmembrane domains (б-helices) I–VII (as defined by the model of Baldwin et al. 1997) of representatives of the various vertebrate
opsin classes. Sequence sources with associated GenBank accession numbers: Rod chicken, D00702; LWS chicken red, M62903; MWS chicken green, M92038; SWS chicken blue, M92037; UVS/VS chicken violet, M92039; Pineal opsin chicken, U15762; VA-opsin salmon, AF001499; Parapinopsin catfish
AF028014; Ciona Ci-opsin1, AB058682; Teleost multiple tissue
opsin Fugu, AF402774; Encephalopsin human encephalopsin,
AF140242; RGR-opsin human, U14910; Peropsin human, AF012270; Melanopsin human, AF147788; Invertebrate cuttlefish rhodopsin, AF000947
Table 2 Table showing the amino acid identity (%) encompassing transmembrane domains (б-helices) I–VII (as defined by the model of Baldwin et al. 1997) of representatives of the various vertebrate
opsin classes. Sequence sources with associated GenBank accession numbers: Rod chicken, D00702; LWS chicken red, M62903; MWS chicken green, M92038; SWS chicken blue, M92037; UVS/VS chicken violet, M92039; Pineal opsin chicken, U15762; VA-opsin salmon, AF001499; Parapinopsin catfish
AF028014; Ciona Ci-opsin1, AB058682; Teleost multiple tissue
opsin Fugu, AF402774; Encephalopsin human encephalopsin,
AF140242; RGR-opsin human, U14910; Peropsin human, AF012270; Melanopsin human, AF147788; Invertebrate cuttlefish rhodopsin, AF000947
фотопигменты опсины из разных семейств обнаруживают приблизительно 40% идентичных аминокислот, тогда как члены внутри семейства опсинов обнаруживают значительно более высокий уровень идентичности (~75% или более), даже у видов столь удаленных как золотая рыбка и человек (Рис. 3). Т.о., опсины с λ
max между 355 и 435 nm и с идентичностью аминокислот ~75% были классифицированы как ultraviolet/violet sensitive (UVS/VS) opsins. Таким же образом опсины с λ
max между 415 и 470 nm и аминокслотной идентичностью ~75% классифицированы как коротковолновые shortwave sensitive (SWS),
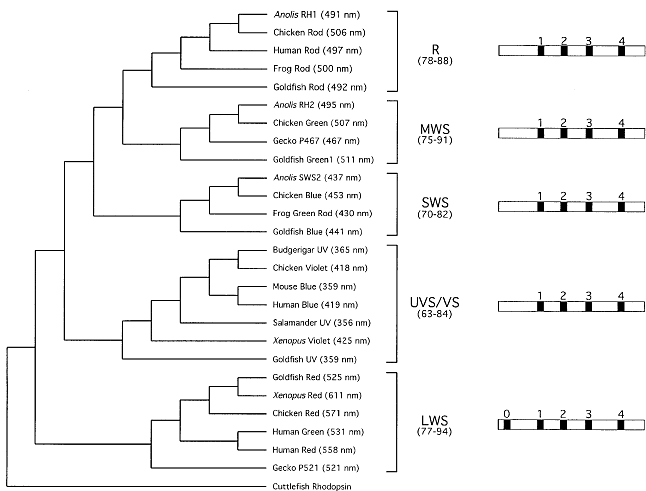 Fig. 3 Maximum parsimony phylogenetic tree showing the relationship
of the various visual opsin classes as represented by selected
members of each class (R rod-opsin, MWS middlewave sensitive,
SWS shortwave sensitive, UVS/VS ultraviolet sensitive/violet
sensitive, LWS longwave sensitive). The level of amino acid
identity (%) encompassing transmembrane domains (б-helices)
I-VII (as defined by the model of Baldwin et al. 1997) between
the representatives within each opsin class is denoted in parentheses
under the class name. The variety of names used within each
class and their respective maximal absorbances (лmax nm) are denoted
in parentheses. A diagrammatic representation of the genomic
structure of each opsin class is shown to the right of the
tree. The genomic structure is perfectly conserved with the exception
of the LWS class, which possesses an extra intron (vertical
black bars), intron 0, with respect to the R, MWS, SWS and
UVS/VS opsin classes. Opsin amino acid sequences were aligned
using ClustalX 1.81 (Thompson et al. 1997), and the maximum
parsimony tree was calculated using Phylo_win (Galtier et al.
1996). GenBank accession numbers for the sequences, and the references
associated with the лmax are as follows: Anolis RH1,
L31503 (Kawamura and Yokoyama 1998); Chicken Rod, D00702
(Bowmaker et al. 1997); Human Rod, U49742 (Dartnall et al.
1983); Frog Rod, S79840 (Kayada et al. 1995); Goldfish Rod,
L11863 (Johnson et al. 1993); Anolis RH2, AF134191 (Kawamura
and Yokoyama 1998); Chicken Green, M92038 (Bowmaker et al.
1997); Gecko P467, M92035 (Kojima et al. 1992); Goldfish
Green1, L11865 (Johnson et al. 1993); Anolis SWS2, AF133907
(Kawamura and Yokoyama 1998); Chicken Blue, M92037
(Bowmaker et al. 1997); Frog Green Rod, AB010085 (Hisatomi et
al. 1999); Goldfish Blue, L11864 (Johnson et al. 1993); Budgerigar
UV, Y11787 (Wilkie et al. 1998); Chicken Violet, M92039
(Bowmaker et al. 1997); Mouse Blue, U92562 (Yokoyama et al.
1998); Human Blue, U53874 (Dartnall et al. 1983); Salamander
UV, AF038948 (Ma et al. 2001); Xenopus Violet, U23463 (Starace
and Knox 1998); Goldfish UV, D85863 (Yokoyama et al. 1998);
Goldfish Red, L11867 (Johnson et al. 1993); Xenopus Red,
U90895 (Witkovsky 2000); Chicken Red, M62903 (Bowmaker et
al. 1997); Human Green, K03494 (Dartnall et al. 1983); Human
Red, M13305 (Dartnall et al. 1983); Gecko P521, M92036 (Kojima
et al. 1992); Cuttlefish Rhodopsin, AF000947
Fig. 3 Maximum parsimony phylogenetic tree showing the relationship
of the various visual opsin classes as represented by selected
members of each class (R rod-opsin, MWS middlewave sensitive,
SWS shortwave sensitive, UVS/VS ultraviolet sensitive/violet
sensitive, LWS longwave sensitive). The level of amino acid
identity (%) encompassing transmembrane domains (б-helices)
I-VII (as defined by the model of Baldwin et al. 1997) between
the representatives within each opsin class is denoted in parentheses
under the class name. The variety of names used within each
class and their respective maximal absorbances (лmax nm) are denoted
in parentheses. A diagrammatic representation of the genomic
structure of each opsin class is shown to the right of the
tree. The genomic structure is perfectly conserved with the exception
of the LWS class, which possesses an extra intron (vertical
black bars), intron 0, with respect to the R, MWS, SWS and
UVS/VS opsin classes. Opsin amino acid sequences were aligned
using ClustalX 1.81 (Thompson et al. 1997), and the maximum
parsimony tree was calculated using Phylo_win (Galtier et al.
1996). GenBank accession numbers for the sequences, and the references
associated with the лmax are as follows: Anolis RH1,
L31503 (Kawamura and Yokoyama 1998); Chicken Rod, D00702
(Bowmaker et al. 1997); Human Rod, U49742 (Dartnall et al.
1983); Frog Rod, S79840 (Kayada et al. 1995); Goldfish Rod,
L11863 (Johnson et al. 1993); Anolis RH2, AF134191 (Kawamura
and Yokoyama 1998); Chicken Green, M92038 (Bowmaker et al.
1997); Gecko P467, M92035 (Kojima et al. 1992); Goldfish
Green1, L11865 (Johnson et al. 1993); Anolis SWS2, AF133907
(Kawamura and Yokoyama 1998); Chicken Blue, M92037
(Bowmaker et al. 1997); Frog Green Rod, AB010085 (Hisatomi et
al. 1999); Goldfish Blue, L11864 (Johnson et al. 1993); Budgerigar
UV, Y11787 (Wilkie et al. 1998); Chicken Violet, M92039
(Bowmaker et al. 1997); Mouse Blue, U92562 (Yokoyama et al.
1998); Human Blue, U53874 (Dartnall et al. 1983); Salamander
UV, AF038948 (Ma et al. 2001); Xenopus Violet, U23463 (Starace
and Knox 1998); Goldfish UV, D85863 (Yokoyama et al. 1998);
Goldfish Red, L11867 (Johnson et al. 1993); Xenopus Red,
U90895 (Witkovsky 2000); Chicken Red, M62903 (Bowmaker et
al. 1997); Human Green, K03494 (Dartnall et al. 1983); Human
Red, M13305 (Dartnall et al. 1983); Gecko P521, M92036 (Kojima
et al. 1992); Cuttlefish Rhodopsin, AF000947
с λ
max между 480 и 520 nm как
middlewave sensitive (MWS), и с λ
max между
500 и 570 nm longwave sensitive (LWS). Первым изолированными
cone-opsin последовательностями были голубые, зеленые и красные
cone-opsins человека (Nathans et al. 1986). Используя критерии, представленные выше, голубой
cone-opsin человека
(λ
max ~420 nm; Dartnall et al. 1983) стал членом клесса ultraviolet/violet-sensitive (UVS/VS) опсинов, тогда как зеленый и красный
cone-opsins (λ
max~530 nm и ~560 nm, соотв.; Dartnall et al. 1983) оба оказались членами longwave sensitive (LWS) класса опсинов, тк. они обнаруживают 96% идентичность (Nathans et al. 1986). Гены UVS/VS опсинов обладают той же самой геномной структурой, что и
rod-opsin гены, т.к. обладают теми же 4 законсервированными интронами. LWS также имеют 4 законсервированных интрона, сходных с
rod- и UVS/VS
cone-опсинами, но имеют дополнительный 5-й интрон в 5' prime позиции по отношению к 4 консервативным интронам (Nathans et al. 1986), который мы обозначили intron 0 (zero) в данном обзоре (Табл. 1, Рис. 3). Последовательности оставшихся двух классов зрительных опсинов позвоночных SWS и MWS были выделены и установлена та же самая геномная структура, что и у
rod- and UVS/VS
cone-opsins
(Yokoyama and Yokoyama 1996). Интересно, что SWS и MWS опсины обнаружены у птиц, рептилий и амфибий и отсутствуют в в ветви млекопитающих. Эта потеря, как полагают, связана с ночной нишей, занятой млекопитающими во время их эволюции, что привело к потере этих двух классов колбочек (Hunt et al. 2001). Взаимоотношения классов зрительных опсинов и их законсервированных геномных структур показаны на рис. 3.
В добавление к их законсервированным геномным структурам, зрительные опсины обладают многими др. общими признаками. Используя numeration схему, базирующуюся на телячьем
rod-opsin (Nathans and Hogness 1983), эти признаки будут рассмотрены ниже и показаны на Рис. 2 и в Табл. 1. Сайтом ретинального прикрепления является Lys-296 в седьмом трансмембранном домене, который связывает ковалентно chromophore посредством protonated Schiff base сцепления (Pepe 1999). Позитивно заряженное Schiff основание сбалансировано с помощью негативно заряженного противоположного иона, Glu-113 третьем трансмембранном домене (Pepe 1999). Конформационная интеграция опсина, частично, поддерживается с помощью дисульфидных связей между Cys-110 и Cys-187 (во внеклеточной петле 1 и 2), признак высоко законсервирован среди GPCRs (Bockaert and Pin 1999; Karnik et al. 1988). Аминокислотная триада
(Glu/Asp)-134/Arg-135/(Tyr/Trp/Phe)-136 высоко законсервирована среди GPCRs и, по-видимому, является критической для взаимодействия с G-белком (Franke et al. 1990, 1992). На N-конце присутствуют два сайта гликозилирования, Asn-2 и Asn-15 (Hargrave 1977), тогда как на С-конце пара цистеиновых остатков (Cys-322 и Cys-323) palmitoylated и образует 4 внутриклеточные петли (Ovchinnikov et al. 1988).
The novel opsins
Не-глазная фоторецепция у позвоночных, не-млекопитающих, хорошо известна и подробно описана (Oksche and Hartwig 1975; Shand and Foster
1999; Yoshikawa and Oishi 1998). Первоначальная характеристика внеглазных фотопигментов использовала иммуногистохимию, чтобы продемонстрировать опсин-подобную иммунореактивность, в последнее время эти исследования сопровождаются детальной молекулярной характеристикой (Soni et al. 1998). В ходе этих исследований открыты новые опсины, которые отличаются от классических зрительных
rod- и
cone-opsins. Они обладают общими основными характеристиками, обнаруженными у зрительных опсинов, такими как лизиновые ретинальные сайты прикрепления и glutamate counterion (Table 1), но обладают также уникальными свойствами как на генном, так и белковом уровне.
P-opsin
В 1994 Okano et al. скринировали куриную библиотеку pineal кДНК
с куриным red (LWS) и violet (UVS/VS)
cone-opsin кДНК зондами и изолировали клоны кДНК, соответствующие новому опсину, который обладает ~49% идентичными аминокислотами со зрительными опсинами (Табл. 2). Этот опсин обладает характерными свойствами зрительных опсинов (эквивалентами Lys-296, Glu-113, Cys-110 и Cys-187, и Asn-15), но его экспрессия ограничена шишковидной железой и поэтому он назван pinopsin. Экспрессия
in vivo куриного pinopsin и его восстановление с помощью 11-cis-retinal показывает, что этот opsin обладает максимальной абсорбцией (λ
max) ~470 nm (Nakamura et al. 1999; Okano et al. 1994) и ~462 nm (Max et al. 1998). Max et al. (1995) подтвердили локализацию куриного pinopsin в шишковидной железе и определили структуру гена. Ген pinopsin обладает 4 интронами. Инсерционные сайты интронов 1, 3 и 4 консервативны с таковыми зрительных опсинов, тогда как инсерционный сайт интрона 2 сдвинут на 14 нуклеотидов в 3' направлении (Рис. 4). Max et al. (1995) внесли также альтернативную номенклатуру для этого опсина, назвав его P-opsin. И pinopsin и P-opsin признанное название для этого класса.
Представители класса P-opsin выделены и у др. видов птиц, напр., голубя (Kawamura and Yokoyama 1996), и в двух др. классах позвоночных, рептилиях (Kawamura and Yokoyama 1997) и амфибиях (Yoshikawa et al. 1998). Паттерн тканевого распределения P-opsin расширяется по мере увеличения идентифицируемых P-opsins. С помощью иммуногистохимии P-opsin птиц удалось ограничить parafollicular pinealocytes и наружными сегментами пинеалоцитов, которые имеют контакт с фолликулярным просветом (Okano et al. 1997). Экспрессия P-opsin у амфибий, жабы Bufo japonicus, выявляется в переднем preoptic ядре hypothalamus (Yoshikawa et al.1998). Уникально, что у дневного геккона Phelsuma madagascariensis longinsulae, экспрессия P-opsin выявляется в шишковидной железе, а также в сетчатке (в наружных сегментах добавочных членовтипа B двойных колбочек) с помощью иммуногистохимии (Taniguchi et al. 2001). Курьезно, т.к. ген P-opsin существует в геноме Птиц, Амфибий и Рептилий, его ортологи, по-видимому. не существуют у млекопитающих и костистых рыб. Костистые рыбы, однако, открывают возможность существования др. классов опсинов нервной ткани.
VA-opsin
Vertebrate Ancient (VA) opsin впервые описан у Atlantic salmon (Salmo salar) (Soni and Foster 1997) в результате выделения кДНК, кодирующей opsin-подобный белок в 323 аминокислоты из глазной ткани. Salmon
VA-opsin имеет 37-41% идентичных аминокислот с классическими ретинальными опсинами и 42% идентичности с куриным P-opsin (Soni and Foster 1997) (Табл. 2). Salmon VA-opsin формирует функциональный фотопигмент (с λ
max 451 nm), когда
 Fig. 4 Maximum parsimony phylogenetic tree showing the relationship of the visual and non-visual novel opsins. To the right of
the tree a diagram of the genomic structures of the opsin classes is
shown, with introns represented by vertical black bars. The highly
conserved structures of some of the opsin classes are very evident,
with the positions of introns 1, 3 and 4 being invariant. The relative
position of intron 2 in the non-visual opsins is indicated by an
arrowhead when it is shifted in a 3ЃЊ direction (P- and VA-opsins)
or absent (Parapineal opsin and Multiple Tissue Opsins). The genomic
structure of peropsin is unknown. Neither melanopsin nor
RGR share a common intron insertion site with those of the characterised
photopigments (see text for details). Note that the tunicate
Ciona intestinalis possesses an opsin (Ciona Opsin 1) that
shares three perfectly conserved intron insertion sites (1, 3 and 4)
with those of the vertebrate visual opsins. Opsin amino acid sequences
were aligned using ClustalX 1.81 (Thompson et al. 1997)
and the maximum parsimony tree was calculated using Phylo_win
(Galtier et al. 1996). GenBank accession numbers for the sequences
are as follows: Human Rod, U49742; Chicken Rod, D00702;
Salmo Exo-Rod, AF201469; Fugu Exo-Rod, AF201472; Chicken
Green, M92038; Goldfish Green, L11865; Chicken Blue, M92037;
Goldfish Blue, L11864; Human Blue, U53874; Chicken Violet,
M92039; Goldfish UV, D85863; Chicken Red, M62903; Goldfish
Red, L11867; Human Red, M13305; Chicken Pinopsin, U15762;
Toad Pinopsin, AF200433; Anolis P-opsin, AF134771; Salmo VAopsin,
AF001499; Carp VA-opsin, AF233520; Lamprey P-opsin,
U90671; Catfish Parapinopsin, AF028014; Ciona Opsin 1,
AB058682; Human Encephalopsin, AF140242; Mouse Encephalopsin,
AF140241; Fugu TMT-opsin, AF402774; Danio TMTopsin,
AF349947; Human Peropsin, AF012270; Mouse Peropsin,
AF012271; Human Melanopsin, AF147788; Mouse Melanopsin,
AF147789; Xenopus Melanopsin, AF014797; Cuttlefish Rhodopsin,
AF000947; Drosophila Rh3-opsin, M17718; Human RGRopsin,
U14910; Mouse RGR-opsin, AF076930; Squid Retinochrome,
X57143
Fig. 4 Maximum parsimony phylogenetic tree showing the relationship of the visual and non-visual novel opsins. To the right of
the tree a diagram of the genomic structures of the opsin classes is
shown, with introns represented by vertical black bars. The highly
conserved structures of some of the opsin classes are very evident,
with the positions of introns 1, 3 and 4 being invariant. The relative
position of intron 2 in the non-visual opsins is indicated by an
arrowhead when it is shifted in a 3ЃЊ direction (P- and VA-opsins)
or absent (Parapineal opsin and Multiple Tissue Opsins). The genomic
structure of peropsin is unknown. Neither melanopsin nor
RGR share a common intron insertion site with those of the characterised
photopigments (see text for details). Note that the tunicate
Ciona intestinalis possesses an opsin (Ciona Opsin 1) that
shares three perfectly conserved intron insertion sites (1, 3 and 4)
with those of the vertebrate visual opsins. Opsin amino acid sequences
were aligned using ClustalX 1.81 (Thompson et al. 1997)
and the maximum parsimony tree was calculated using Phylo_win
(Galtier et al. 1996). GenBank accession numbers for the sequences
are as follows: Human Rod, U49742; Chicken Rod, D00702;
Salmo Exo-Rod, AF201469; Fugu Exo-Rod, AF201472; Chicken
Green, M92038; Goldfish Green, L11865; Chicken Blue, M92037;
Goldfish Blue, L11864; Human Blue, U53874; Chicken Violet,
M92039; Goldfish UV, D85863; Chicken Red, M62903; Goldfish
Red, L11867; Human Red, M13305; Chicken Pinopsin, U15762;
Toad Pinopsin, AF200433; Anolis P-opsin, AF134771; Salmo VAopsin,
AF001499; Carp VA-opsin, AF233520; Lamprey P-opsin,
U90671; Catfish Parapinopsin, AF028014; Ciona Opsin 1,
AB058682; Human Encephalopsin, AF140242; Mouse Encephalopsin,
AF140241; Fugu TMT-opsin, AF402774; Danio TMTopsin,
AF349947; Human Peropsin, AF012270; Mouse Peropsin,
AF012271; Human Melanopsin, AF147788; Mouse Melanopsin,
AF147789; Xenopus Melanopsin, AF014797; Cuttlefish Rhodopsin,
AF000947; Drosophila Rh3-opsin, M17718; Human RGRopsin,
U14910; Mouse RGR-opsin, AF076930; Squid Retinochrome,
X57143
экспрессируется
in vitro и восстанавливается сж 11-cis-retinal
(Soni et al. 1998). Значительная часть VA-opsin экспрессируется в субнаборе горизонтальных и амакринных клеток сетчатки. Это наблюдение впервые продемонстрировало, что фотопигмент м. экспрессироваться и во внутренней сетчатке позвоночных (Soni et al. 1998). Гибридизация
in situ продемонстрировала, что лососевый VA-opsin экспрессируется также в шишковидной железе и в habenular области головного мозга (Philp et al. 2000b), т.е. в структурах, как известно, участвующих в фоторецепции (Ekstrom et al. 1987; Ekstrоm and Meissl 1997; Foster et al. 1994;
Yoshikawa and Oishi 1998). Сходные находки были сделаны у рыбок данио (
Danio rerio) Kojima et al. (2000), которые продемонстрировали присутствие VA-opsin во внутреннем листке сетчатки и головном мозге. Вторая изоформа VA-opsin была идентифицирована у др. вида костистых рыб (карпа,
Cyprinus carpio) (Moutsaki et al. 2000). Эта вторая изоформа VA-opsin характеризуется очень длинным С-хвостом (79 аминокислот) по сравнению с лососевым VA-opsin. Независимо эта длинная изоформа вместе с короткой формой VA-opsin были идентифицированы у рыбок данио (Kojima et
al. 2000). Эти две изоформы VA-opsin, VAL (long)и VAS (short), по-видимому, сосуществуют. Ещё одна изоформа VA-opsin (VAM) выделена
из корюшки (
Plecoglossus altivelis) (Minamoto and Shimizu 2002). Значение этих множественных изоформ пока неизвестно. Как и у P-opsins, инсерционный сайт интрона 2 в гене VA-opsin сдвинут по сравнению со зрительными опсинами (Рис. 4). Однако, в противоположность P-opsins, у которых интрон сдвинут на 14 нуклеотидов в 3' направлении, у VA-opsins интрон 2 сдвинут на 42 нуклеотида в 3' направлении (Moutsaki et al. 2000) (Рис. 4).
В 1997 Yokoyama and Zhang выделилигеномные последовательности из морской миноги (Petromyzon marinus), которые они обозначили как lamprey P-opsin. Т.к. этот ген имеет некоторое отношение к P-opsins, но детальное сравнение геномной структуры гена lamprey P-opsin и определение аминокислотного состава (lamprey P-opsin обнаруживает только 46-48% идентичности с P-opsins, но 61-65% с VA-opsins), говорит в пользу того, что lamprey P-opsin является членом класса VA-opsin. Учитывая эволюционное положение миног, было предположено, что lamprey P-opsin является эволюционным предшественником семейства VA-opsin костистых рыб (Moutsaki et al. 2000).
PP-opsins
Parapinopsin (PP-opsin) описан у единственного вида костистых рыб, channel catfish Ictalurus punctatus (Blackshaw and Snyder 1997). Parapinopsin обладают примерно 40% идентичных аминокислот со зрительными опсинами позвоночных и 48% и 43% идентичности с P-opsin и VA-opsin, соотв. (тТабл. 2). Как и в случае P-opsin и VA-opsin позиции интронов 1, 3 и 4 законсервированы по отношению к зрительным опсинам, но интрон 2 у него отсутствует. PP-opsin экспрессируется строго в parapineal органе и pineal стебле и обнаруживает кроме того экспрессию на низком уровне в шишковидной железе, головном мозге и сетчатке. Экспрессия PP-opsin выявлена также в коже головы catfish, специфически во вкусовых почках (Blackshaw and Snyder 1997).
Extraretinal rod-like opsins
Присутствие иммунореактивности opsin в шишковидной железе костистых рыб известно уже давно (Vigh-Teichmann et al. 1982, 1983), но до сих пор остается неизвестной точная природа этой иммунореактивности. Полная длина кодирующих нуклеотидных последовательностей rod-подобного opsin установлена независимо у рыбок данио,
D. rerio (Mano et al. 1999), puffer-fish,
Fugu rubripes и Атлантической лососи S. salar (Philp et al. 2000a). Эти pineal opsins обладают лишь 74% идентичности с
rod-opsins из сетчатки того же вида, а филогенетический анализ указывает на то, что pineal rod-like opsins и retinal rod-opsins дивергировали рано во время эволюции ветви костистых рыб (Philp et al. 2000a). Экспрессия каждого из этих опсиновых генов ограничена тканью, из которой они выделены, т.е. retinal rod-opsin экспрессируется исключительно в палочках сетчатки, а pineal rod-like-opsin экспрессируется исключительно в шишкоидной железе. Тканеспецифическая экспрессия форм
rod-opsin не уникальна, т.к. rodopsin, экспрессируемый в глубоких частях головного мозга птиц идентичен тому, что экспрессируется в сетчатке, указывая на то, что одни ген rodopsin экспрессируется в обеих тканях (Wada et al. 1998). Номенклатура pineal rod-opsin костистых рыб несколько не согласуется с предложенной Mano и др. (Mano et al. 1999) exo-rhodopsin (происходящей из extra-ocular rhodopsin), а Philp и др. (Philp et al. 2000a) предложили термин ERrod-like opsin (исходя из extra-retinal rod-like opsin) т.к. не имеется информации относительно используемых chromophore, это 11-cis-retinal (A1) или 11-cis-3,4-didehydroretinal (A2), оба из которых обнаруживаются и в сетчатке и головном мозге костистых рыб (Tabata et al. 1985).
Encephalopsin/panopsi
В 1999 Blackshaw and Snyder выделили и определили полную последовательность opsin у людей и мышей, который они назвали encephalopsin из-а его экспрессии в головном мозге млекопитающих (Blackshaw and Snyder 1999). Сравнение encephalopsin со зрительными опсинами показало, что идентичность аминокислот низкая, ~30% и что предполагаемым уравновешивающим ионом (counterion) является aspartate, counterion остаток описан только в
Xenopus laevis violet (UVS/VS)
cone-opsin (Starace and Knox 1998). Генетическая структура encephalopsin идентична таковой с parapinopsin, т.е. интрон 2 отсутствует, а места вставки интронов 1, 3 и 4 законсервированы (Blackshaw and Snyder 1999) (Рис. 4). Независимые исследование этого гена (Halford et al. 2001) прояснило его последовательности и выявило более широкое его тканевое распределение. Помимо строгой экспрессии в головном мозге и яичках и слабой экспрессии в сердце, печени и почках (Blackshaw and Snyder 1999), encephalopsin экспрессируется и в скелетных мышцах, легких, поджелудочной железе и сетчатке. Учитывая очень широкий круг тканей, экспрессирующих encephalopsin, было предполжено, что encephalopsin лучше было бы назвать panopsin (Halford et al. 2001).
Teleost multiple tissue opsin (tmt-opsin)
Др. опсин с широким тканевым распределением идентифицирован у рыбок данио , D. rerio, и pufferfish, F. rubripes (Moutsaki et al. 2002): teleost multiple tissue opsin (tmt-opsin), назван так из-за своей широкой экспрессии в разлиных нервных и не-нейральных тканях, напр., сетчатке, головном мозге, печени, сердце и почках. tmt-Opsin обладает той же самой гнеомной структурой, что и catfish PP-opsin encephalopsin/panopsin млекопитающих (Рис. 4). В противоположность panopsin/encephalopsin он обладает более высоким уровнем идентичных аминокислот с фотопигментными опсинами ~35-39% (Табл. 2). Интересно, что положение counterion занято тирозиновым остатком, аминокислотой, которая часто обнаруживается в зрительных пигментах беспозвоночных в этой позиции (Bellingham et al. 1998). Выполняет ли tmt-opsin фотосенсорную функцию у рыб? интересно, что изолированные органы и клеточные линии рыбок данио обнаруживают циркадные осцилляции экспрессии часовых генов, которые поддерживают 24-ч цикл свет/темнота; однако, механизмы, лежащие в основе этой клеточной фоточувствительности неизвестны (Whitmore et al. 2000). Т.к. tmt-opsin имеет геномную структуру, характерную для фотопигментов позвоночных и идентичность аминокислот, эквивалентную известным фотопиогментным опсинам и важными остатками, необходимыми для функции фотопигмента, то этот ген рассматривается как главный кандидат photic регуляции периферических часов у рыбок данио (Moutsaki et al. 2002).
Peropsin
Peropsin выделен в 1997 (Sun et al. 1997) и обнаруживает ~26% идентичных аминокислот с фотопигментными опсинами. Т.к. этот opsin обладает эквивалентным Lys-296, а позиция Glu-113 counterion занята тирозиновым остатком, который обычно обнаруживается в этой относительной позиции в опсинах беспозвоночных (Bellingham et al. 1998). Экспрессия Peropsin ограничена глазами и локализована с помощью гибридизации
in situ и иммуногистохимии в пигментном эпителии сетчатки (RPE). Это указывает на то, что peropsin м. участвовать в превращениях (recycling) ретинальных chromophore. Окрашивание иммуно-золотом показало, что peropsin
специфически локализуется в апикальной плазматической мембране RPE, включая микроворсинки, которые занимают пространства между наружными сегментами палочек (Sun et al. 1997), что подтверждает роль этой молекулы в ретинальном рециклинге.
RGR-opsin
С помощью скрининга библиотеки кДНК RPE выделен белок в 291
аминокислот, обнаруживающий гомологию с семейством опсинов (Jiang et al. 1993). Этот RPE-retinal G-protein-coupled receptor (RGR-opsin) обладает эквивалентным Lys-296 ретинального сайта прикрепления, но имеет гистидиновый остаток в позиции потенциального counterion. Экспрессия RGR-opsin ограничена RPE, а также Muller клетками. Это привело к предположению, что RGR-opsin м. функционировать как 11-
cis-retinal транспортная молекула или как
all-trans-retinal photoisomerase (Jiang et al. 1993; Pandey et al. 1994). Было установлено, что
RGR-opsin м. связывать all-
trans-retinal и действовать как стереоспецифическая photoisomerase, которая генерирует 11-cis-retinal
в пигментном эпителии (Hao and Fong 1996, 1999). Мыши, лишенные функционального RGR-opsin (Rgr
-/-), в адаптированном к темноте состоянии обладают сходными уровнями retinal и rod-opsin фотопигментов и имеют electroretinogram (ERG) сходную с таковой у мышей дикого типа. Однако, в состоянии адаптации к свету уровни этих параметров снижаются (Chen et al. 2001). Сделан вывод, что Rgr
-/- мыши сохраняют (ещё не идентифицированную) isomerase, но что эта функциональная изомераза и ассоциированный с нею путь синтеза 11-
cis-retinal, недостаточны в отсутствие RGR-opsin , чтобы поддерживать правильные уровни 11-
cis-retinal и rod-opsin фотопигмента на свету. И доминантные и рецессивные мутации гена RGR-opsin человека участвуют в дегенеративном заболевании сетчатки, пигментном ретините (Morimura et al. 1999). Интересно, что RGR-opsin не обладает законсервированной генмной структурой фотопигментных opsins; его 6 мест интронных вставок не законсервированы (Рис. 4), т.е. как и в случае с melanopsin, имеет место др. эволюционная ветвь (Shen et al. 1994; Tao et al. 1998).
Melanopsin
Poikilothermic позвоночные (рыбы и амфибии) способны менять свою наружную окраску посредством chromatophores (Oshima 2001), a некоторые классы хроматофоров, такие как меланофоры амфибии
Xenopus laevis, по-видимому, нуждаются в присутствии retinoid, чтобы обеспечить нормальную реакцию на свет (Rollag 1996). Кроме того, Moriya et al. (1996) установили, что агрегация меланосом у
Xenopus максимально чувствительна к 500 nm с реакцией, сходной с той, которая наблюдается у rod-opsin
Xenopus (λ
max 500 nm; Batni
et al. 1996). Скрининг дермальных меланофор
Xenopus в библиотеке кДНК позволил изолировать и клонировать с открытой рамки считывания предполагаемый белок в 534 кислот, который напоминает опсин и был назван melanopsin (Provencio et al. 1998b). Подобно peropsin и
tmt-opsin аминокислота в позиции counterion в melanopsin является тирозином, тогда как дедуцированные аминокислотные последовательности выявляют довольно низкий уровень идентичности с фотопигментными опсинами (~27%) (Табл. 2). Более того, филогенетически melanopsin ко-сегрегирует с опсинами беспозвоночных (Рис. 4). Избыточная экспрессия гена melanopsin в культивируемых melanophores увеличивает чувствительность этих клеток к свету, указывая тем самым, что melanopsin д. на опредленном уровне вовлекаться в регуляцию фоточувствительности меланофор (Rollag et al. 2000). Xenopus melanopsin экспрессируется также и в глазах и головном мозге eye у этого вида. В глазах melanopsin экспрессируется в слое горизонтальных клеток внутреннего ядерного слоя (в области, где обычно располагаются горизонтальные клетки), в RPE и радужке. В головном мозге melanopsin локализуется в magnocellular preoptic ядре и в suprachiasmatic ядре (Provencio et al. 1998b), все эти области, как установлено ранее, выступают в роль энцефалических фоторецепторов (Foster et al. 1994). Установлено, что rodopsin и melanopsin ко-экспрессируются в меланофорах
Xenopus. Предполагается, что rod-opsin управляет агрегацией меланосом и что это согласуется с действием спектра на агрегацию, тогда как melanopsin м. управлять дисперсией меланофор (Miyashita et al. 2001). Или м. существовать одиночный rod-opsin фотопигмент в меланофорах, а melanopsin поддерживает активность rod-opsin фотопигмента, и вообще действует как RGR-подобная photoisomerase (см "RGR-opsin" выше). Недавно выявлены ортологи Xenopus melanopsin у людей и мышей (Provencio et al. 2000). Подобно Xenopus melanopsin, меланопсины млекопитающих обнаруживюат низкое сходство со зрительными опсинами (Табл. 2) и имеют тирозин в положении предполагаемого counterion (Table 1). Однако, их экспрессия ограничивается глазами. В сетчатке приматов melanopsin экспрессируется в большом количестве клеток слоя ганглиолярных клеток и в клетках внутреннего ядерного слоя, которые напоминаю амакринные клетки. Напротив, в сетчатке мышей melanopsin экспрессируется рассеяно в слое ганглиолярных клеток и даже в немногих клетках в слое амакринных клеток (Provencio et al. 2000). Предполагается, что melanopsin м. экспрессироваться в
RPE/choroid глаз человека. Однако, эти результаты были получены путем RT-PCR и м.б. артефактом из-за загрязнений во время выделения (Provencio et al. 2000). Количество и локализация melanopsin, экспрессируемого генглиолярными и амакринными клетками в сетчатке мышей, указывают на то. что melanopsin экспрессируется в тех клетках сетчатки, которые дают проекции в suprachiasmatic nucleus (SCN) (Provencio et al. 1998a, 2000). Используя ретроградное мечение и гибридизацию
in situ было показано, что большинство RGCs, которые дают проекции в SCN у крыс, экспрессируют melanopsin (Gooley et al. 2001). Используя pituitary adenylate cyclase-activating polypeptide (PACAP), экспрессирующуюся в сетчатке исключительно в RGCs retinohypothalamic tract (RHT), установлено, что распределение melanopsin экспрессирующих клеток ко-локализуется с PACAP-содержащими RGCs (Hannibal et al. 2002). Hattar и др. (Hattar et al. 2002) продемонстрировали, что прирожденно фоточувствительные RGCs (Berson et al. 2002) экспрессируют melanopsin. Всё это указывает на то, что melanopsin в качестве нового фотопигмента обеспечивает photoentrainment у грызунов (Hattar et al. 2002).
У рыбок данио выявлен ортолог меланопсина
Xenopus и млекопитающих, который экспрессируется в глазах (Bellingham et al. 2002). Как отмечалось выше, фотопигментные опсины (напр., зрительные или VA) обладают приблизительно 40% идентичных аминокислот, тогда как члены семейства opsin обнаруживают более высокий уровень идентичности около 85%. Поразительно, что члены семейства melanopsin обнаруживают столь низкий уровень идентичности. Семь трансмембранных доменов мышиного melanopsin только на 58% идентичны Xenopus melanopsin, а меланопсин рыбок данио на 68% идентичен мышиному и на 56% идентичны Xenopus melanopsin. Это указывает на то, что независимо от этого функция меланопсина м. и не нуждаться в высокой консервации и что в этом отношении он заметно отличается от известных фотопигментных опсинов. Более того, melanopsin не обладает законсервированной геномной структурой как у фотопигментных опсинов. Его 9 мест вставки интронов не законсервированы, указывая тем самым на др. эволюционную ветвь, характерную для фотопигментных опсинов (Рис. 4).
Ciona opsin
Недавно выделен ген, сходный с геном позвоночных опсинов, из urochordate (оболочечных) Ciona intestinalis (Kusakabe et al. 2001). Несмотря на филогенетическую удаленность между urochordates и позвоночными, этот опсин обладает многими ключевыми признаками зрительных опсинов позвоночных, включая эквивалентные Lys-296, Glu-113, Cys-110 и Cys-187 и ERY триаду (Табл. 1). Более того, ген Ciona opsin 1 имеет 7 интронов (которые обозначены A-G), из которых 3 (C, E и G) консервативны 1, 3 и 4 интронам зрительных опсинов позвоночных (Рис. 4). Ciona opsin 1 экспрессируется в личиночных глазках (ocellus) этого организма, предполагается, что retinal белок ответственен за действие спектра на реакцию плавания (Kusakabe et al. 2001).
Discussion and conclusions
В первых двух разделах были представлены доказательства нового non-rod, non-cone opsin-based фотопигмента (OP479) в сетчатке млекопитающих, а в разделе "The opsins" описаны свойства различных членов семейства опсинов из G-coupled receptors.
Здесь мы возвратимся к вопросу выделен ли ген, кодирующий OP479, и если нет, то какого типа ген д. разыскиваться и где в глазах м. этот ген экспрессироваться? Berson et al. (2002) предоставили строгие доказательства того, что RGCs, дающие проекции в SCN, прирожденно фоточувствительны. Более того, действие спектра в отношении реакции на свет в этих RGCs сильно напоминает действие спектра на сократимость зрачка у rd/rd cl мышей и на предварительные результаты действия спектра на фазовый сдвиг циркадного ритма в отношении локомоторного поведения rd/rd cl мышей. Это указывает на то, что OP479 находится внутри этих фоточувствительных RGCs. Но какой же из опсиновых генов кодирует OP479?
Все из известных и охарактеризованных opsin-based семейств фотопигментов и зрительные (rod- и cone-opsins) и те. что ассоциированы с детекцией освещенности (P- и VA-opsins), обладают определенными критическими аминокислотными остатками (Табл. 1) и приблизительно 40% идентичных аминокислот по сравнению др. с др. (Табл. 2). Более того, структура этих опсиновых генов в основном законсервирована. Места вставок интронов 1, 3 и 4 законсервированы как в зрительных, так и non-visual описнах, хотя и имеются некоторые минорные отклонения. Место вставки интрона 2 сдвинуто в 3' направлении у VA- и P-opsin, а семейство LWS opsin имеет дополнительный интрон, обозначенный как 0 (Рис. 4). Эти результаты указывают на то, что функционально родственные молекулы опсинов обладают тесным филогенетическим родством на базе как высоких уровней идентичных аминокислот , так и в основном законсервированной геномной структуры. На этом основании м. предсказать, что parapinopsin (PP-opsin),
tmt-opsin и urochordate Ciona opsin 1 (Табл. 2, Рис. 4), все они обладают высокими уровнями идентичных аминокислот (~ 40%) и законсервированной геномной структурой, будут способны формировать функциональные фотопигменты. Но т.к. ни один из новых опсинов (P-, VA-, tmt-, PP- or Ciona-opsin 1) которые формируют или кажется, что д. формировать функциональные фотопигменты, не был выделен из млекопитающих, поэтому эти гены не м. рассматриваться как кандидаты на роль OP479 фоторецепторов. Существуют ли др. кандидаты?
Ясно, что не все белки, классифицируемые как "opsins" формируют фоточувствительные белки. Наиболее охарактеризованными из них являются RGR-opsins (Табл. 2, Рис. 4). RGR-opsin имеет критический Lys-296 retinal сайта прикрепления, но имеет гистидиновый остаток в позиции потенциального counterion. Этот опсин, по-видимому, функционирует как photoisomerase, связывающая all-
trans-retinal и генерирующая 11-
cis-retinal в пигментном эпителии (Hao and Fong 1999). Согласуется с этим и его не-фотосенсорная роль, RGR имеет относительно низкое аминокислотное сходство (Табл. 2) и не законсервированную геномную структуру (Рис. 4) по сравнению с охарактеризованными опсиновыми фотопигментами. Peropsin менее охарактеризован, чем RGR-opsin, но на базе его низкого уровня аминокислот с фотопигментными опсинами и его экспрессии в RPE, peropsin м.б. вовлечен в рециклинг retinal chromophore (Sun et al. 1997). Encephalopsin/panopsin (Табл. 2) находится в серой области в отношении предположений о его функции. Он имеет геномную структуру, общую фотопигментным опсинам (Рис. 4), но общий уровень идентичности аминокислот (~30%) ниже ожидаемого для фотопигментных опсинов. Кроме того, этот ген экспрессируется в очень многих тканях помимо глаз. Всё это в купе с наблюдениями, что у млекопитающих, по-видимому, отсутствуют какие-либо вне-глазные фоторецепторы позволяет предположить, что encephalopsin не кодирует фотопигмент и что он выполняет не установленную еще функцию.
Итак, единственным оставшимся кандидатом на роль фоторецептора OP479 остается melanopsin. Но насколько хорош этот кандидат? М. сказать, что melanopsin не является достаточно сильным кандидатом исходя из уровня идентичности. Он обладает примерно 27% идентичностью с известными фотопигментами позвоночных (Табл. 2). Более того, в отличие от семейства фотопигментных опсинов, члены семейства melanopsin обладают относительно низким уровнем идентичности. Мышиный melanopsin только на 58% идентичен с Xenopus melanopsin, a melanopsin рыбок данио на 68% идентичен мышиному и на 56% Xenopus melanopsin. Кроме того, геномная структура melanopsin не напоминает известные фотопигментные опсины позвоночных (Рис. 4). Эти свойства противоречат находка, описанным выше, что все из известных фотопигментов позвоночных обладают близкими филогенетическими взаимоотношениями. Но melanopsin м. представлять собой самостоятельную линию эволюции фотопигментов из некоторых предшественников беспозвоночных. В некотором смысле melanopsin напоминает фотопиогмент беспозвоночных (Provencio et al. 1998b, 2000). Напр., позиция Glu-113 counterion занята тирозиновым остатком, который обычно обнаруживается в этой относительной позиции в опсинах беспозвоночных (Bellingham et al. 1998). Но необходимы более строгие доказательства того, что melanopsin участвует в photoentrainment и что он экспрессируется в RGCs пути RHT (Gooley et al. 2001; Hannibal et al. 2002; Hattar et al. 2002) и что эти RGCs действительно непосредственно чувствительны к свету (Berson et al. 2002; Hattar et al. 2002). Имеется очень строгая корреляция, но необходима прямая демонстрация, что melanopsin действует как фотопигмент. Melanopsin м. играть роль, сходную с таковой RGR и действовать как photoisomerase. В этом случае следует ожидать, что melanopsin будет ко-экспрессироваться с еще неизвестным фотопигментом в RGCs млекопитающих.
In conclusion, we do not know which gene encodes
OP479 and are left with two broad alternatives. If we assume
that OP479 will be like all of the other vertebrate
photopigments (rod-, cone-, VA-, and P-opsins) and will
share a close phylogenetic relationship based upon both
high levels of amino acid identity and conserved genomic
structure, then an unidentified opsin exists which encodes
OP479. Alternatively, there may have been a distinct
line of photopigment evolution in the vertebrates
that has given rise to the melanopsin family. If true then
the mammalian melanopsin gene may encode OP479. Only
when melanopsin and other candidates for OP479 have
been functionally expressed, and shown to encode a photopigment
that matches the action spectrum of OP479,
can firm conclusions about the identity of the non-rod,
non-cone ocular photoreceptor of mammals be made.
Сайт создан в системе
uCoz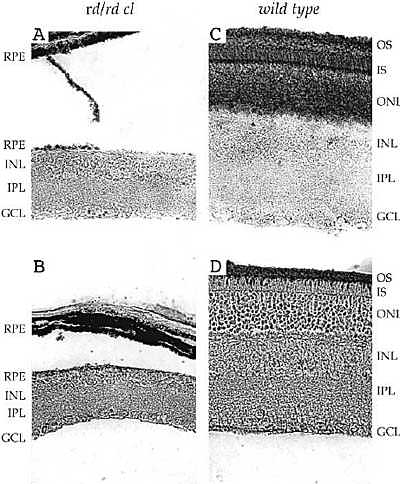 Fig. 1A-D Immunocytochemical analysis of retinae from
rd/rd cl mice. Introduction of the cl transgene into mice homozygous
for the rd mutation induced a retinal phenotype in mice 80 days of age that lacked both rod and cone cells. Tissue from rd/rd cl (A and B) and
wild type (C and D) was fixed with Bouin's fluid for 24 h, paraffin embedded and 8-µm sections treated with antisera ecognising rod (A and C),
rod/LWS cone (B and D) photoreceptors. Visualisation was accomplished using ABC methods (Vectastain Elite, Vector Labs.) (GCL ganglion cell layer, IPL inner plexiform layer, INL inner nuclear layer, ONL outer nuclear layer, IS inner segments, OS outer segments, RPE retinal pigment
epithelium). For full details, see Lucas et al. (1999)
Fig. 1A-D Immunocytochemical analysis of retinae from
rd/rd cl mice. Introduction of the cl transgene into mice homozygous
for the rd mutation induced a retinal phenotype in mice 80 days of age that lacked both rod and cone cells. Tissue from rd/rd cl (A and B) and
wild type (C and D) was fixed with Bouin's fluid for 24 h, paraffin embedded and 8-µm sections treated with antisera ecognising rod (A and C),
rod/LWS cone (B and D) photoreceptors. Visualisation was accomplished using ABC methods (Vectastain Elite, Vector Labs.) (GCL ganglion cell layer, IPL inner plexiform layer, INL inner nuclear layer, ONL outer nuclear layer, IS inner segments, OS outer segments, RPE retinal pigment
epithelium). For full details, see Lucas et al. (1999) 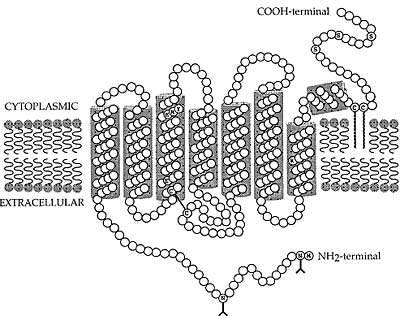 Fig. 2 A two-dimensional model of the rod-opsin molecule
(modified after Palczewski et al. 2000). Features include the retinal attachment site (K296) in the seventh transmembrane domain; the Schiff
base counterion (E113) in the third transmembrane domain; the disulphide bridge formed between C110 and C187; glycosylation sites (N2 and N15)
at the amino terminal; and palmitoylation sites (C322 and C323) at the carboxyl terminal. Also indicated are the ERY triad crucial for transducin binding and activation in the third transmembrane domain, and serine residues (S) in the carboxyl terminal which are phosphorylated by rhodopsin kinase inducing quenching of the phototransduction cascade
Fig. 2 A two-dimensional model of the rod-opsin molecule
(modified after Palczewski et al. 2000). Features include the retinal attachment site (K296) in the seventh transmembrane domain; the Schiff
base counterion (E113) in the third transmembrane domain; the disulphide bridge formed between C110 and C187; glycosylation sites (N2 and N15)
at the amino terminal; and palmitoylation sites (C322 and C323) at the carboxyl terminal. Also indicated are the ERY triad crucial for transducin binding and activation in the third transmembrane domain, and serine residues (S) in the carboxyl terminal which are phosphorylated by rhodopsin kinase inducing quenching of the phototransduction cascade 


