При раннем развитии гипофиза, когда зачаток локализуется по срединной линии переденей части нервного гребня и внутри кармана Ратке, клетки выглядят униформными. Эти гипофизарные клетки предшественники пролиферируют, увеличивая свою популяцию до начала дифференцировки. Ряд гомеодоменовых транскрипционных факторов — вклюая
— экспрессируется в этих клетках предшественниках гипофиза (Рис. 1).
Идентифицированы три bicoid-related Pitx транскрипционных фактора. Два из них,
Pitx1 и Pitx2, обнаруживают перекрывающиеся и самостоятельные паттерны экспрессии во время развития гипофиза. Ген
Pitx1 экспрессируется сначала в переденей части нервной пластинки, а позднее обнаруживает экспрессию во всей ротовой эктодерме, а затем и во всех типах гипофизарных клеток. Он экспрессируется также в первой бранхиальной дуге, носовом эпителии, слюных железах, двенадцатиперстной кишке и задних кончностях [6–8]. Целенаправленное разрушение гена
Pitx1 вызывает минорные дефекты в этой поздней фазе развития гипофиза, включая снижение экспрессии
FSHβ, LHβ и TSHβ, и усиление экспрессии
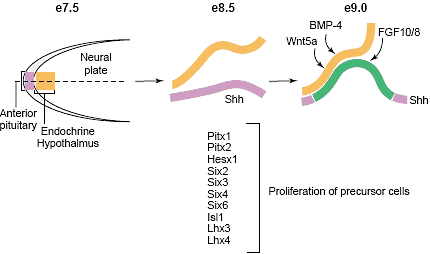 The most anterior neural ridge gives rise to primordia of pituitary and endocrine hypothalamus. An initial uniform oral ectoderm makes
direct contact with ventral diencephalon by e9.0 with Shh excluded from the Rathke’s pouch. The ventral diencephalon expresses BMP4,
FGF10/8 and Wnt5a which provide instructive cues for cell proliferation. Several homeodomain transcription factors expressed in the Rathke’s
pouch are required for expansion of the precursor cells which ultimately differentiate into six hormone-secreting cell types in a distinct spatial
and temporal order.
The most anterior neural ridge gives rise to primordia of pituitary and endocrine hypothalamus. An initial uniform oral ectoderm makes
direct contact with ventral diencephalon by e9.0 with Shh excluded from the Rathke’s pouch. The ventral diencephalon expresses BMP4,
FGF10/8 and Wnt5a which provide instructive cues for cell proliferation. Several homeodomain transcription factors expressed in the Rathke’s
pouch are required for expansion of the precursor cells which ultimately differentiate into six hormone-secreting cell types in a distinct spatial
and temporal order.
ACTH в передней части гипофиза. Такие мыши обнаруживают также дефекты в развитии задних конечностей и черепно-лицевом морфогенезе [9,10]. Отсутствие тяжелых дефектов в
Pitx1-/- гипофизе м приписать функциональному перекрыванию между
Pitx1 и Pitx2 [11,12].
Экспрессия
Pitx2 впервые выявляется на ст. Е8.5 в ротовой эктодерме и левой латеральной пластинке мезодермы. На ст. Е9.5
Pitx2 экспрессируется в кармане Ратке, а также в мезенхиме вблизи оптического возвышения, бранхиальных дугах, сердце [11,13–16].
Pitx2-/- мыши обнаруживают множественные онтогенетические дефекты, включая нарушения закрытия стенки тела, правый pulmonary isomerism, аномалии тракта оттока сердца и дефекты в органогенезе гипофиза, глаз и зубов [11,16–19]. В гипофизе инвагинация кармана Ратке и непосредственный контакт с нейроэпителием происходят нормально. Однако, развитие железы останавливается на ст. Е10.5 при этом выявляются лишь немногие POMC-позитивные клетки и не выявляется индукции
Pit1, указывая тем самым на то, что
Pitx2 необходим для экспансии предшественников и дифференцировки сразу же после образования предетерминировнного кармана. Дефекты как в гипофизе, так и в развитии тракта оттока объясняются неспособностью орган-специфичных клеток предшественников к пролиферации. Снижение пролиферации в гипофизе и уменьшение размеров железы обнаруживаются и у
Pitx1+/- Pitx2+/- и у Pitx1-/- Pitx2neo/neo (гипоморфный аллель Pitx2) эмбрионов, указывая на то, что Pitx1
и Pitx2 функционируют в одном и том же пути стимуляции клеточной пролиферации [11,12].
Недавние доказательства показали, что
Pitx2, благадорая сайтам альтернативной транскрипционной инициации, м.б. непосредственной нижестоящей мишенью для
TGF-β и Wnt/Dvl/β-catenin сигнальных путей [11,20]. Передача сигналов Wnt индуцирует связывание β-catenin и др. ко-активаторных комплексов с промотором
Pitx2 с сопутствующим устранением histone deacetylase 1 (HDAC1) ко-репрессорного комплекса[11,21]. Pitx2, в свою очередь, стимулирует экспрессию специфических генов, контролирующих клеточный цикл, включая
Cyclin D1, Cyclin D2 и c-Myc. Ген Pitx2 представляет собой , т.о., пример ткань-специфических транскрипционых факторов, необходимых для для пролиферации клеток предшественников (Рис. 2).
Pitx2 действует как непосредственно ранний ген с коротким периодом полу-жизни как мРНК, так и белка. Интересно, что белок Pitx2 м. ассоциировать с ко-регуляторными комплексами, которые контролируют оборот мРНК Pitx2 mRNA, также как и др. нестабильных мРНК, включая
c–Jun, Cyclin D1, и Cyclin D2. Т.о., уровни
Pitx2, также как и
Cyclin D1 и Cyclin D2, увеличиваются в ответ на активацию Wnt/β-catenin, включая контроль на обоих уровнях и транскрипции и стабильности РНК [22].
Специфические Wnts, которые регулируют
Pitx1 и Pitx2 во время развития гипофиза еще не выделены. Среди идентифицированных Wnts, кстати,
Wnt4 и Wnt5a, как известнро, экспрессируются во время развития гипофиза.
Wnt4 экспрессируется в кармане ратке, а
Wnt5a экспрессируется по всей вентральной части диэнцефалона. Интересно, что гипофизаный фенотип у
Wnt4-/- мышей сходен с таковым у
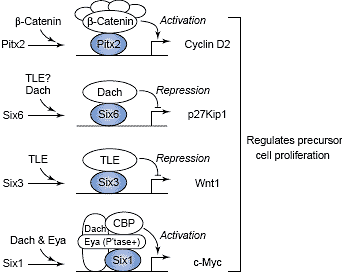 Models of distinct mechanisms by which transcription factors regulate cell proliferation in response to signaling events or by association with different cofactors. Pitx2: Wnt/b-catenin activation triggers the dismissal of corepressors including HDAC1 and recruitment of b-catenin and coactivators to the regulatory regions of cell cycle control genes, such as Cyclin D1, Cyclin D2 and c-Myc. Six6: binding of Six6 with Dach proteins, which in turn recruit corepressors N-CoR, HDAC3 and Sin3A via direct interaction, leads to the repression of targets genes such as cyclin-dependent kinase inhibitor p27Kip1. Members of the Tle family of corepressors have also been suggested in mediating Six6 function in regulating precursor cell proliferation. Six3: Six3 regulates precursor cell proliferation by physical association with Tle corepressors. One of the direct target genes repressed by Six3 is Wnt1. Both Six3 and Six6 do not interact with Eya proteins. Six1: recruitment of Eya phosphatase converts Six1/Dach from transcription repressors to activators by inducing the coactivators, including CBP, to the regulatory regions of targets genes, such as c-Myc, and therefore stimulating gene expression.
Pitx1+/- Pitx2+/-
Models of distinct mechanisms by which transcription factors regulate cell proliferation in response to signaling events or by association with different cofactors. Pitx2: Wnt/b-catenin activation triggers the dismissal of corepressors including HDAC1 and recruitment of b-catenin and coactivators to the regulatory regions of cell cycle control genes, such as Cyclin D1, Cyclin D2 and c-Myc. Six6: binding of Six6 with Dach proteins, which in turn recruit corepressors N-CoR, HDAC3 and Sin3A via direct interaction, leads to the repression of targets genes such as cyclin-dependent kinase inhibitor p27Kip1. Members of the Tle family of corepressors have also been suggested in mediating Six6 function in regulating precursor cell proliferation. Six3: Six3 regulates precursor cell proliferation by physical association with Tle corepressors. One of the direct target genes repressed by Six3 is Wnt1. Both Six3 and Six6 do not interact with Eya proteins. Six1: recruitment of Eya phosphatase converts Six1/Dach from transcription repressors to activators by inducing the coactivators, including CBP, to the regulatory regions of targets genes, such as c-Myc, and therefore stimulating gene expression.
Pitx1+/- Pitx2+/- мышей и характеризуется гипопластичностью железы с существенной редукцией терминально дифференцированного
Pit1 клона [11,23].
Wnt5a является существенным для роста многих эмбриональных структур. Однако, дефицит
Wnt5a вызывает лишь дисморфогенез гипофиза без нарушения др. аспектов развития гипофиза [24]. Являются ли
Wnt4, Wnt5a сами или вместе с др. членами семейства Wnt, функционально перекрывающимися в отношении регуляции
Pitx1 и Pitx2 ещё предстоит выяснить.
Hesx1 regulates pituitary proliferation
indirectly
Hesx1 является членом paired-like класса гомеодоменовых генов. Его экспрессия ограничена карманом Ратке на ст. Е9.5 и подавляется пространственно и во времни после Е12, это совпадает с прогрессивной дифференцировкой гипофизарных типов клеток [25,26]. Напротив, второй paired-like гомеодоменовый фактор, Prop-1, который необходим для детерминации четырех вентральных типов клеток, включая Pit-1 клоны и гонадотропы, обнаруживает реципрокную экспрессию [27]. Делеция
Hesx1 вызывает или полное отсутствие гипофиза (5%) или множественные инвагинации ротовой эктодермы и/или избыточную пролиферацию клеток всех гипофизарных клеточных типов [28–30]. При этом домен экспрессии
FGF8 и FGF10 увеличивается рострально в вентральной части диэнцефалона, приводя к эктопической индукции
Lhx3 и образованию добавочных гипофизарных желез, что согласуется с ролью передачи сигналов FGF в пролиферации и развитии гипофиза [23,31–33].
Hesx1 является репрессором транскрипции, имея два репрессорных домена, расположенных в N-терминальной и гомеодоменовой областях [27,30,34]. N конец Hesx1 содержит высоко консервативный eh1 мотив, необходимый для рекрутирования Tle (transducin-like enhancer of split) ко-репрессора [30].
Tle1 обладает сходным пространственным и временным паттерном экспрессии с Hesx1 в кармане Ратке. Избыточная экспрессия
Hesx1 и Tle1 в кармане Ратке приводит к почти полному отсутствию Prop-1 клона, хотя экспрессия
Prop-1 и POMC поддерживается. Мутации, которые устраняют специфическое взаимодействие между Hesx1 и Tles, не способны воспроизводить этот фенотип. Т.о., взаимодействие между Hesx1 и Tle1 или др. членами семейства Tle необходимо для функционирования Hesx1 [30]. Идентификация гомозиготных мутаций в мотиве eh1
Hesx1 у пациента с комбинированным недостатком гипофизарных гормонов подчеркивает эндогенную функцию Hesx1 как транскрипционного репрессора за счет рекрутирования Tle ко-репрессоров [35].
Помимо
Tle1, три др. члена семейства Tle,
Tle3, Tle4 и Aes, экспрессируются во время развития гипофиза.
Tle3 впервые выявляется в вентральной части диэнцефалона и позднее ограничивается промежуточной долей.
Tle4 экспрессируется в развивающейся воронке и задней доле и затем уменьшается на Е16.5. Эндогенные функции
Tle1, Tle3 и Tle4 во время развития гипофиза пока неизвестны.
Aes экспрессируется временно в дорсальной части кармана Ратке и выполняет роль по моделированию морфологии гипофизарной железы [36].
Six6 controls tissue-specific precursor
proliferation by repressing cyclin-dependent
kinase inhibitors
Третье семейство гомеодоменовых факторов, экспрессирующихся в клетках предшественников, это семейство Six, которое использует самостоятельные механизмы для регуляции пролиферации. Гены
Six являются гомологами у млекопитающих гена
Drosophila sine oculis (so), который играет существенную роль в собственно развитии всей зрительной системы. Исследования на
Drosophila и млекопитающих показали, что synergistic и регуляторная сеть, состоящая из
eyeless/Pax6,
so, eyes absent/Eya и
dachshund/Dach необходима для фофрмирования глаз и ранней детерминации глаз.
Six1, Six3, Six4, и Six6 экспрессируются во время развития гипофиза. Six3 и Six6, как было установлено, стимулируют пролиферацию оптического нейроэпителия при избыточной экспрессии в разных модельных системах [37–40]. Six3 и Six6 функционируют в качестве репрессоров транскрипции и соединяются с членами Tle репрессоров посредством eh-1-подобного мотива, расположенного в Six домене. Мутации в
Six3 и Six6, которые устраняют взаимодействие с Tle корепрессором, обусловливают также дефекты, индуцируя образование гиперпластинчой сетчатки [37,41,42], указывая тем самым. что Six3 и Six6 м. регулировать клеточную пролиферацию путем репрессии ингибиторов клеточного цикла.
Six6 экспрессируется в виде дорсо-вентрального градиента на ранних стадиях развития гипофиза. Делеция
Six6 обусловливает гипопластичность гипофиза и сетчатки с редуцированными количествами терминально дифференцированных клеток из-за дефектов пролиферации. Ингибиторы Cyclin-зависимых киназ, включая p27Kip1 и p19Ink4d, усиливают свою активность в
Six6-/- сетчатке [43]. Соотв., избыточная экспрессиия p27Kip1 в сетчатке, как было установлено, вызывает преждевременный выход из клеточного цикла [44]. Six6 также физически взаимодействует с Dach белками, которые обнаруживают сходство структуры и последовательностей с ко-репрессорами Ski и Sno [45,46], и усиливают обусловленную Six6 репрессию за счёт непосредственной ассоциации с ко-репрессорами HDAC3, N-CoR и Sin3A/B. Six6 и Dach2 физически оккупируют промотор p27Kip1, указывая тем самым, что p27Kip1 является непосредственной мишенью для Six6 [43]. Учитывая, что Six6 и Six3 непосредственно взаимодействуют с членами семейства Tle и что экспрессия
Tle1 и Aes перекрывается с таковой
Six3 и Six6 [30,36,41,42], интересно бы выяснить взаимодействия между разными ко-репрессорами и функционируют ли члены семейства Tle также в регуляции экспрессии p27Kip1.
Близкий гомолог Six6, Six3 экспрессируется в наиболее передней части развиваюшщейся нервной пластинки и позднее ограничивается клетками предшественниками сетчатки и гипофизом [47]. Характеристика
Six3-/- эмбрионов показала, что
Six3 необходим для формирования ростральной части переднего мозга за счет непосредственной экспрессии Wnt1 [48]. Из-за дефектов формирования переднего паттерна, ассоциированных с потерей функции Six3, выявляются специфические потребности в Six3 для пролиферации клеток предшественников гипофиза и сетчатки. Интригует иной молекулярный механизм действия Six3, который не зависит от регуляции транскрипции, и связан с его прямой ассоциацией с Geminin, белком, который ингибирует лицензирование репликации, ингибирует высвобождение Cdt1 от Geminin и тем самым делеат возможной активацию пролиферации [49,50].
Six1 and Eya modulate precursor cell
proliferation in multiple organs
Six1 экспрессируется во многих эмбриональных примордиальных структурах, включая карман Ратке, нефрогенные тяжи и сомиты [51,52,53]. Делеции в гене
Six1 вызывают дефекты в большинстве органов, где экспрессируется
Six1, которые характеризуются или отсутствием или заметным снижением размеров [54–58]. Эти дефекты возникают во время ранних стадий органогенеза и являются результатом снижения клеточной пролиферации и повышенного апоптоза [53,56,57].
CMyc, Gdnf и Six2 подавляются в мышцах конечностей и почках у эмбрионов
Six1-/- и оба Six1 и Eya1/3 рекрутируются на регуляторные области
c-Myc и Gdnf,
указывая тем самым, что они являются непосредственными транскрипционными мишенями Six1 [53]. Недавно, cyclin A1 также был идентифицирован как непосредственная мишень для Six1 в молочных железах и в клетках карцином молочных желез, указывая на др. связь между Six1 и ходом клеточного цикла [58].
Один Six1 репрессирует свои гены-мишени и эта репрессия усиливается с помощью Dach1 и ревертируется с помощью Eya3, указывая, что Eya белки м. конвертировать Six1 и Dach1 из репрессоров в транскрипционные активаторы [53]. Как белки Eya запускают подобное переключение? Eya белки содержат высоко консервативные С-терминальные области, известные как Eya домены, которые обеспечивают взаимодействия с Six и Dach, а также слобо законсервированные N-терминальные области, которые способны функционировать как транскрипционные активаторы [59–61,62]. Установлено. что Eya белки являются прирожденными tyrosine/serine protein phosphatases [53,63,64]. Мутантные Eya белки с нарушенной фосфатазной активностью по существу неспособны восстанавливать нормальное формирование глаз у ‘eyeless’ мух, у которых отсутствует функциональный Eya, и индуцировать образование эктопических глаз [63,64]. Более того, мут антный Eya3 не способен восстанавливать Six1-обусловленную репрессию из-за неспособности рекрутировать ко-активаторы, включая CREB binding protein
(CBP), и роспуска ко-репрессоров. Всё это указывает на то, что фосфатазная активность необходима для фугкционирования белков Eya, но субстраты, фосфорилируемые с помощью белков Eya, неизвестны [53].
Эти факторы, безусловно, осуществляют генетические взаимодействия в предопределении размеров органов. Делеции или
Six1 или
Eya1 не вызывают изменений фенотипа гипофиза. Однако, у
Six1-/- Eya1-/- эмбрионов гипофизы в ~5–10 раз меньше, чем железы дикого типа. Кроме того, имеется полное отсутствие всех hypaxial мышц и тяжелое уменьшение epaxial мышц у
Six1 или
Eya1 не вызывают изменений фенотипа гипофиза. Однако, у
Six1-/- Eya1-/- мутантов. Эти данные подтверждают, что Six1 и др. члены семейства Six выполняют перекрывающиеся функции в этих тканях..
Six4, который взаимодействует с белками Eya, скорее всего является кандидатом, т.к.
Six1 и Six4 обнаруживают очень сходные паттерны экспрессии, хотя делеция Six4 не вызывает видимого фенотипического отклонения [53,65,66].
Isl1, Lhx3, and Lhx4 control proliferation,
survival and organ commitment of
pituitary gland
LIM гомеодоменовые белки характеризуются двумя тандемно повторенными LIM мотивами. Три LIM гомоедоменовых фактора, Lhx3, Lhx4 и Isl-1, экспрессируются в кармане Ратке. Экспресссия
Lhx3 впервые выявляетс я на Е9.5 в развивающемся кармане и персистирует преимущественно в передней и промежуточной долях взрослого гипофиза [67]. Целенаправленное разрушение гена
Lhx3 показало, что Lhx3 является существенным для пролиферации и дифференцировки почти всех гипофизарных клеточных клонов и для прогрессии кармана Ратке во время органогенеза [68]. Однако, лежащие в основе молекулярные механизмы в основном не известны. Были попытки найти нижестоящие мишени Lhx3. Исследовнаия на ст. Е12.5 карманов Ратке дикого типа и
Lhx3-/- идентифицировали
Thg-1pit и PP2Ca-2 в качестве новых мишеней Lhx3. Thg-1pit является членом семейства TSC-22/DIP/bun, а паттерн его экспрессии в гипофизе совпадает с
Lhx3. PP2Ca-2 является новой изоформой PP2Ca, которая принадлежит к семейству генов, кодирующих Mg
2+-зависимые protein phosphatases. Функции этих Lhx3 мишеней в органогенезе гипофиза и являются ли они посредниками в действиях Lhx3 неизвестны [69,70].
Lhx4 также экспрессируется в мнвагинирующем кармане на Е9.5. В противоположность
Lhx3, который экспрессируется повсюду у взрослых, экспрессия
Lhx4 оказывается ограниченной будущей передней долей гипофиза и снижается на Е15.5. Делеция
Lhx4 обусловливает гипоплазию гипофиза с повышенной гибелью клеток и снижением количества разных типов клеток, это указывает на то, что
Lhx4 необходим для пролиферации и выживания клеток предшественников [71,72]. В дополнение к самостоятельным ролям
Lhx3 и Lhx4 в органогенезе гипофиза, Lhx3 и Lhx4 действуют перекрывающимся способом при контроле за формированием окончательного кармана. У
Lhx3-/-Lhx4-/- мышей инициальная инвагинация ротовой эктодермы происходит нормально. Однако, карман не способен расти далее после Е12.5, а на Е15.5 весь рудимент кармана выталкивается обратно по направлению к ротовой полости, т.к. хрящ клиновидной кости растет вдоль основания головного мозга [71].
Несколько предшествуя экспрессии
Lhx3 и Lhx4,
Isl1 первоначально экспрессируется в ротовой эктодерме, лежащей под вентральной частью диэнцефалона и на Е9.5 он экспрессируется во всем кармане Ратке/ На Е10.5, однако, экспрессия
Isl1 ограничивается вентральной частью кармана. Экспрессия
Isl1 репрессируется с помощью FGFs и индуцируется с помощью BMP2, противоположные дорсальный и вентральный сигнальные градиенты оказываются критическими для развития гипофиза [23,31]. Делеция Isl1 обусловливает эмбриональную летальность на ~Е10. На Е9.5 у
Isl1-/- эмбрионов карманы формируются, но остаются примитивными, а стенка кармана более тонкой, это указывает на то. что Isl1 необходим для пролифереции клеток предшествнников гипофиза [73]. Сходная функция Isl1 была обнаружена в раннем развитии сердца [74]. Количество FGFs и BMPs подавляется в
Isl1-/- сердце, указывая тем самым, что они м.б. ниже стоящими мишенями для Isl1. Регулирует ли Isl1 также и FGFs и BMPs во время развития гипофизаt неизвестно.
Conclusions and future direction
Early pituitary development requires a combinatorial
strategy for achieving appropriate expansion of the precursor
cell pool that is required for normal organogenesis.
The proliferation of pituitary precursor cells is
controlled by a number of tissue-specific factors, acting
to either repress inhibitors of cell cycle or to activate
growth stimulators, and which are required to set the
correct number of cell cycles. Thus, general regulators of
cell-cycle control are modulated in a tissue-specific
fashion, presumably because they contain cassettes of
binding sites for factors expressed or modulated in a celltype-
specific fashion. For example, Pitx2 is required in
those tissues where it is expressed for regulating Cyclin
D1 expression, implying analogous actions of functionally
comparable factors in other tissues. The linkage
between general proliferation control machinery and
cell-restricted DNA binding factors is further illustrated
by the relationship between Geminin and homeodomain
factors. Regulation of expression of genes encoding
signaling molecules by these tissue-restricted factors
is an additional strategy critical for setting organ size
prior to the subsequent programs dictating cell-type
determination. Delineating the roles of other signaling
pathways and the targets of each regulators, as well as
substrates for Eya phosphatase should provide further
insights.
Сайт создан в системе
uCoz  The most anterior neural ridge gives rise to primordia of pituitary and endocrine hypothalamus. An initial uniform oral ectoderm makes
direct contact with ventral diencephalon by e9.0 with Shh excluded from the Rathke’s pouch. The ventral diencephalon expresses BMP4,
FGF10/8 and Wnt5a which provide instructive cues for cell proliferation. Several homeodomain transcription factors expressed in the Rathke’s
pouch are required for expansion of the precursor cells which ultimately differentiate into six hormone-secreting cell types in a distinct spatial
and temporal order.
The most anterior neural ridge gives rise to primordia of pituitary and endocrine hypothalamus. An initial uniform oral ectoderm makes
direct contact with ventral diencephalon by e9.0 with Shh excluded from the Rathke’s pouch. The ventral diencephalon expresses BMP4,
FGF10/8 and Wnt5a which provide instructive cues for cell proliferation. Several homeodomain transcription factors expressed in the Rathke’s
pouch are required for expansion of the precursor cells which ultimately differentiate into six hormone-secreting cell types in a distinct spatial
and temporal order.  Models of distinct mechanisms by which transcription factors regulate cell proliferation in response to signaling events or by association with different cofactors. Pitx2: Wnt/b-catenin activation triggers the dismissal of corepressors including HDAC1 and recruitment of b-catenin and coactivators to the regulatory regions of cell cycle control genes, such as Cyclin D1, Cyclin D2 and c-Myc. Six6: binding of Six6 with Dach proteins, which in turn recruit corepressors N-CoR, HDAC3 and Sin3A via direct interaction, leads to the repression of targets genes such as cyclin-dependent kinase inhibitor p27Kip1. Members of the Tle family of corepressors have also been suggested in mediating Six6 function in regulating precursor cell proliferation. Six3: Six3 regulates precursor cell proliferation by physical association with Tle corepressors. One of the direct target genes repressed by Six3 is Wnt1. Both Six3 and Six6 do not interact with Eya proteins. Six1: recruitment of Eya phosphatase converts Six1/Dach from transcription repressors to activators by inducing the coactivators, including CBP, to the regulatory regions of targets genes, such as c-Myc, and therefore stimulating gene expression.
Models of distinct mechanisms by which transcription factors regulate cell proliferation in response to signaling events or by association with different cofactors. Pitx2: Wnt/b-catenin activation triggers the dismissal of corepressors including HDAC1 and recruitment of b-catenin and coactivators to the regulatory regions of cell cycle control genes, such as Cyclin D1, Cyclin D2 and c-Myc. Six6: binding of Six6 with Dach proteins, which in turn recruit corepressors N-CoR, HDAC3 and Sin3A via direct interaction, leads to the repression of targets genes such as cyclin-dependent kinase inhibitor p27Kip1. Members of the Tle family of corepressors have also been suggested in mediating Six6 function in regulating precursor cell proliferation. Six3: Six3 regulates precursor cell proliferation by physical association with Tle corepressors. One of the direct target genes repressed by Six3 is Wnt1. Both Six3 and Six6 do not interact with Eya proteins. Six1: recruitment of Eya phosphatase converts Six1/Dach from transcription repressors to activators by inducing the coactivators, including CBP, to the regulatory regions of targets genes, such as c-Myc, and therefore stimulating gene expression.