Др. не-эпителиальные ткани обладают вариациями этой основной темы (см. [3]). Напр., deep нейральные клетки эмбрионов
обладают 'monopolar' активностью образования выпячиваний [1], a рыхло организованные мезодермальные ткани гаструлы рыбок данио мигрируют как скоординированные индивиды. Компьютерная трассировка по вычерчиванию траекторий индивидуальных клеток предоставляет наглядное зрительное подтверждение, что последнее движение очень сходно с тем, что имеет место у амфибий [5].
Planar cell polarity. . .and more
Механизмы сигнальной трансдукции, которые позволяют глубоким клеткам перестаиваться, доминируют в последних работах. Как Wnt/Ca
2+ так и пути planar cell polarity (PCP)регулируют клеточную поляризацию во время CE, по-видимому, путем взаимодействия с событиями в параксиальной мезодерме, обусловленные частично paraxial protocadherin (PAPC) (rev.
[2,6,7]). Помимо Slb/Wnt11, Ppt/Wnt5 регулирует клеточную элонгацию и ориентацию филоподий в глубоких клетках рыбок данио [8,9], подтверждая, что перестраивающиеся клетки отвечают на множественные Wnts. Несколько путей скорее всего интегрируют нижестоящие Wnts в перестаивающихся клетках. Напр., Protein kinase C δ влияет на локализацию и фосфорилирование Dishevelled (Dsh) в союзе с Wnt сигналовм во время CE у
Xenopus [10]. Dsh, в свою очередь, м. активировать Wnt/Ca
2+ и PCP пути посредством своего DEP домена, указывая тем самым, что пути м. действовать совместно [11]. Показано, что Prickle, PCP белок, регулирует гаструляционные движения [12-14]. Безусловным препятствием такой клеточной сигнализации м.б. альтерации цитоскелета, в недавней работе было предположено, что Rac и Rho действуют в параллельных путях, ниже Dsh, чтобы активировать JNK путь и модулировать сборку актина,
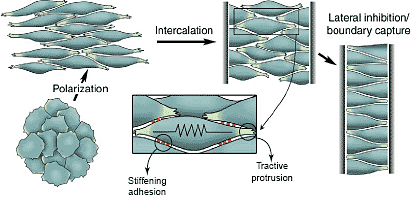 Convergent extension in deep cells. A cartoon depicting the major motile events during convergent extension (CE) of dorsal axial mesoderm in Xenopus. Initially, cells show largely random protrusive activity. At the onset of CE, cells orient their protrusions mediolaterally, become bipolar, and intercalate between their neighbors. Cells continue to intercalate until they reach the lateral boundary with presumptive somitic mesoderm, where protrusive activity ceases. Cells in the notochord continue to converge until their mediolateral edges each make contact with the boundary ('boundary capture'). As the cells converge, the tissue extends along the forming A-P axis. Inset: the Keller cell-cell traction model of intercalation. CE must maintain rigidity within the tissue, while individual cells retain the ability to migrate between neighboring cells. 'Stiffening adhesions' (red) are temporary regions of adhesion between cells that allow the tissue to retain structure, but can be easily broken or reformed as cells migrate between each other. 'Tractive protrusions' consist of mediolaterally directed filopodia that adhere to neighboring cells with enough force to pull cells between one other. (Adapted from drawings courtesy of R Keller, with permission.)
Convergent extension in deep cells. A cartoon depicting the major motile events during convergent extension (CE) of dorsal axial mesoderm in Xenopus. Initially, cells show largely random protrusive activity. At the onset of CE, cells orient their protrusions mediolaterally, become bipolar, and intercalate between their neighbors. Cells continue to intercalate until they reach the lateral boundary with presumptive somitic mesoderm, where protrusive activity ceases. Cells in the notochord continue to converge until their mediolateral edges each make contact with the boundary ('boundary capture'). As the cells converge, the tissue extends along the forming A-P axis. Inset: the Keller cell-cell traction model of intercalation. CE must maintain rigidity within the tissue, while individual cells retain the ability to migrate between neighboring cells. 'Stiffening adhesions' (red) are temporary regions of adhesion between cells that allow the tissue to retain structure, but can be easily broken or reformed as cells migrate between each other. 'Tractive protrusions' consist of mediolaterally directed filopodia that adhere to neighboring cells with enough force to pull cells between one other. (Adapted from drawings courtesy of R Keller, with permission.)
соотв. [15,16]. Такая активность по формированию выпячиваний м. модулироваться с помощью MARCKS, связанного с мембраной и связывающего актин белка, который м. действовать ниже Rho [17]. Аннулирование передачи сигналов Wnt снижает CE, но не устраняет его, указывая тем самым, что др. параллельные пути оперируют с поляризованными глубокими клетками. В самом деле, platelet-derived growth factor (PDGF) и phosphoinositide 3-kinase (PI3K) необходимы для формирования филоподий и клеточной поляризации во время ранней1 гаструляции рыбок данио [18]. Учитывая широкое распределение PDGF у эмбрионов, путь PDGF/PI3K м.б. пермиссивным для поляризации, тогда как Wnt сигналы стабилизируют и обогащают локальную полярность.
What polarizes deep cells?
У
Xenopus и рыбок данио формирование дорсовентрального паттерна обусловливает дорсовентральные различия в protrusive активности глубоких клеток (rev. [3,19]); как поляризующие сигналы пространственно организованы локально, однако, остаётся неясным. У
Xenopus,
Keller et al. считают, что 'boundary capture' происходит когда дорсальная мезодерма завершает свою перестройку (Рис. 1; см [3]). В этой модели граница между презумптивными клетками хорды и сомитной мезодермой ингибирует protrusive поведение. Интересно, что extracellular matrix (ECM), содержащий fibrillin м. создавать этот ингибирующий барьер [1]. Насколько широко распространено такой механизм неясно, т.к. многие перестраивающиеся клетки лишены очевидных структурных границ. Локальные аттрактивные наводящие сигналы м. играть роль в поляризации монополярных нейральных глубоких клеток, исходя из микрохирургического удаления или добавления клеток дорсальной срединной линии у
Xenopus [20]. Молекулы, обеспечивающие такие аттрактивные сигналы, остаются
How do deep cells rearrange?
Будучи поляризованными клетки д. менять позицию, тогда как оставшиеся ригидными достаточны, чтобы продуцировать силы, приводящие в результате к extension. На базе морфологических наблюдений [2], Keller et al. предложили модель, которая балансирует эти ключевые свойства перестраивающихся глубоких клеток [3]. Они предположили, что перестраивающиеся клетки используют как 'tractive protrusions' (медиолатеральные выпячивания, которые натягивают соседние клетки), так и
'stiffening adhesions' (временные связи, создающие ригидность, когда соседи интеркалируют; Рис. 1). Вызывающая отвердение слипчивость (stiffening adhesions) д. оставаться достаточно лабильной, чтобы позволять ремоделирование в ответ на силы растяжения, генерируемые с помощью вытягивающихся в длину выпячиваний.
Хотя молекулярные компоненты, делающие возможными такие контакты, неизвестны, но молекулы межклеточной адгезии д. участвовать. В самом деле, уровни C-cadherin являются критическими для нормальной перестройки [21], но вплоть до недавнего времени integrins не считались важными для глубокой клеточной перестройки. Однако, Marsden and DeSimone показали, что разрушение базирующейся на интегринах адгезии снижает CE дорсальной мезодермы и биполярную ориентацию перестраивающихся клеток [22]. Такие воздействия вмешиваются в зависимую от C-cadherin клеточную сортировку, указывая тем самым, что интегриновая и кадхериновая системы м. взаимодействовать во время CE. При внимательной проверке глубокие клетки оказываются окруженными fibronectin (FN)-содержащим ECM [22];
in vivo микроскопия показала, что т.к. перестраивающиеся глубокие клетки интеркалируют, то они несут с собой прикрепленный к ним FN (R Keller,
personal communication). М. предположить, что FN необходим для for тягловых выпячиваний и что повышение жесткости адгезий происходит с использованием cadherins. Однако, имеется много др. путей, с помощью которых эти взаимодействующие системы слипчивости м.б. приведены в действие.
Epithelial cell rearrangement: additional
challenges, additional mechanisms
Эпителиальные клетки также м. перестраиваться, но они сталкиваются с дополнительными задачами поддержания высоко организованных junctional
соединений и апикально-базальной полярности во время перестройки [23]. Во многих случаях перестройка является результатом сил, продуцируемых самими перестраивающимися клетками, так как это происходит при удлинении нервной пластинки во время нейруляции у позвоночных (rev.
[24]). Потенциально новым примером CE является нейроэпителий Кортиева органа во внутреннем ухе [25]. Без сомнения и морфогенез внутреннего уха и нейруляция нуждаются в передаче сигналов PCP [24]; на это указывает связь мутантных мышей с дефектами нервной трубки с PCP ортологом, Celsr1/Flamingo [26]. Хотя передача сигналов PCP м. служить для ориентации нейроэпителиальных клеток у позвоночных, имеется множество др. примеров перестройки эпителиальных клеток, не связанной с пердачей сигналов PCP, включая archenteron морских ежей (rev. [27]), зародышевый диск
Drosophila [28], заднюю кишку [29] и stigmatophore [30],
Caenorhabditis elegans дорсальный эпидермис [31,32] и кишечник [33], и зачаток хорды у асцидий [34] (хорда использует PCP сигналы, как только её клетки интернализуются [35]). Генетические доказательства, полученные на
Drosophila [36] и на C.
elegans (T Walston, J Hardin, unpublished) показывают, что передача сигналов PCP посредством Dsh м. в лучшем случае играть лишь минимальную роль в ориентации клеток в этой системе.
What polarizes epithelial cells?
Недавние исследования подтвердили, что, по крайней мере, существует три др. пути, с помощью которых перестраивающиеся эпителиальные клетки м. становиться поляризованными (Рис. 2). В кишке
Drosophila Upturned,
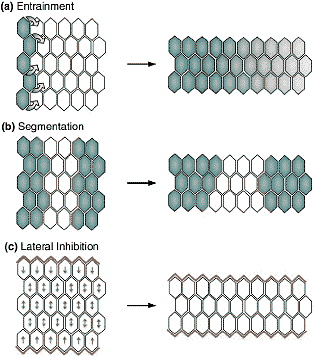 Рис. 2. Models for polarization of rearranging epithelial cells. (a) Entrainment. In this model, based on work in [37], cells at one end of the sheet secrete a diffusible factor that is distributed in a gradient across the sheet. The growth-factor gradient leads to polarization and CE of all cells in the sheet. (b) Segmentation. In this model, based on germ band extension in Drosophila [28,36], the expression of the pair-rule genes establishes narrow segmental regions along the A-P axis, spanning one, or a few, cell diameters. During CE, cells remain within their segmental compartments and only intercalate with 'like' cells, presumably employing bipolar asymmetries at their A-P and dorsoventral edges. (c) Lateral inhibition. This model is suggested by work in C. elegans [32]. An array of intercalating cells is bounded on its lateral edges by either a physical or a molecular barrier. As intercalation begins, cells are free to migrate mediolaterally, but cells in contact with the boundary only retain the ability to migrate in a monopolar manner away from the boundary.
Рис. 2. Models for polarization of rearranging epithelial cells. (a) Entrainment. In this model, based on work in [37], cells at one end of the sheet secrete a diffusible factor that is distributed in a gradient across the sheet. The growth-factor gradient leads to polarization and CE of all cells in the sheet. (b) Segmentation. In this model, based on germ band extension in Drosophila [28,36], the expression of the pair-rule genes establishes narrow segmental regions along the A-P axis, spanning one, or a few, cell diameters. During CE, cells remain within their segmental compartments and only intercalate with 'like' cells, presumably employing bipolar asymmetries at their A-P and dorsoventral edges. (c) Lateral inhibition. This model is suggested by work in C. elegans [32]. An array of intercalating cells is bounded on its lateral edges by either a physical or a molecular barrier. As intercalation begins, cells are free to migrate mediolaterally, but cells in contact with the boundary only retain the ability to migrate in a monopolar manner away from the boundary.
секретируемый белок, который действует посредством JAK/STAT пути, экспрессируется в тонком кишечнике, но действует клеточно не автономно, чтобы регулировать CE движения в зачатке задней кишки (Рис. 2a; [37]). Очевидно, что униформная экспрессия
upturned или активированного JAK рецептора, hopscotch, не может стимулировать правильное CE, это указывает на то, что градированное распределение Upturned, a , следовательно, и активности STAT внутри чувствительных клеток, необходимо для организации правильных перемещений [37]. Как локальная продукция секретируемого белка м. давать в результате униформную перестройку клеток на разных расстояниях от сигнала, неизвестно.
Второй механизм, который м. поляризовать перестраивающиеся эпителиальные клетки, предположен в работе по системе формирования anterior-posterior (A-P) паттерна у
Drosophila, где гены типа pair rule
eve и runt транскрипционно регулируют увеличение зародышевого диска (Рис. 2b; [28]). Zallen and Wieschaus показали, что система A-Pведет к асимметричной локализации белков вдоль A-P краев клеток в зародышевом диске, включая myosin II и эктопически экспрессируемый белок Slam, вместе с одновременной дорсовентральной локализацией Bazooka/PAR-3. Границы, по которым выявляются различия в экспрессии генов pair rule, необходимы и достаточны для индукции такой биполярности [36]. Как формирование A-P паттерна ведет к такой субклеточной асимметрии неизвестно, но оно м. приводить к обменам с соседями внутри зародышевого диска.
Третья возможность заключается в том, что эпителиальные клетки перестраиваются в ответ на латеральную ингибицию (Рис. 2c). Пока нет четких доказательств для такого механизма поляризации в эпителиальных клетках. Однако, дорсальные эпидермальные клетки у
C. elegans обладают значительно меньшей активностью по выпусканию выпячиваний на границе с латеральными эпидермальными клетками, а когда их медиаьные кончики достигают оппозитной латеральной границы, то они подвергаются сходной редукции подвижности [32]. Эти наблюдения указывают на существование ингибирующих сигналов, но далеки от экспериментального подтверждения.
How do epithelial cells rearrange
Как эпителиальные клетки физически меняют своё положение, изучено недостаточно. Ранние модели представляли себе или контрактильные элементы, ассоциированные с апикальными соединительными доменами или 'cortical tractor', вовлекаемый в базальные выпячивания, который тянется апикально, одновременно проталкиваясь между соседними клетками и доставляя белки к местам ремоделирования соединений (rev. [23]). Однако, выпячиваний, согласующихся с моделью тягача, не выявлено. Вместо этого в archenteron морских ежей [27], зачатке ходы асцидий [34] и дорсальном эпидермисе
C. elegans [31], присутствуют базолатеральные выпячивания, которые подобно биполярным выпячиваниям глубоких клеток, ориентированы в направлении клеточного движения (Рис. 3). У
C. elegans такие выпячивания предшествуют продвижению вперед апикальной поверхности [31]. Ремоделируются ли лежащие поверх соединения пассивно в ответ на базолатеральные события или за счет возникновения апикальных натяжений, неизвестно.
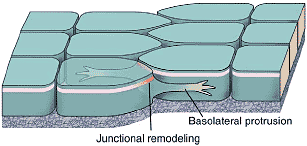 Рис. 3. Basolateral protrusive behavior during epithelial cell rearrangement.
Although the diagram is based on work in C. elegans [31,32], similar
protrusions have been seen in other systems [27,34]. Rearranging
cells extend basolateral protrusions that initiate intercalation. As
intercalation proceeds, apical junctional complexes (pink) must be
remodeled (red) as new junctional boundaries are created with
neighboring cells.
Рис. 3. Basolateral protrusive behavior during epithelial cell rearrangement.
Although the diagram is based on work in C. elegans [31,32], similar
protrusions have been seen in other systems [27,34]. Rearranging
cells extend basolateral protrusions that initiate intercalation. As
intercalation proceeds, apical junctional complexes (pink) must be
remodeled (red) as new junctional boundaries are created with
neighboring cells.
Это независимо от того, использует ли ремоделирование соединений преимущественно инсерцию нового junctional материала или передислокацию существующих соединительных частиц (Рис. 3). Базолатеральные выпячивания не наблюдаются в зародышевом диске
Drosophila [36], это указывает на то, что м. существовать и др. не охарактеризованные механизмы, обусловливающие перестройку эпителиальных клеток.
Как базолатеральные выпячивания м. обусловливают изменения соседних клеток? Наиболее вероятно, что такие выпячивания, если они генерируют силы, делают это благодаря осуществлению непосредственного давления на соседние клетки или подлежащий ECM, скорее, чем проталкиваясь. Важно, что у
C. elegans белки ECM не нужны для дорсальной интеркаляции в эпидермисе(rev. [38]), подтверждая, что выпячивания, если они обладают силой, то действуют непосредственно на соседние клетки.
Апикальные поверхности клеток также м. играть важную роль в перестройке. Так многоклеточные трахейные трубки у
Drosophila ремоделируются, клетки меняют свое положение, чтобы создать одноклеточные тубулярные элементы, соединенные конец-в-конец. Мутации в ZP домене секретируемого белка Piopio и в трансмембранном ZP белке Dumpy приводят к потере соединений между этими одноклеточными элементами, подтверждая, что комплекс внутри просвета из Piopio и Dumpy м. помогать стабилизировать слипчивые соединения [39]. Сходные фенотипы с разсоединением возникают, когда избыточно стимулирована активность Rac в трахейных клетках и это сопровождается потерей cadherin из соединений. Снижение Rac активности приводит к избыточному накоплению cadherin и к слабой элонгации [40], указывая тем самым, что тщательная оркестровка уровней кадхерина м.б. необходима для интеркаляции. for intercalation. Является ли такая регуляция необходимым условием, неясно, т.к. нулевые мутации в
C. elegans cadherin,
hmr-1, не вызывают обнаружимых дефектов в интеркаляции эпидермальных клеток [41].
Mechanics: the forgotten polarizer?
Перестраивающиеся клетки обычно рассматриваются как активные партнеры по морфогенезу, но эмбриональные ткани отвечают также на воздействующие снаружи силы. Напр., поверхностные (эпителиальные) и глубокие эктодермальные клетки перестраиваются в ответ на прямое механическое растягивание эксплантов
Xenopus [42]. Перестройка эпителиальных клеток, как полагают, отвечает на внешние силы, т.к. клетки герметически закрывают отверстия, как это происходит во время epiboly у костистых рыб [43] и при закрытии ран [44] и во время поздней фазы элонгации примитивного кишечника (archenteron) у морских ежей (rev. [27]). В первом случае клетки отсоединяются от замыкающего свободного края, тем самым облегчая геометрические смыкание (Рис. 4a). В последнем случае, трубчатый archenteron подвергается 'necking' (Poisson эффект), т.к. клетки растягиваются (Рис. 4b).
Сложность задачи в связи с 'passive' перестройкой клеток заключается в том, как такие ткани д. испытывать механические воздействия. Точные лазерные микрохирургические манипуляции на дорсальной closure
у
Drosophila показали, что некоторые не перестраивающиеся ткани ведут себя как эластические слои, которые испытывают вязкое медленное перемещение [45]. Хотя индивидуальные перестраивающиеся клетки скорее всего ведут себя viscoelastically [46], их агрегационное поведение скорее всего является более похожим на пластичное, которое м. подвергаться постоянным изменениям при перестройке. Зародышевый диск
Drosophila является прекрасным примером: несмотря на довольно драматическое расширение ретракция зародышевого диска не связана с перестройкой [47]. Сходным образом, после осуществления перестройки удаление мезенхимных клеток, которые осуществляют тракции archenteron морского ежа, не вызывает соответствующей ретракции (J Hardin, unpublished). Эпителиальные ткани обладают дополнительным осложнением, в том, что они они являются без сомнения композитным материалом - т.е., апикальный и базальный ECM возможно затрагивает массу их механических свойств. Наша интуиция подсказывает, как перестраивающиеся клетки д. вести себя механически и это лучше, чем механическое моделирование таки х тканей. Наша попытка смоделировать CE трактует ткань как решетку, чьи точки купирования, используют уравнение, представляющее сохранение энергии, которая м. инкорпорироваться в дифференциальные адгезии [48]. Хотя такое моделирование и способно описывать перестройки, но его отношение к действительным клеточным процессам неясно. Др. модель использует схему, согласно которой клетки отвечают на стресс, пытаясь перестраивать свои границы и м. описывать динамику перестроек довольно хорошо [49]. Finite element method (FEM), хорошо проверенный численный поход к continuum mechanics (rev. [50 ]), успешно использован для изучения аспектов инвагинации во время гаструляции морского ежа (rev. [3,27]). Исследования Brodland и др. расширили FEM подход к набору перестраивающихся клеток (Рис. 4c; [51,52]). Т.к. эти модели расширены, чтобы учесть композитную природу клеточных слоев, то они обладают потенциалом объяснить, какие механические параметры доминируют в поведении перестаривающейся ткани.
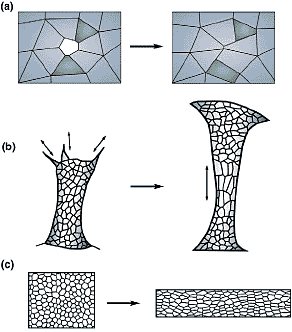 Рис. 4. Models of ‘passive’ cell rearrangement in response to external forces.
(a) After wounding of an epithelial sheet or during events such as
teleost epiboly, cells along the leading edge constrict to seal the
opening. During this process, some cells retreat from the leading
edge (adapted from [54], with permission). (b) Cells in the sea urchin
archenteron undergo noticeable stretching where the tube is
narrowest in diameter (‘necking’, or the Poisson effect); cells
appear to respond to tension generated by mesenchymal cells at
the tip of the archenteron by rearranging. (c) A finite element method
model shows that in-plane stretching of a two-dimensional sheet
of cells initially results in cell elongation, but ultimately cells rearrange
to relieve stress generated within the sheet (adapted from [51], with
permission).
Рис. 4. Models of ‘passive’ cell rearrangement in response to external forces.
(a) After wounding of an epithelial sheet or during events such as
teleost epiboly, cells along the leading edge constrict to seal the
opening. During this process, some cells retreat from the leading
edge (adapted from [54], with permission). (b) Cells in the sea urchin
archenteron undergo noticeable stretching where the tube is
narrowest in diameter (‘necking’, or the Poisson effect); cells
appear to respond to tension generated by mesenchymal cells at
the tip of the archenteron by rearranging. (c) A finite element method
model shows that in-plane stretching of a two-dimensional sheet
of cells initially results in cell elongation, but ultimately cells rearrange
to relieve stress generated within the sheet (adapted from [51], with
permission).
Conclusions: models, mechanics, and
mechanisms united
Ultimately, understanding directed cell rearrangement
will require understanding the wider context within
which such events take place. Whether this involves
the protrusive activity and internal signaling pathways
(e.g. PCP signaling) governing deep cell rearrangement,
or the patterning and polarizing cues guiding rearranging
epithelial cells, our understanding of CE will remain
incomplete until our models include both the mechanisms
and mechanics of rearrangement. Indeed, mechanical
effects are not restricted to reshaping of tissues.
In Drosophila, externally applied compressive forces
designed to stimulate germ band extension are sufficient
to induce nuclear localization of Armadillo/b-catenin and
twist transcription, even in mutants that cannot normally
activate twist expression [53]. Such studies suggest that
we are only beginning to explore how rearranging tissues
affect their surroundings, and that in the future our understanding of this fundamental morphogenetic event
will continue to improve.
Сайт создан в системе
uCoz Convergent extension in deep cells. A cartoon depicting the major motile events during convergent extension (CE) of dorsal axial mesoderm in Xenopus. Initially, cells show largely random protrusive activity. At the onset of CE, cells orient their protrusions mediolaterally, become bipolar, and intercalate between their neighbors. Cells continue to intercalate until they reach the lateral boundary with presumptive somitic mesoderm, where protrusive activity ceases. Cells in the notochord continue to converge until their mediolateral edges each make contact with the boundary ('boundary capture'). As the cells converge, the tissue extends along the forming A-P axis. Inset: the Keller cell-cell traction model of intercalation. CE must maintain rigidity within the tissue, while individual cells retain the ability to migrate between neighboring cells. 'Stiffening adhesions' (red) are temporary regions of adhesion between cells that allow the tissue to retain structure, but can be easily broken or reformed as cells migrate between each other. 'Tractive protrusions' consist of mediolaterally directed filopodia that adhere to neighboring cells with enough force to pull cells between one other. (Adapted from drawings courtesy of R Keller, with permission.)
Convergent extension in deep cells. A cartoon depicting the major motile events during convergent extension (CE) of dorsal axial mesoderm in Xenopus. Initially, cells show largely random protrusive activity. At the onset of CE, cells orient their protrusions mediolaterally, become bipolar, and intercalate between their neighbors. Cells continue to intercalate until they reach the lateral boundary with presumptive somitic mesoderm, where protrusive activity ceases. Cells in the notochord continue to converge until their mediolateral edges each make contact with the boundary ('boundary capture'). As the cells converge, the tissue extends along the forming A-P axis. Inset: the Keller cell-cell traction model of intercalation. CE must maintain rigidity within the tissue, while individual cells retain the ability to migrate between neighboring cells. 'Stiffening adhesions' (red) are temporary regions of adhesion between cells that allow the tissue to retain structure, but can be easily broken or reformed as cells migrate between each other. 'Tractive protrusions' consist of mediolaterally directed filopodia that adhere to neighboring cells with enough force to pull cells between one other. (Adapted from drawings courtesy of R Keller, with permission.) 

