У эукариот DNA double-strand breaks (DSBs) репарируются с помощью двух разных, но взаимосвязанных путей: non-homologous end-joining (NHEJ) и homologous recombination (HR) (Рис. 1). Во время NHEJ, два конца DSB воссоединяются с помощью простой ligation после незначительного или отсутствия нуклеолитического процессинга концов. У людей этот путь связан с Ku70/Ku80 гетеродимером, DNAPK, Artemis nuclease и Lig4/Xrcc4 ligase
(rev.[1]). Т.к. NHEJ часто сопровождается мутациями и небольшими делециями на месте разрыва, то этот путь в целом рассматривается как склонный к ошибкам. Напротив, HR нуждается в обширной 5' резекции от общей области однонитчатой ДНК в месте разрыва. Концы одиночной нити м. последовательно захватывать гомологичную матрицу для первичного ДНК синтеза и копирования и в конечном итоге восстановления генетической информации, нарушенной с помощью DSB (Рис. 1). Т.к. генетическая информация преимущественно копируется с интактной сестринской хроматиды, то этот путь является свободным от ошибок. Однако, потеря гетерозиготности или геномные перестройки м. возникать, когда DSB репарируются с использованием хромосомного гомолога или повторяющихся последовательностей. У людей эффективная HR нуждается в replication
protein A (RP-A) и белках из RAD52 epistasis группы, включая комплекс Mre11/Rad50/Nbs1. Собственно активация DNA damage checkpoint нуждается в Mre11/Rad50/Nbs1, Rad17/Rfc2-5, Rad9/Hus1/Rad1 и ATR/ATRIP комплексах и ATM, а также в ряде адапторных белков, включая BRCA1 и claspin и эффекторные киназы Chk1 и Chk2 (rev. [2,3]). Белки, участвующие в пути репарации DSB высоко консервативны от дрожжей до людей, как и ядерная организация процесса репарации (Рис. 2).
Сайты репарации DSB характеризуются агрегацией репарирующих белков в цитологических фокусах, как это впервые было описано Douglas K Bishop для Dmc1 и Rad51 во время мейоза у
Saccharomyces cerevisiae и Thomas Haaf с коллегами для Rad51 в митотических клетках человека [4,5]. Эти фокусы образуются на DSBs, в местах стрессов ДНК репликации, на укороченных теломерах, на не репарируемых DSBs в стареющих клетках и в областях однонитчатых ДНК
in vivo [6-10]. Более того, фокусы репарации ДНК являются местами внепланового синтеза ДНК (выявляется по включению BrdU), это является маркером начинающейся гомологичной рекомбинации [11]. Исследования этих фокусов в живых клетках существенно продвинулись в результате использования GFP-меченных checkpoint и репаративных белков. Эти меченные белки комбинировали с эндонуклеазой индуцируемыми DSB сайтами, флюоресцентно маркированными тандемными последовательностями или Tet или Lac репрессор связывающих сайтов (Рис. 3). У дрожжей эти инструменты были использованы для демонстрации, что индуцированные повреждениями ДНК фокусы являются центрами репарации, способными одновременно рекрутировать множественные DSBs [7]. Сходным образом, агрегация индуцированных повреждениями ДНК фокусов
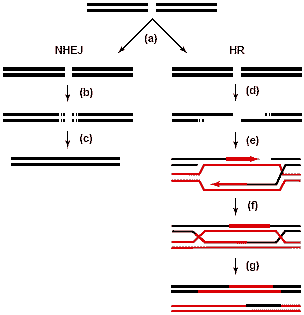 Fig.1. DNA double-strand break repair pathways in eukaryotes. Left, non-homologous end-joining pathway (NHEJ). Right, homologous recombination pathway (HR). Depending on whether the NHEJ or HR
pathway is used, DNA double-strand break repair proceeds through
a number of distinct step: (a) damage detection, (b) end processing,
(c) end ligation, (d) 5' resection, (e) strand invasion, (f) Holliday-junction
formation, and (g) Holliday-junction resolution. Damaged DNA in
black and intact homologous sequences in red.
Fig.1. DNA double-strand break repair pathways in eukaryotes. Left, non-homologous end-joining pathway (NHEJ). Right, homologous recombination pathway (HR). Depending on whether the NHEJ or HR
pathway is used, DNA double-strand break repair proceeds through
a number of distinct step: (a) damage detection, (b) end processing,
(c) end ligation, (d) 5' resection, (e) strand invasion, (f) Holliday-junction
formation, and (g) Holliday-junction resolution. Damaged DNA in
black and intact homologous sequences in red.
γ-H2AX в клетках млекопитающих указывает на то, что организация репарации в центрах эволюционно консервативна [12]. Соединение множественных DSBs во время репарации согласуется с более ранними наблюдениями межхромсомных транслокаций в клетках дрожжей и млекопитающих [13,14]. Молекулярная архитектура фокусов репарации остается неизвестной, но флюоресцентная микроскопия показала, что фокусы репарации являются ансамблями белков размером в giga-dalton [15]. Фокальная организация репарации DSB и процессов рекомбинации скорее всего создают клеткам ряд преимуществ. Во-первых, центры репарации ДНК облегчают высокие локальные концентрации репаративных белков на повреждениях, это м.б. необходимым для определенных биохимических ступеней во время репаративного процесса. Во-вторых, два конца DSB иногда оказываются разделены, а репаративные центры м. снова сводить их вместе для правильного воссоединения [16]. Однако, клетки не м. отличать концы от разных DSBs и тем самым способствуют транслокациям, когда сталкиваются с множественными DSBs [13,14]. В-третьих, локализация множественных повреждений ДНК в немногих центрах м. облегчать координацию процессов репарации ДНК с ходом клеточного цикла [17,18].
Dynamics of proteins in repair foci
Было продемонстрировано, что фокусы репарации ДНК являются высоко динамичными структурами, которые м. собираться и разбираться в течение минут [7,19]. Кроме того, фокусы репарации перемещаются по ядру, а репаративные белки Rad52 и Rad54 постоянно обмениваются с пулом несвязанных белков [19,20]. Более того, было продемонстрировано, что checkpoint белок, Chk2, фосфорилируется с помощью ATM исключительно в репаративных фокусах. Эта ассоциация с фокусами преходяща, и это делает возможной диффузию глобального Chk2 checkpoint сигнала внутри клетки [18]. Напротив, белок Nbs1 остается более тесно связанным с DSB сайтом, а Rad51 лишь едва обменивается с не связанным белком [18,19]. Более того, разные скорости диффузии индивидуальных репаративных белков указывают на то, что не происходит предварительной сборки DSB рекомбинационных репаративных комплексов [19]. Что же тогда предопределяет место сборки репаративного фокуса? Вообще-то в ядрах существуют каркасы, которые поддерживают зарождение (nucleation) репаративных фокусов, которые последовательно рекрутируют повреждения ДНК. Или поврежденная ДНК/хроматин сами м. действовать как поддержки для сборки репаративной кухни (machinery). Значение хроматина для эффективной репарации ДНК подтверждается быстрым фосфорилированием гистона H2AX (γ-H2AX) в DSB сайтах [21]. Мыши, лишенные H2AX являются чувствительными к иррадиации и иммунодефицитны, а самцы бесплодны [22]. Более того, H2AX
-/- клетки обнаруживают пониженную стабильность Nbs1, 53BP1 и Brca1 фокусов, это подтверждает прямое участие H2AX в организации фокусов репарации ДНК [22,23]. Др. подтверждением непосредственной роли модификации хроматина во время репарации является локализация histone deacetylase HDAC4 на 53BP1 фокусах после индукции DSB [24]. Важность ацетилирования/деацетилирования гистонов подтверждается также чувствительностью к повреждениям ДНК у мутантных дрожжей с отсутствием Yng2 субъединицы NuA4 histone acetylase комплекса [25].
Assembly and disassembly of the DNA repair
machinery
выявлены 4 стадии в сборке и разборке фокусов репарации (Рис. 4). Первая стадия это обнаружение повреждения ДНК; Mre11/Rad50/Nbs1 комплекс, по-видимому. является самым ранним сенсором разрывов двойной нити ДНК, это достигается непосредственным связыванием с концами ДНК ([26,27] и M Lisby and R Rothstein, unpublished). Это связывание является скорее всего облегчает связывание этих концов др. с др. посредством zinc-hook в Rad50, как было продемонстрировано
in vitro [28,29]. Идентифицирован ряд модуляторов комплекса Mre11/Rad50/Nbs1, включая MDC1 и 53BP1 в клетках человека и Sae2 у почкующихся дрожжей ([30] и MLisby and R Rothstein, unpublished). Пока неясно, как NHEJ и HR пути координируются, возможно, что Mre11/Rad50/Nbs1 комплекс является важным компонентом ранних стадий обоих путей.
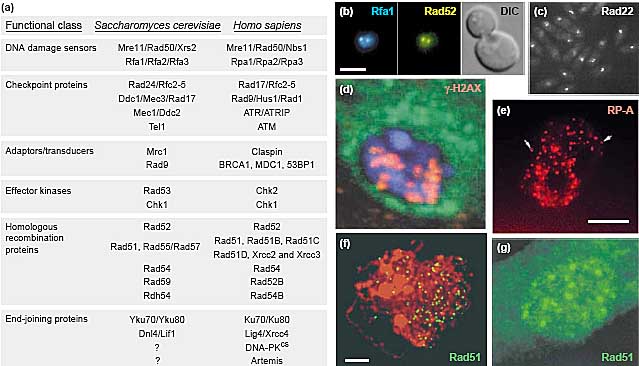 Fig.2. Evolutionary conservation of DSB repair pathways and their cellular organization. (a) Functional classes of DSB response proteins in S. cerevisiae and H. sapiens. (b-g) Examples of repair foci in different organisms. Scale bars: 3 mm. (b) Rfa1-CFP (cyan) and Rad52-YFP (yellow) foci in
S. cerevisiae after 400 Gy of g-irradiation. (c) Spontaneous Rad22-YFP foci in swi1 mutant Schizosaccharomyces pombe cells (reproduced with
permission) [61]. (d) Accumulation of γ-H2AX foci (red) in late meiotic prophase in spnBBU mutant oocytes in Drosophila melanogaster. DNA blue,
cytoplasm green. (reproduced with permission) [62]. (e) RP-A foci in restriction-enzyme-treated (EcoRI) sperm pronuclei of Xenopus laevis
(reproduced with permission) [63]. (f) Rad51 foci (green) in early zygotene of meiosis in Zea mays male meiocytes. DAPI (red) (copyrighted by the
American Society of Plant Biologists and reproduced with permission) [64]. (g) Rad51 foci in human fibroblasts after 8 Gy of γ-irradiation
(reproduced with permission) [65].
Fig.2. Evolutionary conservation of DSB repair pathways and their cellular organization. (a) Functional classes of DSB response proteins in S. cerevisiae and H. sapiens. (b-g) Examples of repair foci in different organisms. Scale bars: 3 mm. (b) Rfa1-CFP (cyan) and Rad52-YFP (yellow) foci in
S. cerevisiae after 400 Gy of g-irradiation. (c) Spontaneous Rad22-YFP foci in swi1 mutant Schizosaccharomyces pombe cells (reproduced with
permission) [61]. (d) Accumulation of γ-H2AX foci (red) in late meiotic prophase in spnBBU mutant oocytes in Drosophila melanogaster. DNA blue,
cytoplasm green. (reproduced with permission) [62]. (e) RP-A foci in restriction-enzyme-treated (EcoRI) sperm pronuclei of Xenopus laevis
(reproduced with permission) [63]. (f) Rad51 foci (green) in early zygotene of meiosis in Zea mays male meiocytes. DAPI (red) (copyrighted by the
American Society of Plant Biologists and reproduced with permission) [64]. (g) Rad51 foci in human fibroblasts after 8 Gy of γ-irradiation
(reproduced with permission) [65].
Т.к. концы ДНК временно стабилизируются, то имеется окно, обеспечивающее возможность появления NHEJ [31]. Mre11 nuclease м. действовать, чтобы отстригать т.наз 'dirty' концы, такие как hairpins и ковалентные комплексы ДНК-белок, до появления NHEJ [32,33]. Однако, если клетки неспособны заканчивать NHEJ реакцию. то репарации предшествует HR. Соотв., в клетках млекопитающих мутации в DNA-PK ведут к увеличению утилизации HR пути, в то время как мутации в HR генах не увеличивают абсолютного количества NHEJ событий [34,35]. Сходные конкурентные взаимоотношения между HR и NHEJ наблюдаются у почкующихся дрожжей [31].
Второй стадией является активация КПП (checkpoint),она характеризуется экстенсивной 5' резекцией концов ДНК с помощью неизвестной нуклеазы. После резекции клетка оказывается предетерминированной к HR, а NHEJ не стоит больше на повестке [36]. С этой точки зрения у высших эукариот одно-нитчатые концы оказываются связанными с RP-A, которое последовательно рекрутирует checkpoint комплексы Rad17/Rfc2-5, Rad9/Hus1/Rad1 и ATR/ATRIP [37-40]. У почкующихся дрожжей гомологичные комплексы (Rad24/Rfc2-5, Ddc1/Mec3/Rad17 и Mec1/Ddc2) рекрутируются с помощью RP-A на поврежденную ДНК [38,39]. Когда концы ДНК обрезаются у дрожжей, то Mre11 отсоединяется от DSB сайта, указывая тем самым, что его первичной ролью является ранний процессинг концов DSB и координация между NHEJ и HR (M Lisby and R Rothstein, unpublished).
Стадия три - это гомологичная рекомбинация. В противоположность первым двум, которые осуществляются на любой фазе клеточного цикла, стадия 3 ограничена S и G2 и у дрожжей и у людей, когда рекомбинационные белки из RAD52 epistasis группы рекрутируются в места повреждений ДНК [41]. Это м. объяснить, почему NHEJ является предпочтительным путем репарации DSB в G1 клеток, а HR предпочтительным путем во время S/G
2 [34,42]. У почкующихся дрожжей рекомбинационная кухня зависит от RP-A и возможно осуществляет свое действие посредством взаимодействия с Rad52 [43,44].
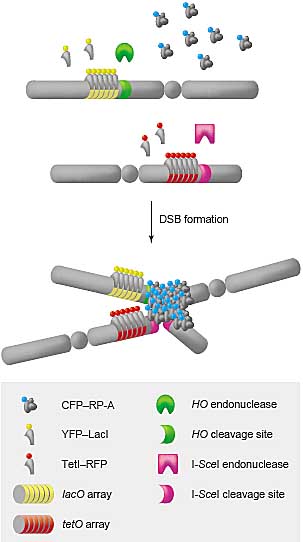 Techniques for imaging of DSB repair in living cells. The cellular
localization of unique genomic double-strand breaks can be visualized
in living cells by integrating arrays of Lac and Tet repressor binding
sites adjacent to HO and I-SceI endonuclease cleavage sites,
respectively, in cells expressing YFP-LacI and TetI-RFP protein
fusions [7]. The binding of the repressors marks the DSB sites. The
localization of induced DSBs at DNA repair centers can be visualized
by tagging RP-A or other repair proteins with CFP.
Techniques for imaging of DSB repair in living cells. The cellular
localization of unique genomic double-strand breaks can be visualized
in living cells by integrating arrays of Lac and Tet repressor binding
sites adjacent to HO and I-SceI endonuclease cleavage sites,
respectively, in cells expressing YFP-LacI and TetI-RFP protein
fusions [7]. The binding of the repressors marks the DSB sites. The
localization of induced DSBs at DNA repair centers can be visualized
by tagging RP-A or other repair proteins with CFP.
Стадия 4 выражается в разборке рекомбинационного аппарата и завершении клеточного цикла. На этой стадии клетки интегрируют репаративные и checkpoint функции, так что остаются арестованными до тех пор, пока рекомбинационные комплексы не будут разобраны [7]. Установлено, что Srs2 демонтирует Rad51 однонитчатые ДНК филаменты, подтверждая тем самым, что разборка рекомбинационных фокусов является активным процессом [45,46]. Важность собственно разборки фокусов рекомбинации иллюстрируется неспособностью srs2 мутантов освобождаться от вызванного checkpoint ареста [47].
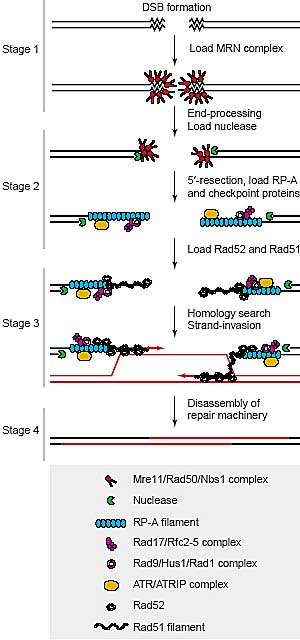 A four-stage model for assembly and disassembly of repair foci during HR. Stage 1: DSB recognition and processing by the MRN
complex. Stage 2: 50-resection of DNA ends, dissociation of the MRN
complex, and recruitment of RP-A, which in turn recruits the ATR/ATRIP,
Rad17/Rfc2-5 and Rad9/Hus1/Rad1 complexes. Stage 3:
recombinational repair during S and G2 phase. Rad52 catalyzes the
displacement of RP-A by Rad51, which in turn catalyzes strand-invasion
and Holliday-junction formation. Stage 4: disassembly of
repair centers and resumption of cell-cycle progression.
A four-stage model for assembly and disassembly of repair foci during HR. Stage 1: DSB recognition and processing by the MRN
complex. Stage 2: 50-resection of DNA ends, dissociation of the MRN
complex, and recruitment of RP-A, which in turn recruits the ATR/ATRIP,
Rad17/Rfc2-5 and Rad9/Hus1/Rad1 complexes. Stage 3:
recombinational repair during S and G2 phase. Rad52 catalyzes the
displacement of RP-A by Rad51, which in turn catalyzes strand-invasion
and Holliday-junction formation. Stage 4: disassembly of
repair centers and resumption of cell-cycle progression.
Regulation of proteins at repair foci
Ключевыми компонентами реакции на повреждения ДНК являются протеин киназы ATR, ATM и DNA-PK в клетках млекопитающих и Mec1 и Tel1 у почкующихся дрожжей. Эти белки модифицируют некоторые checkpoint и репаративные белки пост-трансляционно в зависимости от клеточного цикла и/или в ответ на повреждения ДНК (RP-A, Rad52, scRad9, Rad53, Mre11, Xrs2, Nbs1 и hsRad17 [16,
37,48-53]). В случае scRad9 и Rad53, индуцированное повреждениями ДНК фосфорилирование необходимо для репарации [49,50]. Сходным образом фосфорилирование Nbs1 необходимо для S phase checkpoint [54]; однако, для др. белков физиологическая роль модификаций в основном неизвестна. Кроме того, белки м.б.ubiquitinated (FANCD2 [55]) или sumoylated (Schizosaccharomyces
pombe Rad22 [56]). Такие модификации, как было продемонстрировано, играют роль в регуляции PCNA в безошибочном и в склонном к ошибкам пострепликативным репарациям ДНК [57]. Наконец, м. предположить, что пост-трансляционные модификации также действуют как переключатели сродства, чтобы регулировать взаимодействия ДНК-белок и белок-белок. Напр., BRCA1 содержит BRCT (BRCA1 C-концевой) домен, который соединяется с BACH1 и 53BP1 phospho-зависимым способом [58,59] и этот домен законсервирован в нескольких важных ДНК репарирующих белках
(ScRad9, Nbs1, and MDC1 [60]).
Conclusions and perspectives
The organization of DNA double-strand break repair into
highly dynamic multiprotein assemblies involves thousands
of molecules of checkpoint and repair proteins and
is conserved throughout eukaryotic evolution [7]. However,
we still lack a fundamental understanding of the
basic design of DNA repair centers and of their ability to
facilitate the many biochemical steps of DSB repair. To
reach this goal, it will be important to characterize further
the dynamics of individual components and the molecular
architecture of repair foci. Furthermore, attempts must be
made to identify additional components of these foci.
DNA replication and recombinational repair are interlinked
processes that share proteins such as RP-A and the
Mec1/Ddc2 complex. It will be important to study the
interactions between these processes, especially during
DNA replication stress, when restart of stalled replication
forks can take place via HR. In addition, investigating the
role of chromatin and protein remodeling activities within
repair foci should help to identify their specific functions
in the vicinity of DSBs. It will also be interesting to
determine how the activity of repair foci is coordinated
with cell-cycle progression, as NHEJ is favored in G1 cells
and HR in S/G2 cells. Finally, to bring the study of DSB
repair in living cells to the next level, attempts must be
made to directly monitor biochemical processes within
DNA repair foci in real-time. Important biochemical
steps include DSB processing by 50 resection, post-translational
modifications, homology search, strand exchange
and Holliday-junction resolution.
Сайт создан в системе
uCoz Fig.1. DNA double-strand break repair pathways in eukaryotes. Left, non-homologous end-joining pathway (NHEJ). Right, homologous recombination pathway (HR). Depending on whether the NHEJ or HR
pathway is used, DNA double-strand break repair proceeds through
a number of distinct step: (a) damage detection, (b) end processing,
(c) end ligation, (d) 5' resection, (e) strand invasion, (f) Holliday-junction
formation, and (g) Holliday-junction resolution. Damaged DNA in
black and intact homologous sequences in red.
Fig.1. DNA double-strand break repair pathways in eukaryotes. Left, non-homologous end-joining pathway (NHEJ). Right, homologous recombination pathway (HR). Depending on whether the NHEJ or HR
pathway is used, DNA double-strand break repair proceeds through
a number of distinct step: (a) damage detection, (b) end processing,
(c) end ligation, (d) 5' resection, (e) strand invasion, (f) Holliday-junction
formation, and (g) Holliday-junction resolution. Damaged DNA in
black and intact homologous sequences in red. 
 Techniques for imaging of DSB repair in living cells. The cellular
localization of unique genomic double-strand breaks can be visualized
in living cells by integrating arrays of Lac and Tet repressor binding
sites adjacent to HO and I-SceI endonuclease cleavage sites,
respectively, in cells expressing YFP-LacI and TetI-RFP protein
fusions [7]. The binding of the repressors marks the DSB sites. The
localization of induced DSBs at DNA repair centers can be visualized
by tagging RP-A or other repair proteins with CFP.
Techniques for imaging of DSB repair in living cells. The cellular
localization of unique genomic double-strand breaks can be visualized
in living cells by integrating arrays of Lac and Tet repressor binding
sites adjacent to HO and I-SceI endonuclease cleavage sites,
respectively, in cells expressing YFP-LacI and TetI-RFP protein
fusions [7]. The binding of the repressors marks the DSB sites. The
localization of induced DSBs at DNA repair centers can be visualized
by tagging RP-A or other repair proteins with CFP.  A four-stage model for assembly and disassembly of repair foci during HR. Stage 1: DSB recognition and processing by the MRN
complex. Stage 2: 50-resection of DNA ends, dissociation of the MRN
complex, and recruitment of RP-A, which in turn recruits the ATR/ATRIP,
Rad17/Rfc2-5 and Rad9/Hus1/Rad1 complexes. Stage 3:
recombinational repair during S and G2 phase. Rad52 catalyzes the
displacement of RP-A by Rad51, which in turn catalyzes strand-invasion
and Holliday-junction formation. Stage 4: disassembly of
repair centers and resumption of cell-cycle progression.
A four-stage model for assembly and disassembly of repair foci during HR. Stage 1: DSB recognition and processing by the MRN
complex. Stage 2: 50-resection of DNA ends, dissociation of the MRN
complex, and recruitment of RP-A, which in turn recruits the ATR/ATRIP,
Rad17/Rfc2-5 and Rad9/Hus1/Rad1 complexes. Stage 3:
recombinational repair during S and G2 phase. Rad52 catalyzes the
displacement of RP-A by Rad51, which in turn catalyzes strand-invasion
and Holliday-junction formation. Stage 4: disassembly of
repair centers and resumption of cell-cycle progression.