Если законченную хрящевую дифференцировку использовать в качестве диагностического детерминанта склеротома, то возникают различия между исследованиями
, эксплантированная на разных стадиях созревания доказывает их способность давать хрящ автономно только после стадии XXVII; сомиты стадии I-XIV не дают хряща
даже если они культивируются в присутствии эмбрионального экстракта (Strudel 1962,1963) Трансплантации эксплантов на САМ более старых хозяев, что обеспечивает лучшее долговременное выживание эксплантов, дают сходные результаты (Watterson et al., 19545). Недавно время детерминации склеротома определяли с помощью эктопических имплантаций клеток склеротома перепела под эктодерму хозяина курицы. В этих дорсальных условиях недетерминированные сомитные клетки, как и ожидалось, давали дермис и мышцы, образования хряща из трансплантированных клеток наблюдалось, если склеротом происходил из сомитов стадии XII или старше (Dockter, Ordhal, 1998). Т.о., полный процесс детерминации хряща приходится примерно на 18 ч после отделения сегмента, т.к. на время, когда уже экспрессируется ген Sox9 (Zeng et al., 2002).
После сегментации индукция склеротома в сомитах I-II зависит от позитивных и негативных сигналов, испускаемых аксиальными органами медиально, соматоплеврой латерально и эктодермой дорсально. Если хорда и нервная трубка или растворимый экстракт, приготовленный из хорды и нервной трубки, добавить в культуру на ст. I-XIV сомитов. то они всегда формируют хрящ и мышцы (Strudel, 1962). Необходимо упомянуть, что в эти культуры добавлялись сыворотка и эмбриональный экстракт. Эктопические трансплантации хорды или донной пластинки дорсальнее эпителиальных сомитов вызывали в результате рекрутирование дорсальных сомитных клеток в хрящ позвонков in vivo (Brand-Saberi et al., 1993, Pourquie et al., 1993). Эта активность параллельна вентрализующей активности этих тканей во время формирования DV паттерна нервной трубки (Hirano et al., 1995, Pourquie et al., 1993, van Straaten, Hekkung, 1991). Напротив, эктодерма ингибирует хондрогенез и способствует формированию дермомиотома in vitro и in vivo (Kenny-Mobbs, Thorogood, 1987, Marcelle et al., 1999), тогда как мезенхима латеральной пластинки контролирует образование латеральных сомитных типов (Pourquie et al., 1996, Tonegawa et al., 1997). Первые молекулярные маркеры появляются, когда проспективный склеротом индуцируется, это Pax1, Nkx3.1, Nkx3.2/Bapx1. Pax1 появляется в вентральном эпителии и сомитоцеле сомита III, тогда как экспрессия Pax3 оказывается ограниченной дорсальной частью сомита (Ebensperger et al., 1995). Pax9 появляется чуть позднее в склеротомах стадии IV-V сомитов и обнаруживает перекрывающуюся активность с Рах1 (Muller et al., 1996). У Pax1/Pax9 двойных мутантных мышей развитие вентральной части позвонков, но не нейральных дужек, сильно нарушено (Peters et al., 1999). Nkx3.2/Bapx1 впервые обнаруживается на той же стадии, что и Рах1. Если его экспрессия не происходит у Pax1/Pax9 двойных мутантов, то она может быть активирована эктопически с помощью избыточной экспрессии Рах1 in vivo (Rodrigo et al., 2003. Tribioli, Lufkin, 1997). Pax1 экспрессируется нормально у Pax1/Pax9 двойных мутантных мышей, но на поздних ступенях дифференцировки позвонков экспрессия его сильно нарушена (Tribioli, Lufkin, 1999). Nkx3.1 появляется во вновь сформированном сомите, но мутантные мыши не обнаруживают дефектов скелета (Kos et al., 1998, Schneider et al., 2000). Все вместе указывает на то, что Рах1 (поддерживаемый с помощью Рах9 позднее) действует выше Nkx3.2 при инициации развития склеротома. Более того Рах1 способен активировать экспрессию ранних маркеров хондробластов (aggrecan) в пресомитной мезодерме кур, культивируемой in vitro (Rodrigo et al., 2003). Это указывает на то, что активация Рах1 является ключевым событием, которое запускает формирование склеротома во время развития.
Хорда и вентральная часть нервной трубки, но не верхняя часть трубки, активируют Рах1 in vivo и in vitro (Brand-Saberi et al., 1993, Ebensperger et al., 1995, Koseki et al., 1993, Muller et al., 1996). Эта активность более мощная в каудальной части хорды, чем в более ростральных её частях (Muller et al., 1996). Это наблюдение может также означать, что некоторые сигналы хорды могут быть необходимы только временно во время развития склеротома. Сигнальные молекулы, секретируемые аксиальными органами, которые формируют паттерн сомитов, регулируют также начало экспрессии Рах1 и Nkx3.1 (Brand-Saberi et al., 1993, Schneider et al., 2000). Noggin и Sonic Hedgehog являются производными хорды, секретируемыми факторами, критическими для инициации и раннего поддержания Рах1. Noggin экспрессируется в хорде эмбрионов кур начиная со стадии Hamburger and Hamilton 4-5 (Streit, Stern, 1999). У мутантов Noggin начало экспрессии Рах1 задерживается, в то время как Noggin может индуцировать низкие уровни Рах1 в пресомитной мезодерме in vitro (McMahon et al., 1998. Это указывает на то, что противодействующая активность ВМР является критической для инициации развития склеротома. однако, альтернативные факторы могут частично компенсировать, спустя определенное время, отсутствие активности Noggin in vivo , тогда как у Noggin мутантных мышей в конечном итоге происходит запуск Рах1 и отсутствует лишь в немногих позвонках (McMahon et al., 1998).
В дополнение к активности, способствующей выживанию всего сомита, SHH далее поддерживает развитие склеротома (Borycki et al., 1999, Fan, Tessier-Lavingne, 1994, Johnson et al., 1994, Teillet et al., 1998). Тот факт, что мыши, лишенные SHH, обнаруживают нормальную, но временную экспрессию Рах1 первоначально предполагал. что SHH участвует в поддержании индукции in vivo (Chiang et al., 1996, Marcelle et al., 1999). Рах1 инициируется in vitro в пресомитной мезодерме раньше, независимо от сигналов SHH, но не поддерживается долго (Murtaugh et al., 1999). Добавление SHH поддерживает и усиливает экспрессию Рах1 и Nkx3.1 в несегментированной параксиальной мезодерме, поддерживаемой к культуре (Афт уе al., 1995, Fan, Tessier-Lavigne, 1994, Kos et al., 1998, Munsterberg, Lassar, 1995). Эффект SHH нуждается в активности Gli2 и Gli3 генов (Buttitta et al., 2003). Незадолго перед активацией Рах1 с помощью SHH член SHH пути активируется в презумптивном склеротоме (Borycki et al., 1999). Noggin и SHH действуют синергично в индукции склеротома и, по-видимому, осуществляют это с помощью параллельных сигнальных путей (McMahon et al., 1998).
Активность SHH блокируется в присутствии двух классов растворимых молекул, секретируемых с помощью среды сомита. Прежде всего, как на то указывает важность активности Noggin, BMP4 экспрессируется в латеральной пластинке и потолочной пластинке нервной трубки, противодействуя вентрализующей активности SHH и в нервной трубе и в сомитах
in vitro и
in vivo (Liem et al., 2000, 1995, Monsoro-Burq, 1996). Эпителиальные сомиты став объектом эктопических BMP2/4 сигналов, трансформируются в латеральные части сомитов, экспрессирующих
Sim-1, или в латеральную мезодерму (Pourquie et al., 1996, Tonegawa et al., 1997). Как результат тела позвонков не развиваются на уровне трансплантата (Monsoro-Burq et al., 1996). Это подтверждает модель потребности в инициальном BMP антагонизме, осуществляемым Noggin, чтобы предупредить BMPs, секретируемые латеральной пластинкой, от соединения с их клеточными рецепторами в сомитах и тем самым позволить паттерн формирующую активность SHH (MvMahon et al., 1998). Наконец, WNT молекулы продуцируемые эктодермой, также предупреждают активацию Рах1 (Capdevilla et al., 1998).
The sclerotome is firther subdivided into several domains
Вскоре после индукции в вентральной части эпителиального домена, клетки склеротома подвергаются эпителиально-мезенхимному переходу (EMT) из вентральной части эпителиального сомита и мигрируют вокруг нервной трубки, хорды или более латерально, чтобы сформировать проксимальные части ребер. EMT не нужен для инициального формирования паттерна склеротома: Рах1 появляется до EMT, Рах1 и Рах9 активируются у мышей с дефектами эпителизации/сегментации (Paraxis и ВАудеф-1 мутантов, напр.) (Barnes et al., 1997, Burgess et al., 1996, Hrabe de Sngelis et al., 19970. Напротив, EMT происходит нормально у Рах1/9 или Nkx3.2 мутантов (Peters et al., 1999, Tribioli, Lufkin, 1999). Устранение аксиальных органов показало, что EMT не зависит от их влияния (Teillet, Le Dourin, 1983).
Во время этой второй ступени развития, могут быть предопределены некоторые самостоятельные компартменты в популяции склеротома, согласно самостоятельным наборам генов, которые они экспрессируют. Рах1 экспрессия становится сильнее в вентрально-медиальной части склеротома (которая формирует тело позвонка и межпозвоночный диск), тогда как Рах9 усиливается в заднем вентро-латеральном компартменте (предшественнике нервных дужек и проксимальных частей рёбер) (Neubuser et al., 1995). Pax1 не экспрессируется клетками склеротома, которые мигрируют дорсально к нервной трубке (Monsoro-Burq, Le Douarin, 2000). Ген Gli2 сильно экспрессируется вокруг хорды, тогда как Gli3 отсутствует в окружении хорды, но экспрессируется в широком латеральном и дорсальном домене склеротома (Mo et al., 1997). Гены Foxc2/MFH1 и Zic1 экспрессируются по всему склеротому (Aruga et al., 1999, Furumoto et al., 1999) Клетки, которые мигрируют между эктодермой и верхней пластинкой начинают экспрессировать Msx1 и Msx2 по достижении ст. НН 20 (Monsoro-Burq et al., 1994, Monsoro-Burq, Le Douarin, 2000, Takahashi et al., 1992). Т.о., разные части склеротома скорее всего следуют по общему и специфическому генетическому пути, что отражается в общей хрящевой судьбе и специфических морфогенетических процессах.
Мы изучали судьбу клеток, мигрирующих дорсально к нервной трубке. Эти клетки формируют дорсальные части нервных дужек и остистые отростки (spinous) позвонков (Monsoro-Burq et al., 1994, Monsoro-Burq, Le Douarin, 2000, Takahashi et al., 1992). Т.о., эта популяция формирует хрящ в тесной близи к эктодерме, несмотря на ингибирующую активность эктодермы на хондрогенез (Capdevila et al., 1998, Kenny-Mobbs, Thorogood, 1987, Marcelle et al., 1999). Для идентификации механизмов, которые способствуют формированию хряща под эктодермой, в этой специфической локализации была проведена серия исследований, чтобы проверить активность верхней пластинки или хорды на развитие этих частей позвонков. В соответствии с его паттерном экспрессиии у эмбрионов мышей Foxc2, по-видимому, экспрессируется в тех же самых клетках (Furumoto et al., 1999). Т.о., можно предположить, что хондрогенные и дермальные предшественники, экспрессирующие Msx гены могут быть отличены по их экспрессии Foxc2 или Dermo-1, соотв. (Houzelstein et al., 2000).
Индукция генов Msx1/2 в дорсальной части склеротома обеспечивается с помощью сигналов BMP4, испускаемых эктодермой и верхней пластинкой нервной трубки; она блокируется, если noggin-секретируемые клетки трансплантируются дорсальнее верхней пластинки (Monsoro-Burq et al., 1996). Сигналы WNT также присутствуют в верхней пластинке, но не участвуют в этой индукции (Takahashi et al., 1996). Более того, эктопические трансплантаты верхней пластинки или BMP-секретирующих клеток под летеральную эктодерму, выше проспективного дермомиотома, вызывает активацию генов Msx, что сопровождается образованием подкожных хрящей (Takahashi et al., 1992). Этот эффект не наблюдается после трансплантации донной пластинки. Эффект очень мощный, если BMP-секретирующие клетки имплантируются дорсально на ст. Е3, во время миграции клеток склеротома дорсально к верхней пластинке (Monsoro-Burq et al., 1996). Однако, активации Msx генов недостаточно для достижения образования полного скелета в дорсальной локализации, т.к. после удаления хорды, обнаруживается очень мало
Msx2-позитивных клеток, расположенных дорсально, которые дальше не развиваются в хрящ (Monsoro-Burq et al., 1994). Эти наблюдения указывают на на двухступенчатый механизм, нуждающийся в активности хорды и донной пластинки на ст. Е2, это сопровождается потребностью в верхней пластинкой обусловленной активности BMP на ст. Е3 (Monsoro-Burq et al., 1996)ю Более того, хорда или SHH-секретирующие клетки не могут заместить активности верхней пластинки: дорсальная имплантация любого из них даёт в результате потерю экспрессии BMP4 в верхней пластинке, потерю экспрессии
Msx в нервной трубке и дорсальной части склеротома и отсутствие дифференцировки хряща вокруг трансплантата (Monsoro-Burq et al., 1994, Watanabe et al., 1998). Такого типа транплантаты защищены от нормального формирования DV паттерна нервной трубки и в конечном итоге дает дегенерацию дорсальной половины спинного мозга (Monsoro-Burq et al., 1995). Эти наблюдения были подтверждены на эмбрионах мышей. когда SHH экспрессировали под контролем промотора Wnt1 в верхней пластинке (Rowitch et al., 1999). Это подтверждает, что наблюдаемый дефект в формировании дорсальных частей позвонков после дорсальной трансплантации хорды, является вторичным по отношению к отсутствию экспрессии BMP из верхней пластинки нервной трубки. Наконец, в разных исследованиях, анализирующих имплантации хорды дорсально по отношению к сомитам, экспансия позвонкового хряща всегда локализовалась вентральнее транплантата: эктопический хрящ не формировался между эктодермой и эктопической хордой (Pourquie et al., 1993). На основании этих данных мы выдвинули гипотезу, что формирование хряща из детерминированных клеток склеротома может происходить вблизи эктодермы, это обусловливается тем, что BMP сигналы ослабляют ингибирующий эффект от эктодермы во время второй ступени развития склеротома.
Sclerotome differentiation into cartilage depends upon additional signals
Недавно в серии исследований in vitro была получена новая информация о ступенчатости процесса дифференцировки хряща из склеротома. Было установлено, что потребность в двух-ступенчатом процессе, связанным с активностью SHH на ранней ступени, когда индуцируется компетентность склеротома отвечать на последующие сигналы BMP.
Когда пресомитная мезодерма культивировалась в определенной среде, то добавление SHH или комбинации SHH и Noggin индуцировало ранние склеротомные маркеры, но было недостаточным, чтобы способствовать дифференцировке хряща. Однако, в полу-определенной среде, содержащей эмбриональный куриный экстракт (2%), низкие уровни образования хряща из пресомитной мезодермы всё-таки наблюдались, когда добавлялся SHH; этот эффект усиливался в присутствии сыворотки (Murtaugh et al., 1999). Эти результаты указывают на то, что SHH может кооперировать с еще не установленными факторами, присутствующими в экстрактах кур и сыворотке, способствующих дифференцировке хондроцитов. В частности, без сыворотки, SHH индуцирует экспрессию Рах1 и aggrecan. Это согласуется со способностью Рах1 индуцировать aggrecan в сходных условиях (Rodrigo et al.,2003). Однако, добавление сыворотки необходимо для достижения более сильной экспрессии aggrecan и индукции маркера поздней дифференцировки collagen IX (Murtaugh et al., 1999).
Важно, что пресомитная мезодерма обнаруживает экспрессию BMP4 и BMPRs после 3-5 дней in vitro (Murtaugh et al., 1999). BMP4 экспрессия усиливается, а BMP7 сильно активируется после культивирования в течение 3-5 дней в присутствии SHH. Если активность BMP блокирована с помощью Noggin in vitro и in vivo , то не происходит дифференцировки хряща, даже если экспрессия Рах1 остаётся неизменной. Наконец, 'mk исследование показало, что обработка ранней пресомитной мезодермы SHH изменяет ее реакцию на BMP сигналы. Как упоминалось выше, ранняя параксиальная мезодерма латерализуется с помощью BMPs, тогда как после 2-х дней воздействия SHH, экспланты параксиальной мезодермы способны хондрифицироваться при том же воздействии BMP (Murtaugh et al., 1999). Это согласуется с in vivo анализом, показавшем, что избыточная экспрессия BMP д. трансформировать соматическую мезодерму в латеральную мезодерму на ст. Е2, но способствовать образованию хряща, когда сигналы BMP поступают в область, занятую склеротомом позднее, точно также как в дорсальной части склеротома выше верхней пластнки ((Monsoro-Burq et al., 1996, (Monsoro-Burq, Le Douarin, 2000, Tonegava et al., 1997).
Однако, эти результаты не разрешают того факта, что хрящ не дифференцируется между эктодермой и эктопической хордой или донной пластинкой, тогда как это происходит между верхней пластинкой и эктодермой (Takahashi et al., 1992). В этой позиции хорда не окружена толстым межклеточным матриксом и и не обладает более длительной секреторной активностью по сравнению с тем, когда она локализована в более вентральных позициях (Monsoro-Burq et al., 1998). Она может кроме того обладать изменённой сигнальной активностью по сравнению с эндогенной хордой. Альтернативно, как было предположено выше, верхняя пластинка или высокая BMP активность д.б. особенно необходимой для ослабления эктодермального ингибирования дифференцировки хряща локально в дополнение к общему SHH-BMP обусловленному контролю дифференцировки склеротома.
Lassasr и др. анализировали гены, индуцируемые с помощью SHH и способствующие компетентности отвечать на сигналы BMP хондрогенезом. Они показали, что Nkx3.2/Bapx1 индуцируется с помощью SHH и поддерживается с помощью BMP в отсутствие действия SHH (Murtaugh et al., 2001). Более того, они показали, что Sox9 поддерживает автономно хондрогенез в эксплантах (Murtaugh et al., 2001б Zeng et al., 2002). "mkm in vitro анализ подтвержден фенотипом мутантов Nkx3.2/Bapx1: у таких мышей склеротом формируется, но не дифференцируется, а экспрессия Sox9 редуцируется (Tribioli, Lufkin, 1999). Однако, Рах1 экспрессируется на нормальном уровне у таких мутантов, в согласии с моделью инициация нормального склеротома сопровождается дефектной дифференцировкой.
Наконец, фенотип различных двойных мутантных мышей показывает, что множественные активности кооперируются , чтобы обеспечить дифференцировку склеротома и морфогенез различных частей позвонков, хотя некоторые гены необходимы не только для развития склеротома и они бывают недостаточны, чтобы обеспечить хондрогенез in vitro .
У Рах1/Рах9 двойных мутантов производные медиальной части склеротомов отсутствуют: тела позвонков, межпозвонковые диски и проксимальные части ребер отсутствуют, тогда как у Рах1 гомозигот выявляются более ограниченные дефекты тел позвонков и межпозвонковых дисков, а у мутантов Рах9 не затронут осевой скелет (Peters et al., 1999). Интересно, что нервные дужки у двойных Рах1/Рах9 мутантов образуются, но соединяются с помощью эктопических элементов хряща (Peters et al., 1999). Рах1 и Рах9 определенно являются критическими для образования скелета из медиальных частей склеротома посредством активации Bapx1 , но они не объясняют образования всего позвонка (Rodrigo et al., 2003). Напротив, winged helix транскрипционный фактор Foxc2/MFH1, по-видимому, является критическим для образования всего позвонка (Furumoto et al., 1999). Foxc2 экспрессируется во всём склеротоме, включая и клетки, мигрирующие дистально к верхней пластинке. Его экспрессия зависит от активности SHH, а мутанты Foxc2 имеют дефектные тела позвонков и нервные дужки. Двойные мутанты по Foxc2 и Рах1 обнаруживают даже более тяжелый фенотип, включая большие открытые нервные дужки и отсутствие тел позвонков и межпозвонковых дисков (Furumoto et al., 1999).
В противоположность мутантам Рах1/Рах9 мутантные мыши Zic1 обнаруживают скелетные дефекты прежде всего в нервных дужках (Aruiga et al., 1999). Экспрессия Рах1 и раннее развитие склеротома, по-видимому, не существенно нарушены и остальные части позвонков выглядят нормально. Этот фенотип напоминает фенотип Gli3 (Mo et al., 1997). Интересно, что Zic1 экспрессируется клетками дорсальной части склеротома, некоторые из которых не экспрессируют Рах1, тогда как Gli3 распространяется в основном на вентральную и дорсальную часть склеротома (Aruga et al., 1999). Zic1/Gli3 двойные мутанты обнаруживают более тяжелый фенотип со слиянием ренвных дужек латерально, тогда как остистые отростки (spinous) не образуются, как это наблюдается и после избыточной экспрессии SHH латеральнее по отношению к сомиту, in vivo (Watanabe et al., 1998).
Наконец, в согласии с идеей, что морфогенез дорсальной части позвонков может контролироваться специфически с помощью сигналов, исходящих от верхней пластинки нервной трубки, некоторые мутанты с дефектами верхней пластинки лишены дорсальных частей позвонков на уровне поврежденной нервной трубки (Manzanares et al., 2000).
Все эти сложные фенотипы указывают на то, что точный морфогенез позвонков базируется на интеграции этих разнообразных генетических активностей у эмбрионов.
Прогресс в идентификации существенных регуляторов дифференцировки хряща открывает новые перспективны для ортопедической генной терапии. Кости, хрящи или сухожилия могут быть индуцированы в принципе в стволовых клетках, подвергнутых действию определенных доз и времени индуцирующих молекул (Пфатш уе al., 2004). Взрослые стволовые мезенхимные клетки, по-видимому, пригодны для таких подходов. Большинство современных подходов концентрируются на активности BMPs? в особенности BMP2, являющийся костным индуктором (Baltazer, Lieberman, 2004, Yoon, Boden, 2004). Т.к. Sox9 обусловливает автономное образование хряща в эмбриональной ткани, не предназначенной для хондрогенеза, поэтому этот ген скорее всего станет центром внимания в будущем (Trippel et al., 2004, Zeng et al., 2002).
Сайт создан в системе
uCoz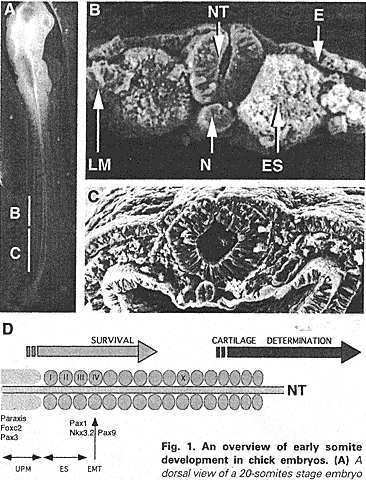 Foxc2/MFH1 и Zic гены также экспрессируются в более крупном склеротомном домене, чем Pax1 (Aruga et al., 1999, Furumoto et al., 1999). C помощью более тщательного анализа маркёров было бы интересно выяснить, становится ли вентральная часть сомита III после того как она помещается под эктодерму (Dockter, Ordahl, 2000), "дорсальным" склеротомным типом или склоняется в направлении др. сомитной судьбы (напр., дермиса) (Houzeilstein et al., 2000, Scaal et al., 2001). Альтернативно, если трансплантированный склеротом детерминирован и не может меняться в направлении др. судьбы, то он может не следовать дельнейшей дифференцировке, если вторичные сигналы, необходимые для полной дифференцировки хряща, не обнаруживаются в новых условиях. Альтернативно, негативные сигналы от эктодермы могут предупреждать хондрогенез в этой дорсальной локализации (Kenny-Mobbs, Thorogood, 1987). В обоих случаях клетки д.б. оставаться недифференцированными мезенхимными, что и наблюдали Dockter и Ordahl (2000).
Foxc2/MFH1 и Zic гены также экспрессируются в более крупном склеротомном домене, чем Pax1 (Aruga et al., 1999, Furumoto et al., 1999). C помощью более тщательного анализа маркёров было бы интересно выяснить, становится ли вентральная часть сомита III после того как она помещается под эктодерму (Dockter, Ordahl, 2000), "дорсальным" склеротомным типом или склоняется в направлении др. сомитной судьбы (напр., дермиса) (Houzeilstein et al., 2000, Scaal et al., 2001). Альтернативно, если трансплантированный склеротом детерминирован и не может меняться в направлении др. судьбы, то он может не следовать дельнейшей дифференцировке, если вторичные сигналы, необходимые для полной дифференцировки хряща, не обнаруживаются в новых условиях. Альтернативно, негативные сигналы от эктодермы могут предупреждать хондрогенез в этой дорсальной локализации (Kenny-Mobbs, Thorogood, 1987). В обоих случаях клетки д.б. оставаться недифференцированными мезенхимными, что и наблюдали Dockter и Ordahl (2000).