Notch является один раз пронизывающим мембрану трансмембранным белком, он обеспечивает многие онтогенетические сигнальные события, включая латеральную ингибицию и спецификацию границ. Передача сигналов Notch является в основном juxtacrine, т.к. лиганды (Delta and Serrate) также являются трансмембранными белками. Активация сигнала ведет к расщеплению Notch и высвобождению его внутриклеточного домена, который затем транслоцируется в ядро, где он взаимодействует с кофакторами, чтобы регулировать транскрипцию генов-мишеней [2,3]. Это внутриклеточное расщепление предваряется и стимулируется с помощью лигандом индуцированного расщепления по определенному сайту внутри extracellular domain (ECD) Notch [4].
Передача сигналов Notch затрагивается эндоцитозом разными способами, наиболее необычным является трансэндоцитотическое событие, при котором Notch ECD комплексуется с Delta и интернализуется с помощью лиганд-несущих клеток (Рис. 1). Предполагается, что трансцитоз Notch
ECD является существенным для передачи сигналов. Во-первых, экспериментальное ингибирование dynamin, GTPase, которая выщипывает эндоцитотические пузырьки из плазматической мембраны, показало, что эндоцитоз в целом необходим для передачи сигналов Notch [5]. Во-вторых, эндоцитоз лигандов является, по-видимому, критическим,
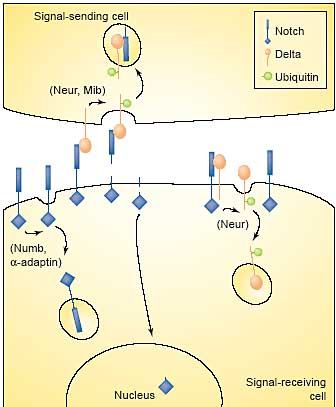 Endocytosis contributes positively to the activation of the Notch
pathway. The Notch receptor (blue) is activated by Delta (orange),
expressed in adjacent cells. Binding of Delta stimulates the cleavage
and release of the extracellular domain of Notch and its
transendocytosis (into the Delta-presenting cell). A further cleavage
releases a cytoplasmic fragment that translocates into the nucleus and
activates transcription. Endocytosis of Delta is required for activation of Notch, possibly by triggering Notch cleavage. Thus, promotion of Delta ubiquitination and internalisation by Mib or Neur stimulates signalling. By contrast, cis interaction between Notch and Delta (within the same cell) inhibits signalling. Thus, in cis, Neur could contribute positively to signalling by promoting internalisation of Delta in the receiving cells, thus releasing its inhibitory effect. Notch itself is also subjected to negative regulation by endocytosis: Numb and a-adaptin promote Notch internalisation, thus preventing Delta from accessing Notch.
Endocytosis contributes positively to the activation of the Notch
pathway. The Notch receptor (blue) is activated by Delta (orange),
expressed in adjacent cells. Binding of Delta stimulates the cleavage
and release of the extracellular domain of Notch and its
transendocytosis (into the Delta-presenting cell). A further cleavage
releases a cytoplasmic fragment that translocates into the nucleus and
activates transcription. Endocytosis of Delta is required for activation of Notch, possibly by triggering Notch cleavage. Thus, promotion of Delta ubiquitination and internalisation by Mib or Neur stimulates signalling. By contrast, cis interaction between Notch and Delta (within the same cell) inhibits signalling. Thus, in cis, Neur could contribute positively to signalling by promoting internalisation of Delta in the receiving cells, thus releasing its inhibitory effect. Notch itself is also subjected to negative regulation by endocytosis: Numb and a-adaptin promote Notch internalisation, thus preventing Delta from accessing Notch.
т.к. мутантные Delta, которые не м. эндоцитозироваться не способны активировать Notch in vivo [5]. Важность эндоцитоза лиганда для передачи сигналов Notch подтверждена изучением двух генов, которые необходимы для передачи сигналов Notch: neuralized (neur) и mind bomb (mib). Ген neur кодирует RING-finger E3 ubiquitin лигазу, которая м. модифицировать Delta in vitro [6] и является существенной для функции in vivo [7]. Подтверждается, что активность Neur обусловливает перераспределение Delta
из плазматической мембраны в эндоцитотические пузырьки и ведет к их деградации [6,8,9]. Как Neur-обусловленная поставка Delta ведет к активации передачи сигналов Notch всё ещё неясно. Одна из возможностей, что с помощью стимуляции эндоцитоза Delta в сигнал-посылающих (Delta-презентирующих) клетках, м. стимулировать расщепление и активацию Notch в воспринимающих клетках. Альтернативное объяснение, что Neur м. действовать в сигнал-воспринимающих (Notch-представляющих) клетках. В самом деле, Delta ингибирует активность Notch в цис-положении [10,11,12] и , следовательно, деградация Delta (запускаемая с помощью Neur) в воспринимающих клетках м. способствовать здесь активации сигнального пути.
У рыбок данио ubiquitin лигаза также участвует в передаче сигналов Notch. Хотя и не гомологичный Neur, но Mib функционирует очень сходным образом [10]. Mib, который имеет гомологов и у Drosophila и у млекопитающих, является E3 ubiquitin лигазой, которая влияет на Delta и обеспечивает Delta ubiquitination и его эндоцитоз в late endosomal/lysosomal компартменте. Делеционный анализ снова подтвердил, что ubiquitination важна. Делеция цитоплазматического хвоста Delta даёт неактивные молекулы, которые накапливаются на плазматической мембране. Важно, что сигнальная активность, также как эндосомный трафик, восстанавливаются, если ubiquitin половинка добавляется in frame к этой делеции. Это предоставляет строгие доказательства, что активность Delta регулируется с помощью ubiquitination. Подтверждено, что Mib не действует в воспринимающих клетках, т.к. трансфекция Mib не облегчает цис-ингибирующий эффект Delta на активность Notch. Поэтому на сегодня считается, что Mib регулирует Delta в клетках, продуцирующих сигнал [10].
Degradation of the receptor
Передача сигналов Notch затрагивается также эндоцитозом и более классическим образом, а именно, подавлением рецепторов. Генетические доказательства получены в исследованиях развития вульвы у Caenorhabditis elegans. В специфических клетках-предшественниках вульвы и в их производных передача сигналов Notch д. подавляться, делая тем самым возможной lateral inhibition [13]. Как показано Shaye and Greenwald [13], это подавление активируется с помощью передачи сигналов epidermal growth factor (EGF)/Ras и скорее всего использует отправку в лизосомы. Используя Notch-GFP (green fluorescent protein) слитый белок в качестве репортера , Shaye and Greenwald идентифицировали домен в 15 аминокислот в цитозольном хвосте Notch, который необходим для Ras-обусловленного подавления. Внутри этой короткой аминокислотной последовательности расположен предполагаемый dileucine мотив интернализации, а мутация в этом мотиве предупреждает интернализацию и деградацию Notch.
Т.о., передача сигналов Ras модулирует передачу сигналов Notch с помощью контроля его деградации посредством эндоцитотического пути. Др. исследование на Drosophila подтвердило, что ubiquitination также м. использоваться. Дело в том, что suppressor of deltex [Su(dx)], ген, как известно, необходимый для подавления передачи сигналов Notch, кодирует ubiquitin лигазу [14,15]. Это подтверждает, что ubiquitination Notch, осуществляемое с помощью Su(dx), м. ингибировать передачу сигналов в результате направления Notch на лизосомную и протеосомную деградацию. Во всяком случае, этот способ регуляции скорее всего законсервирован, т.к. биохимические исследования также показали, что гомолог Su(dx)у мышей, Itchy, м. убиквитинировать Notch [16].
Availability of the receptor at the cell surface
modulates signalling
В ином контексте, эндоцитоз, как было установлено, затрагивает активность Notch модулируя его наличие на поверхности воспринимающих клеток. Белок Numb противодействует передаче сигналов Notch во время асимметричных клеточных делений sensory organ precursors (SOP) у
Drosophila [17]. Во время митоза Numb оказывается в одной из двух дочерних клеток и его присутствие предупреждает дальнейшую передачу сигналов Notch [18]. Т.о., асимметричное распределение Numb делает возможной активацию передачи сигналов Notch в одной дочерней клетке, но не в др. Numb, как известно, непосредственно физически взаимодействует с Notch [17]. Было установлено, что Numb млекопитающих м. связывать α-adaptin и локализоваться в эндоцитотичесаких пузырьках [19]. Функциональное значение этого наблюдения было подкреплено с помощью находки, что α-adaptin необходим Numb-обусловленным асимметричным клеточным делениям [20]. Более того, α-adaptin асимметрично расположен в клетках SOP и для этого необходимо связывание его ear
домена с Numb [20]. Т.о., асимметрично локализованный Numb сводит вместе Notch и α-adaptin. По-видимому, это ведет к рекрутированию дальнейших эндоцитотических компонентов и к интернализации Notch, делая тем самым его недоступным для лигандов (Рис. 1). По-видимому, Numb
влияет только на доступность Notch, но не на его стабильность, т.к. общий уровень Notch, по-видимому, остаётся тем же самым в двух дочерних клетках SOP [20].
Hedgehog signalling
Передача Hedgehog (Hh) сигнала (или его гомлога у позвоночных
Sonic Hedgehog [Shh]) вовлекает два мембранных белка, 7 раз пронизывающий трансмембранный белок Smoothened (Smo) и много раз пронизывающий рецептор Patched (Ptc; [21]). В отсутствие Hh, Ptc удерживает Smo в неактивном состоянии. Соединение Hh с Ptc устраняет это ингибирование и позволяет Smo активировать нижестоящие сигнальные события. Это приводит к необычной ситуации, когда отсутствие рецептора (Ptc), напр., в результате мутации, ведет к конституитивной активации пути.
В дополнение к регуляции активности Smo, Ptc контролирует деградацию Hh и тем самым границы его действия. Эта форма регуляции довольно понятна, в самом деле, Patched, как известно, интернализует Hh в эндосомы в результате dynamin-зависимого процесса [22], и как полагают, в конечном счёте отправляет его в лизосомы. С помощью такого отлавливания Hh, Ptc ограничивает пределы перемещения Hh [23,24]. Механизм активации Smo более труден для понимания.
Endosomal sorting activates signalling
Поставка Ptc и Smo меняется драматически в ответ на Hh, который индуцирует противоположные эффекты на стабильность и локализацию двух молекул. Ptc деградирует и исчезает из плазматической мембраны. В то же самое время и возможно как следствие, Smo оказывается фосфорилированным и накапливается на плазматической мембране [25,26]. Эти наблюдения согласуются с кинетическими исследованиями эндоцитоза Smo и Ptc в клеточной культуре[22]. Хотя их общее steady-state распределение отлично, в отсутствие Shh, Ptc и Smo поступают в эндоцитотический компартмент с одинаково медленной скоростью. Добавление Shh заставляет два белка сегрегировать после того, как они достигнут позднего эндосомного компартмента, из которого Smo рециклирует обратно в плазматическую мембрану, тогда как Ptc и Hh скорее всего следуют лизосомным путём [27].
Более того, доказательства из эксплантов куриных эмрионов подтверждают, что сегрегация двух молекул в разные мембранные компартменты м.б. важным аспектом активации Smo. Воздействия, которые блокируют сортирующую активность поздних эндосом и которые в тканевой культуре предупреждают сегрегацию Smo из комплекса лиганд-рецептор, ингибируют передачу сигналов Shh [27]. Первоначально генетический анализ подтвердил простую модель, согласно которой Ptc д. ингибировать Smo путём его связывания, взаимодействия, которое д. выявляться после соединения Hh с Ptc [21]. Однако, несмотря на ранние подтверждающие данные [28,29], не выявлено взаимодействия между Smo и Ptc [27,30], а в последней работе было установлено, что Ptc действует substoichiometrically в своей репрессии Smo [30].
Ptc обладает общими признаками с рядом бактериальных транспортеров семейства RND (Resistance, Nodulation, Division) и с Niemann-Pick C1 (NPC1) млекопитающих, также мощным транспортёром. Интригуют законсервированные остатки, которые существенны для функции NPC1, которые также необходимы для функции Ptc [23,31], и сходным образом, ключевые остатки для активности бактериальных транспортеров, которые также существенны для Ptc [30]. Т.о., согласно современной модели, Ptc д. транспортировать малые молекулы, которые д. модулировать функцию Smo. Вообще-то разделение Ptc и Smo в разные компартменты выводит Smo из области ингибирующего действия Ptc (Рис. 2).
Roundabout/Commissureless
Membrane trafficking regulates receptor presentation
at the cell surface
У
Drosophila, как беспозвоночного нейроны нервного тяжа или простирают свои аксоны вдоль передене-задней оси без пересечения срединной линии (ipsilateral axons), или переходят на противоположную сторону (Рис. 3). Решение, пересекать или нет, регулируется трансмембранным рецептором Roundabout (Robo) и его лигандом, Slit [32]. присутствие Robo на поверхности нейронов обеспечивает их чувствительность к отталкивающему
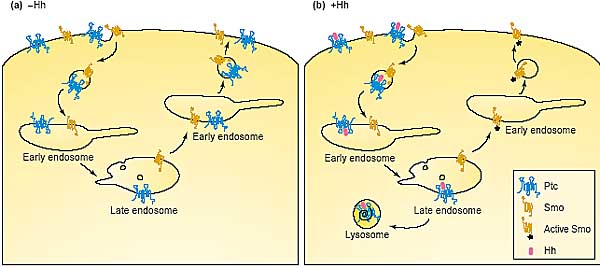 Sorting into a late endosomal compartment is essential for activation of the Hh pathway. (a) In the absence of Hh, the receptor Ptc (blue) and the signal
transducer Smo (orange) traffic together in the endocytic pathway. When the two molecules are in the same compartment, Ptc inhibits Smo, maybe by
controlling the concentration of a small molecule that inhibits Smo activity. (b) Hh causes Smo and Ptc to follow different routes after they have reached late endosomes: Ptc–Hh complexes follow a lysosomal route, whereas Smo recycles back to the plasma membrane. This segregation allows
Smo to be activated.
Sorting into a late endosomal compartment is essential for activation of the Hh pathway. (a) In the absence of Hh, the receptor Ptc (blue) and the signal
transducer Smo (orange) traffic together in the endocytic pathway. When the two molecules are in the same compartment, Ptc inhibits Smo, maybe by
controlling the concentration of a small molecule that inhibits Smo activity. (b) Hh causes Smo and Ptc to follow different routes after they have reached late endosomes: Ptc–Hh complexes follow a lysosomal route, whereas Smo recycles back to the plasma membrane. This segregation allows
Smo to be activated.
влиянию Slit, исходящем их глиальных клеток срединной линии. Т.о., ангажирование Slit и Robo страхует аксоны от пересечения срединной линии. Тогда следует ожидать, что ipsilateral нейроны поддерживают высокие уровни Robo на поверхности, тогда как контралатеральные нейроны д. обладать низкими уровнями Robo, которые после пересечения д. возрастать, чтобы предупредить повторное пересечение срединной линии. Т.о., усиление активности Robo на поверхности является важным для поведения нейронов. И в самом деле, у robo мутантных эмбрионов нейроны постоянно пересекают срединную линию, давая характерный roundabout фенотип. Установлено, что субклеточное распределение Robo регулируется с помощью действия Commissureless (Comm). В клеточной культуре, Comm обусловливает перенаправление Robo с клеточной поверхности на эндосомный компартмент [33,34]. Предложены две модели для объяснения этих результатов (Рис. 3b). Согласно одной, Comm д. способствовать эффективному эндоцитозу Robo [33].
Др. модель предполагает. что вновь синтезированный Comm перемещается непосредственно из Golgi в эндосомы. Commwould взаимодействует с Robo в Гольджи и отвлекает его от его обычного предназначения (плазматической мембраны) в эндосомный компартмент [34].
Главным доказательством в подтверждение последней модели является то, что антитела против внеклеточного epitope tag в Robo эффективно интернализуются с помощью Robo, не смотря на то, что Comm также присутствует. Однако, т.к. внеклеточный и/или трансмембранный домены Robo необходимы для перенаправления функции Comm [34],нельзя формально исключить возможность, что Robo-Comm взаимодействие д. маскировать эпитоп, распознаваемый с помощью антител, т тем самым создаётся впечатление, что интернализации не происходит. Во всяком случае независимо от маршрута, избираемого Comm, чтобы достичь эндосом, становится ясным, что снова д. привлекаться ubiquitination. В цитоплазматическом хвосте Comm находится область в 25 аминокислот, которая содержит два связывающих сайта для ubiquitin лигазы Nedd4, a нарушения этого взаимодействия или препятствие ubiquitinating активности Nedd4, нарушает Comm-обусловленную доставку Robo [33]. Т.о., ubiquitination является пост-трансляционной модификацией, которая метит Comm для эндоцитотической сортировки.
Transforming growth factor β signalling
The endosome as a signalling compartment
Растут доказательства, указывающие что связанные лигандом рецепторы м. сохранять свою сигнальную активность после эндоцитоза (хотя, конечно, перед деградацией). Некоторые тирозин киназные рецепторы , включая EGF
рецептор и (NGF) ростового фактора рецептор и их нижестоящие эффекторы, были локализованы в эндосомах и было показано, что они передают сигналы и здесь [1].
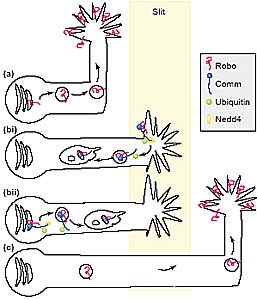 Comm regulates the presentation of Robo at the neuronal surface. (a)
Neurons that do not express Comm (blue) have high levels of surface
Robo (red). This makes them sensitive to repulsion by Slit, a ligand
expressed at the midline, and prevents them from crossing. (b)
Expression of Comm causes the downregulation of cell-surface Robo,
rendering the axon insensitive to Slit and allowing crossing. Two
possible models can account for Comm action. (i) In one model, Comm
interacts with Robo at the cell surface and, if it is ubiquinated through the action of Nedd4, becomes internalised, dragging Robo along. (ii) In another model, Comm is sorted directly from the Golgi to endosomes, most likely in a manner that depends on Nedd4-mediated ubiquitination. Again, Comm would guide the trafficking of Robo, but this time, from the Golgi to endosomes. (c) After the axon has crossed, comm expression decreases, high surface Robo is restored, and re-crossing is prevented.
Comm regulates the presentation of Robo at the neuronal surface. (a)
Neurons that do not express Comm (blue) have high levels of surface
Robo (red). This makes them sensitive to repulsion by Slit, a ligand
expressed at the midline, and prevents them from crossing. (b)
Expression of Comm causes the downregulation of cell-surface Robo,
rendering the axon insensitive to Slit and allowing crossing. Two
possible models can account for Comm action. (i) In one model, Comm
interacts with Robo at the cell surface and, if it is ubiquinated through the action of Nedd4, becomes internalised, dragging Robo along. (ii) In another model, Comm is sorted directly from the Golgi to endosomes, most likely in a manner that depends on Nedd4-mediated ubiquitination. Again, Comm would guide the trafficking of Robo, but this time, from the Golgi to endosomes. (c) After the axon has crossed, comm expression decreases, high surface Robo is restored, and re-crossing is prevented.
Сходным образом у эмбрионов
Drosophila снижение лизосомальной функции с помощью генетических средств ведет к накоплению сигнала Wingless (Wg) в эндоцитотическом компартменте, и это обусловливает избыточную передачу сигналов, подтверждаея, что эндоцитозированные Wg продолжают сигналить [35].
Т.о., эндоцитоз скорее является пермиссивным для передачи сигналов. В определенных ситуациях он м.б. даже необходим. Напр., в случае передачи сигналов transforming growth factor β (TGF-β), которая участвует в ряде онтогенетических процессов. Блокирование эндоцитоза ингибирует индуцированное TGF-β фосфорилирование и ядерную транслокацию Smad-2, транскрипционного фактора, который обеспечивет TGF-β реакцию
[36,37]. Smad anchor for receptor activation (SARA), адапторная молекула участвующая в TGF-β пути, как известно, накапливается в ранних эндосомах, где она м. помогать собирать рецепторный комплекс с дополнительными адапторами и эффекторами, необходимыми для нижестоящей передачи сигналов. В самом деле, нарушение эндосомной локализации SARA
приводит к ингибированию передачи сигналов [37].
Хотя всё ещё неполные, но генетические доказательства от
Drosophila в основном согласуются с позитивной ролью эндоцитоза в передаче сигналов TGF-β. Напр.. снижение скорости эндоцитоза благодаря экспрессии доминантно-негативной формы Rab5 снижает передачу сигналов с помощью Decapentaplegic (Dpp, гомолог TGF-β у
Drosophila) в крыловых имагинальных дисках [38]. Это считается доказательством того, что эндоцитоз необходим для транспорта Dpp вдоль эпителия диска, но это м. также указывать и на его роль в передаче сигналов. Дополнительные доказательства получены при изучении мутаций в гене spinster, который кодирует белок поздних эндосом
Drosophila. Такие мутации меняют функцию поздних эндосом и вызывают синаптические дефекты, обусловленные усилением передачи сигналов Dpp [39], снова предоставляя генетические доказательства позитивной роли эндоцитоза в передаче сигналов TGF-β. Одной из возможных интерпретаций является то, что мутация spinster позволяет сигнальным компонентам проходить в течение более продолжительного периода времени в эндосомном компартменте, что является благоприятным для передачи сигналов. Или напротив, мутации в spinster м. мешать деградации рецепторов, тем самым способствуя пути рециклинга и делая возможным новый раунд передачи сигналов.
Short Gastrulation, Wingless and
Decapentaplegic
Endocytosis and the spread of morphogens
В некоторых примерах онтогенетические сигналы д. перемещаться на относительно большие расстояния и формировать концентрационный градиент, который чувствительная ткань м. использовать, для приобретения позиционной информации. Роль эндоцитотического трафика в этом процессе активно обсуждается. Одной из общеизвестных функций эндоцитоза является деградация сигнала и, следовательно, формирование градиента. Более противоречивой является роль, которую эндоцитоз м. играть в самом транспорте, и необходимо ещё посмотреть до какой степени модель planar transcytosis приложима в целом к транспорту морфогенов.
Short Gastrulation (Sog) является секретируемой молекулой, которая подобно гомологу у
Xenopus chordin, соединяется с bone morphogenetic
proteins (BMPs), тем самым отказывая в доступе к их рецепторам. У эмбрионов
Drosophila Sog, происходящий из источника вблизи вентральной срединной линии распространяется по эмбриону в направлении дорсальной области [40,41]. Ингибирование dynamin чувствительной к температуре мутацией ведет к накоплению Sog по всему эмбриону [41]. Т.о.,
dynamin-зависимый эндоцитоз необходим для деградации этого лиганда. Заметим, что этот пример dynamin-зависимого эндоцитоза не нужен для транспорта, т.к. Sog по-прежнему достигает дорсальных клеток у мутантов. , следовательно, или Sog распределяется с помощью non-dynamin-зависимого planar transcytosis или делает это с помощью диффузии.
Важность эндоцитоза в деградации сигнала продемонстрирована также для Wg, секретируемого glycoprotein семейства Wnt. В крыловых имагинальных дисках клетки, дефицитные по dynamin, также накапливают Wg [42]. У эмбрионов, лизосомная деградация (также как и передача сигналов с помощью) Wg регулируется как в пространстве, так и во времени [35]. Это подчёркивает тот факт, что эндоцитоз м. предоставлять важный регуляторный импульс для диапазона и активности онтогенетического сигнала. Др. сигнал, который является предметом регуляции с помощью эндоцитоз-зависимой деградации является Dpp [38,43]. Изучение Dpp в крыловых имагинальных дисках
Drosophila предоставляют наилучшие доказательства роли эндоцитоза в транспорте морфогена. Три основных экспериментальных результата подтверждают идею, что Dpp м.б. транспортирован с помощью planar transcytosis вдоль эпителия диска [38]. Во-первых, когда все клетки диска (за исключением Dpp-секретирующих клеток) оказываются дефицитными по функции dynamin, то не выявляется Dpp вне домена экспрессии за исключением слабого окрашивания соседних к источнику клеток. Во-вторых, волна Dpp (инициированная в источнике в данный момент времени) неспособна пересечь клоны клеток, лишенные dynamin (хотя, постепенно, такие клоны становятся преодолеваемыми). В-третьих, ингибирование или ускорение эндоцитоза путём изменения активности малой GTPase Rab5,снижает или увеличивает сигнальный диапазон Dpp, соотв.
Хотя и противоречиво, но интерпретация, что эндоцитоз усиливает транспорт Dpp, стала предметом количественных моделей формирования градиента [44]. Lander et al. [44] продемонстрировали, что физиологически возможно, что градиенты м.б. установлены с помощью комбинации диффузии и униформной деградации вследствие рецептор-обусловленного эндоцитоза. Математическое моделирование м. сделать предсказания, которые не обязательно интуитивны и в самом деле Lander et al. [44] предсказали, что клоны клеток, дефицитных по эндоцитозу, д. препятствовать транспорту, базирующемуся на диффузии. Авт. подтвердили, что это м. произойти, если уровни рецепторов повышаются драматически на поверхности дефицитных по dynamin клеток, ситуация. которая д. приводить к отлавливанию лигандов и тем самым к предупреждению дальнейшей диффузии. Оба эти предположения и предсказание м. и д.б. протестированы.
Conclusions
Many signals and receptors are inherently associated with
membranes. It is now becoming clear that developing
tissues are capitalising on this association by using membrane
trafficking as a means of modulating signalling
activity in time and space. Indeed, as we have described,
a variety of regulatory opportunities from membrane traf-
ficking are exploited by signalling systems. It is likely tha more strategies will be uncovered as the fields of signalling
and trafficking continue to progress synergistically.
Update
В недавней статье предоставлена дальнейшая информация о механизме, с помощью которого Numb негативно регулирует Notch рецепторы и уместности ubiquitination в передаче сигналов Notch. McGill and McGlade [45] показали, что Numb соединяется с E3 ubiquitin ligase Itchy, и способствует ubiquitination как Notch полной длины, так и внутриклеточного домена Notch (после отщепления). В то время как последнее событие ubiquitination ведет к протеосомами-обеспечиваемой деградации фрагмента Notch, первое. по-видимому, не вызывает подавления рецепторов [45]. Эта находка в согласии с предыдущим наблюдением, что уровни Notch, по-видимому, те же самые в двух дочерних клетках SOP [20] и усиливает современную модель, что Numb форсирует Notch эндоцитоз.
Как указывалось выше эндоцитоз играет существенную роль в передаче сигналов TGF-β. В частности, данные показывают, что ингибирование эндоцитоза негативно регулирует передачу сигналов TGF-β, подтверждая, что передача сигналов имеет место в эндоцитотическом компартменте[36,37]. Недавно было показано, что TGF-β и его рецептор интернализуются посредством двух разных путей, каждый с разным исходам [46]: a clathrin-зависимый 'signalling route' поставляет комплекс в ранние эндосомы и является пермиссивным для активации рецепторов; а raft-зависимый
'degradative route' в caveolin-1-обогащенный компартмент ведет к ассоциации с Smad7-Smurf2 ubiquitin ligase и подавлению рецепторов. Т.о., авт. предложили альтернативную модель, причем clathrin-зависимая интернализация не д. сама по себе быть необходима для передачи сигналов, но д. уводить рецепторы прочь от caveolar дегративного пути [46]. В соответствии с этим передача сигналов д. происходить как в эндосомах, так и на клеточной поверхности.
Сайт создан в системе
uCoz

