Несмотря на ретроградный везикулярный транспорт NGF-TrkA,
существуют альтернативные модели для распространения сигнала NGF (reviewed in [35,39,40]). Модель 'domino' или 'wave propagation' предусматривает быстрое латеральное распространение фосфорилирования TrkA вдоль плазматической мембраны аксона, инициируемое связыванием NGF
в окончаниях, но распространение происходит лиганд-независимым способом [41]. Сходная волна латерального фосфорилирвоания рецепторов становится видимой при флюоресценином imaging после фокальной стимуляции EGFR в не-нейрональных клетках [42]. Др. модель 'retrograde effector' предполагает, что сигнальные молекулы, активированные с помощью NGF-TrkA достигают тела клетки независимо от комплексов лиганд-рецептор. Подтверждение не-эндосомной передачи сигналов NGF получено в исследовании, где окончания аксонов стимулировали фокально с помощью кусочков, покрытых NGF, которые не м. интернализоваться, но были способны влиять на жизнеспособность нейронов [43]. Хотя NGF кусочки вызывают активацию TrkA и Akt, фосфорилирование MAPK было тем не менее нарушено в этих условиях, демонстрируя снова роль эндосомного таргетинга в избирательной активации сигнальных путей. В целом. данные по действию NGF строго подтверждают, что передача сигналов от эндосом имеет функциональное значение. хотя др. механизмы м. действовать параллельно. Эта парадигма, как ожидается, оперирует также в не-нейрональных клетках в ответ на факторы, иные чем NGF [34]. Примеры с нейронами указывают на то. что эндосомы, с их зависимой от цитоскелета подвижностью, идеально приспособлены для точного, направленного и контролируемого высвобождения сигнальных комплексов в специфических клеточных местах, функция, которая не м.б. воспроизведена и аккуратно достигнута с помощью механизмов распространения сигнальной волны или диффузии.
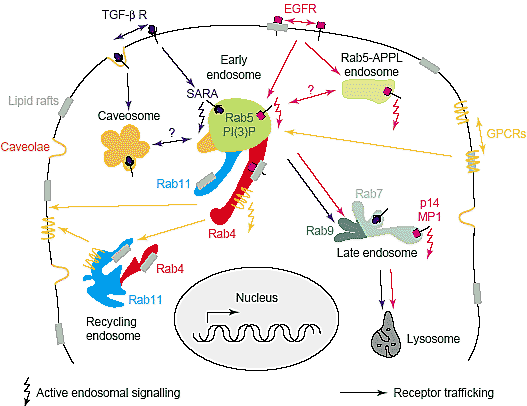
Учитывая, что некоторые цитоплазматические сигнальные молекулы являются общими для разных путей, то как предупреждается неспецифическое общение между этими путями? Нежелательные взаимодействия м.б. устранены с помощью ограничения сигнальных каскадов в пространстве. Помимо действия в качестве транспортных переносчиков на длинные расстояния эндосомы м. обеспечивать два дополнительных взаимосвязанных уровня контроля: избирательная доставка сигнальных молекул к специфическим органеллам и их сегрегацию в субдомены внутри данной органеллы. Хорошо известно, что мембранные субдомены, участвующие в передаче сигналов, являются иммунологическими синапсами в лимфоцитах [44] и сайтами фокальных адгезий в эпителиальных клетках [45]. Др., более общий тип, субдоменов, присутствующих в большинстве клеточных мембран, базируется на биофизических свойствах определенных вилдов липидов. Во внеклеточном листке мембранного бислоя насыщенные glycosphingolipids м. соединяться и формировать жидкие упорядоченные домены, в которые интеркалирован холестерол, называемые липидными плотиками (rafts) [46]. Сходные микродомены, по-видимому. существуют и в цитозольном листке и они, по-видимому, связаны с платформами в наружном листке [47]. Интересно, что некоторые сигнальные молекулы, включая рецепторные тирозин киназы, GPI-закрепленные сигнальные молекулы, определенные члены семейства Ras и lipid-модифицирующие молекулы, подобно большинству киназ семейства Src, обладают высоким сродством к липидным плотикам. С помощью регуляции разделения на части сигнальных компонент в липидные плотики, сигнальные каскады м.б. или инициированы или закончены [48]. Специализированная форма липидных плотиков присутствует в большинстве типов клеток, называемая кавеолоами, это маленькие фляжко-образные инвагинации, стабилизированные с помощью олигомеров caveolin-1, принципиальных структурных компонентов кавеол [49]. Помимо своей структурной роли, caveolin-1, как полагают, рекрутирует некоторые сигнальные белки посредством своего каркасного (scaffolding) домена [50]. Хотя точный механизм остаётся неясным, несмотря на это вполне возможно, что сигнальные каскады м. регулироваться посредством рекрутирования сигнальных молекул в кавеолы. Напр., кавеолы, по-видимому, негативно регулируют сигнальные функции EGFR, PDGFR, GPCRs и nitric oxide synthase путем предупреждения их взаимодействий с нижестоящими эффекторами [51]. Т.к. липидные платформы и caveolin-1-позитивные структуры перемещаются с помощью эндоцитотических и экзоцитотических компартментов, то разделение на части сигнальных молекул в этих микродоменах, м.б. общим механизмом, оперирующим в большинстве внутриклеточных органелл. Фактически, убедительный случай роли кавеол в передаче сигналов связан с их способностью интернализоваться [52]. Когда кавеолы интернализуются, то они м.б. доставлены к внутриклеточным органеллам, богатым caveolin-1, называемыми caveosomes. Caveosomes обладают и просветной средой и мембранными характеристиками, которые отличают их от ранних или поздних эндосом [53]. Интересно, что , по-видимому, избирательная доставка или в caveosomes или ранне эндосомы, специфически модулирует передачу сигналов с помощью TGF-β рецепторов [54]. В сигнальной сети TGF-β, SARA (Smad anchor for receptor activation) специфически рекрутируется в Rab5-домен ранних эндосом, обогащенный phosphatidylinositol 3-phosphate (PI(3)P) [55,56] (Рис. 1). Интересно, что SARA, по-видимому, играет двойную роль в эндосомах, регулируя и доставку грузов посредством Rab5 компартмента и рецепторную передачу сигналов из этого домена [57,58]. Вовлечение TGF-β рецепторов с помощью SARA необходимо, чтобы фосфорилировать Smad2 и достичь последующего распространения сигнала, это объясняет, почему интернализация TGF-β рецепторов в ранние эндосомы необходима для собственно передачи сигналов. В caveosomes, однако, TGF-β рецепторы не встречаются с SARA и остаются неактивными. Интригующим наблюдением является то, что экспрессия постоянно неактивного Rab5 (Rab5S34N) стимулирует передачу сигналов TGF-β, тогда как экспрессия постоянно активного Rab5 (Rab5Q79L) не оказывает влияния [57]. Одна из возможностей заключается в том, что ингибирование Rab5 м. модифицировать транспорт TGF-β рецепторов между caveosomes и ранними эндосомами, тем самым подчеркивается влияние транспорта на передачу сигналов.
Scaffold факторы м. играть важную роль в передаче сигналов путем регуляции трафика сигнальных рецепторов и/или активности нижестоящих сигнальных компонентов, таких как MAPK [25,32]. Интересно, что эти молекулы м. также специфически локализовать сигнальные комплексы в эндоцитотических компартментах. Huber и др. идентифицировали белок поздних эндосом p14, который необходим для эффективной передачи сигналов EGF в каскаде ERK [59]. Локализация MP1-MAPK каркаса в поздних эндосомах с помощью p14 (Рис. 1) необходима для полной активации ERK1/2 в поздней фазе передачи сигналов после инициальной активации в плазматической мембране. Интересно, что неправильная доставка p14-MP1 в плазматическую мембрану не м. компенсировать отсутствие эндосомной передачи сигналов, это указывает на то, что поздние эндосомы обеспечивают уникальную платформу для распространения сигналов.
Во время своего эндоцитотического маршрута рецепторы. предназначенные для деградации. такие как EGFR, секвестрируются во внутренних пузырьках, которые образуются из ограничивающих мембран эндосомных вакуолей, процесс, который стартует в ранних эндосомах и ведет к формированию мультивезикулярных телец и поздних эндосом [60]. Т.к. рецепторы во внутриэндосомных пузырьках считаются неактивными, то передача сигналов д. происходить в течение временного промежутка транспорта иежду плазматической мембраной и включением во внутрипросветные домены. Важно учитывать, однако, что intra-lumenal сортировка белков прочь от цитоплазмы не всегда приводит к деградации, т.к. внутренние пузырьки, содержащие MHC class II молекулы, м.б. использованы в качестве контейнеров для хранения, которые сливаются обратно с ограничивающей мембраной [61]. Путем модулирования баланса между активными сигнальными комплексами на ограничивающей наружной мембране и секвестрированными неактивными молекулами во внутренних пузырьках, поздние эндосомы м. обеспечивать еще один механизм, чтобы регулировать качество и продолжительность сигнала.
Были ли первоначальные эндосомы первоначально лишены сигнальных функций? Эндоцитотическая структура заметно отличается от канонических ранних эндосом и содержит малую GTPase Rab5 вместе с её двумя эффекторами APPL1 и APPL2, недавно была идентифицирована как промежуточная в передаче сигналов между плазматической мембраной и ядром [62]. Белки APPL существенны для клеточной пролиферации, способны к снованию между ядром и цитоплазмой в ответ на EGF или оксидативные стрессы и ассоциируют непосредственно с ядерными белками (NuRD/MeCP1 комплекс). Др. эндоцитотические белки, такие как eps15, epsin1, CALM (clathrin assembly lymphoid myeloid leukemia) и α-adaptin, как было показно ранее, подвергаются транслокации из плазматической мембраны в ядро [63]. Напротив, локализация белков APPL в до сих пор не описанной популяции эндоцитотических мембран, вместе с их существенной ролью в митогенезе, указывает на то, что определенные реакции на пути передачи сигналов EGF м.б. запущены из субнабора специализированных эндосом.
Conclusions and future prospects
The data available so far demonstrate that signal transduction
occurring from endosomes has functional importance,
although different modes of signal propagation
may co-exist for a given stimulus in the same cell and
different signalling systems may depend on endosomes
to various degrees [23,34]. By sorting and trafficking
ligand–receptor complexes within defined timeframes,
endosomes provide temporal control of signal transduction.
Activated plasma membrane receptors can be internalised
via several routes (e.g. clathrin-mediated,
caveolin-dependent, clathrin- and caveolin-independent,
macropinocytosis) into different types of endosomes (e.g.
EEA1- or APPL-positive ones). By providing a platform
for compartment-specific molecular interactions leading
to the assembly of unique signalling complexes, endosomes
also add a level of spatial control to signal propagation
events. Targeting to different endosomes or even
distinct membrane subdomains within the same endosome
can determine specific cellular responses. From this
point of view, metabolic networks provide a good example
of how compartmentalisation is essential for the
correct flow of enzymatic reactions [64]. Moreover, the
same membrane–cytoskeleton interactions that regulate
the position of endosomes within the cell can be
exploited for the generation of localized signal transduction
responses, thus providing an advantage over diffusion-
or lateral-wave-propagation-based mechanisms.
Although in the past few years the interface between
endocytosis and signalling has been actively explored, we
still do not know how preferential activation of particular
signalling cascades on endosomes translates into specific
biological responses. Determining the subcellular localisation
of signalling components and their interactions
with respect to the subdomain organisation of endosomes
is bound to reveal new insights into how signalling networks
operate. It remains to be clarified whether and how
sorting of receptor complexes into intra-endosomal vesicles
during the formation of multivesicular bodies correlates
with the termination of endosomal signalling.
Furthermore, it is clear that responses generated shortly
after growth factor exposure are not limited only to the
plasma membrane and endosomes. Intriguingly, upon
receptor tyrosine kinase endocytosis, phosphatidylinositol-
3,4,5-triphosphate is produced on endoplasmic reticulum
(ER) and Golgi membranes [65]. Similarly, the ER
appears to be a site of EGFR and PDGFR dephosphorylation
following their internalisation [66]. In addition to
its established role on the plasma membrane and more
recently recognised function in endosomes ([67,68];
reviewed in [69]), Ras is localized to the ER and Golgi
complex where it can be activated by specific exchange
factors [70]. Dynamic interactions between the ER, the
plasma membrane and the endosomal system contribute
to phagosome formation and antigen cross-presentation in
macrophages and dendritic cells [71–73], thus underscoring
the plasticity of these compartments under different
physiological conditions. These observations raise the
intriguing question of how the extensive communication
between endosomes and the organelles of the biosynthetic
pathway contributes to the repertoire of regulatory
mechanisms of the cellular signalling machinery.
Сайт создан в системе
uCoz