Эксперименты на млекопитающих позволили предположить, что конкуренция за ограничивающие рост или выживание факторы м.б. генеральным механизмом контроля размеров органов. В клетках
конкуренция наблюдается в имагинальных дисках. Медленно растущие клетки элиминируются, если они рядом с клетками, растущими с нормальной скоростью. Медленно растущие клетки в этих исследованиях были гетерозиготами по одной из нескольких мутаций
, кодирующих рибосомальные белки.
Недавно была установлена связь между клеточной конкуренцией и передачей сигналов секретируемого фактора Dpp. Элиминации медленно растущих
М/+ клеток предшествует усиление активности гена
brinker (brk), который запускает клеточную гибель. Экспрессия
brk подавляется с помощью высоких уровней Dpp. Т.к. в клетках
М/+ усиление активности
brk и элиминация клеток с помощью апоптоза также запускаются в клетках вблизи к источнику Dpp, которые нечувствительны к Dpp, т.к. они лишены Dpp рецептора Thickveins (Tkv). Медленно растущие клетки проигрывают конкуренцию, т.к. они менее эффективны в интернализации Dpp посредством эндоцитоза и в результате получают меньше сигналов выживания. проблема с этой простой моделью в том. что клетки удалённые от передне-задней границы - места продукции Dpp - обладают высокими уровнями Brk, но не погибают, а растут с той же скоростью, что и клетки вблизи источника Dpp. В самом деле
tkv мутантные клоны также выживают в этих областях. Следовательно, уровни
brk не коррелируют с потенциалом роста и жизнеспособности клеток во всех условиях.
Альтернативное объяснение для наблюдаемых параллелей между элиминацией
tkv клеток и
М/+ клеток в том, что соседство клеток с разными свойствами клеточной поверхности является триггером для элиминации. Усиление активности
brk в
М/+ клетках м. запускать различные поверхностные признаки (positional identities) одним и тем же способом, как и в
tkv мутантных клетках. Т.о., клеточная конкуренция м.б. механизмом клеточной полиции, которая элиминирует клетки, которые по разным причинам не нравятся сообществу. Играет ли этот механизм клеточной конкуренции главную роль в контроле размеров органов, пока неясно.
Haw Are Pattern Formation and Growth Connected?
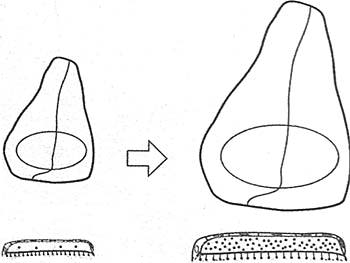 Figure 3. Model for the Coordinated Control of Growth and Patterning In the Drosophila Wing Disc
Figure 3. Model for the Coordinated Control of Growth and Patterning In the Drosophila Wing Disc
A schematic representation of a growing (left) and a mature (right) wing disc is shown at the top. Corresponding cross-sections through the wing blade region are depicted below. The wing disc originates from the infolding of the embryonic ectoderm and consists of pseudostratified epithelial cells containing a basal-lateral side (yellow) and an apical side (red).The apical surface faces the disc lumen that is formed by the epithelium and the overlaying peripodial membrane (black), consisting of squamous epithelial cells. The morphogen and growth factor Dpp (yellow) is secreted basal-lateralty by the Dpp-producing cells located anterior to the anterior-posterior compartment boundary (line through centre of wing disc). The Dpp concentration gradient from the anterior-posterior boundary to the periphery provides the anterior-posterior patterning cues. In addition, Dpp is also secreted apically into the disc lumen where is can diffuse freely. The model proposes that luminal Dpp acts as a growth-promoting factor stimulating disc growth in young discs. As the disc grows, a hypothetical growth inhibitor (blue dots) is also secreted apically and antagonizes the growth promoting activity of Dpp. Once the concentration of the inhibitor has reached a certain threshold, proliferation of wing imaginal disc cells ceases. (DOI:10.1371/journal/pbio.OOOOO86.gOO3)
Размер органа связан с формированием паттерна. Интерферирует, напр., с механизмами формирования паттрна при имплантации кусочков, смоченных секретируемы фактором Shh в передню часть зачатка крыла цыплёнка или при эктопической экспрессии Hh или Dpp в крыле
Drosophila, что вызывает паттерн удвоений и сопутсвующего роста. Напротив, мутации частичной потери функции в
dpp редуцируют размер крыла. В противоположность эффектам, ызываемым модуляциями активности инсулиновго пути, стимуляция роста с помощью Dpp, по-видимому, тесно связана с формированием паттерна. Как? Это один из нереленных вопросов. Мало вероятно, что формирование паттерна морфогенов, подобных Dpp, действует непосредственно, способствуя росту, т.к. скоровти деления клеток одинаковы в областях с высокой и низкой концентрацией Dpp.
Привлекательная гипотеза позволяет продвинуться вперед, исходя из предедыщей мдели регенерации, постулирующей, что индивидуальные клетки зачатка органа определяют концентрационные градиенты специфических сигнальных молекул, таких как Dpp в крыловых дисках
Drosophila и Shh в зачатках конечностей позвоночных. В незрелых небольших зачатках градиенты являются ступенчатыми и клетки продолжают рост и делеятся. Т.к. источник градиента остаётся приблизительно постоянным, то его концентрационный градиент уплощается с ростом ткани. Когда различия в концентраии морфогена, ощущаемые двумя концами клетки вдоль оси градиента падают ниже определенного порога, то клетки прекращают рост. Хотя эта модель м. объяснить, почему рост и деления клеток не концентрируются вокруг источника морфогена, однако экспериментальные доказательства не подтверждают этого. Клоны клеток, экспрессирующие постоянно активную версию рецепторов Dpp, Tkv, обнаруживают усиленный рост, если окружены клетками с низкой активностью Tkv. Более того, постоянная избыточная экспрессия активированного Tkv в целом диске также способствует росту, что говорит против роста, индуцируемого с помощью дифференциальной активности Tkv на разных концах клетки.
Как же тогда норально гардированная активность Tkv обеспечивает гомогенный рост? Одним из вожможных решений проблемы является наблюдение, что Dpp в крыльях
Drosophila секретируется базально-латерально, также как и апикально. Т.к. Dpp, секретируемый на базально-латеральной стороне эпителия, обнаруживается в виде концентрационного градиента, то Dpp, секретируемый на апикальной стороне, накапливается в просвете диска, формируемом собственно дисковым эпителием и перипоидальной мембраной, чьи клетки также секретирут Dpp. М. предположить, что Dpp в просвете функционирует как генеральный способствующий росту фактор, тогда как Dpp, секретируемый градированным образом на бызально-латеральной стороне, индуцирует формирование паттерна. Способствующая росту функция отведена продуцируемому в просвет Dpp. Эта модель полагает, что Dpp получаемый на апикальной стороне клетки запускает разные клеточные ответы (рост, жизнеспособность или оба), по сравнению Dpp, воспринимаемым на базально-латеральной стороне (формироание паттерна) и является, по-видимому, необходимым для неравномерного распределения рецепторов Dpp или сигнальных компонентов водль апикально-базальной оси клетки.
В настоящее время более привлекательна гипотеза, постулирующая, что секретируемый способствующий росту фактор накапливается в зачатке органа и что его функции противодействует ингибитор, накапливающийся с задержкой (Nijhout 2003). Как только ингибитор достигает определенного порога и/или ростовой фактор поглощается, рост органа прекращается. Гипотетические модели активатора и ингибитора были постулированы для многих процессов формирования паттерна. Dpp и родственный TGFβ представляют собой подобный случай. Агонисты и антагонисты участвуют в формировании паттерна дорсо-вентральной оси эмбрионов
Drosophila и в лево-правосторонней ассиметрии у эмбрионов позвоночных. Необходимы дальнейшие эксперименты для идентификации компонентов, контролирующих рост органов.
Which Growth Promoting Pathways Are Regulated by Secreted Factors with Patterning Functions?
Хотя мало известно о связи между паттерн формирующими факторами и путями роста, некоторые потенциальные связи всё же описаны. напр., в глазных имагинальных дисках
Drosophila Hh регулирует рост непосредственно, контролируя экспрессию циклина Е, промотора G1/S перехода, и циклина D, промотора клеточного роста. Является ли это генеральным механизмом, с помощью которого Hh контролирует рост клеток и деления клеток, неясно, однако, в крыловых дисках, по крайней мере, эффект Hh, по-видимому, опосредуется Dpp. Тщательный поиск генов-мишеней, регулируемых этими паттерн-формирующими факторами в специфических развивающихся тканях с использованием техники микромассивов м. бы пролить дальнейший свет на то. как они контролируют клеточный рост непосредственно или опосредованно.
How is Body Size Controlled?
В противоположность контролю размеров органов с использованием локальных взаимодействий клеток, локально продуцирующих ростовые факторы, общий размер тела контролируется в первую очередь системными факторами. Размеры тела позвоночных зависят от гормонов роста и подчинённых инсулин-подобных факторов роста (IGFs). У беспозвоночных рост и размеры тела также регулируются системой insulin/IGF в ответ на питательные вещества. Финальный размер тела у насекомых предопределяется количеством циклов линек и это находится под контролем стероидного гормона экдизона и sesquiterpenoid ювенильного гормона. Несмотря на это изменения уровней экдизона или уровней инсулин-подобных пептидов у беспозвоночных или избыточная продукция гормонов роста у позвоночных м. увеличивать размеры тела только внутри определенных границ. Нельзя вырастить мышь до размеров слона, хотя недавняя идентификация ископаемых Phoberomys pattersoni указывает, что грызуны были некогда значительно больше, чем сегодня. В дополнение к гормональному контролю размеров тела имеются внутренне присущие генетические ограничения размеров органов и тела.
Сайт создан в системе
uCoz