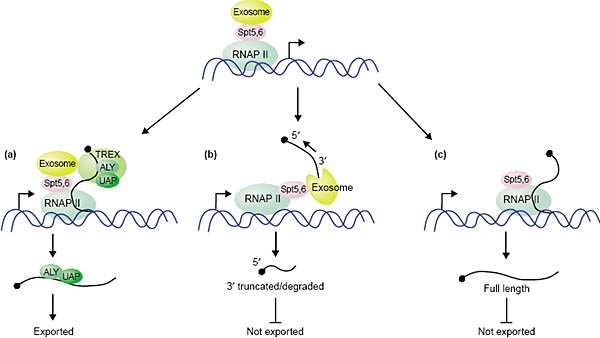
Выявлена ещё одна связь между экзосомами и факторами транскрипционной элонгации (Spt5 и Spt6) [22]. В этом исследовании Lis и др. показали. что экзосомы физически ассоциируют с Spt5 и Spt6
и рекрутируются на активно транскрибируемые гены, возможно с помощью этих белков. Предлагается модель того, как экзосомы, комплекс TREX, Spt5 и Spt6 регулируют транскрипционную элонгацию, образование мРНП и экспорт. Согласно этой модели Spt5 и Spt6 рекрутируют экзосому на RNA polymerase II на ранней стадии транскрипции (Рис. 2). Комплекс TREX, который ассоциирует с геном на поздней стадии транскрипции, м. физически защищать мРНП от экзосом или м. даже функционировать как ингибитор экзосом (Рис. 2a). Если комплекс TREX отсутствует (как у TREX-нулевых мутантов), то активность 30 - 50 exonuclease экзосомы
разрушает растущую мРНП и ведет к диссоциации РНК полимеразы от ДНК и т.о., блокирует транскрипционную элогнацию (Рис. 2b). Если и TREX
комплекс и экзосома отсутствуют, то генерируются транскрипты полной длины, но они не экспортируются, т.к. не поставляется экспортная machinery (Рис. 2c). Т.о., причиной соединения экзосом с комплексом TREX является обеспечение того, чтобы любой транскрипт, который лишен комплекса TREX, несмотря на присутствие мРНК экспортной machinery, направлялся на деструкцию.
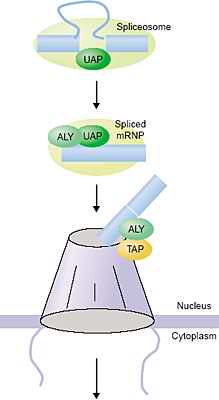
Хотя большое число доказательств указывает на то, что кухня экспорта мРНК ко-транскрипционно загружается на мРНК у дрожжей, однако, формирование 3' конца м. играть более критическую роль в этой загрузке. Напр., Lei and Silver [12] нашли, что Sub2 не нужна для рекрутирования Yra1 на гены, у которых отсутствуют интроны. Однако, собственно образование 3'-концов необходимо для рекрутирования этого фактора, независимо от того присутствует или нет интрон. Это подтверждает ранние работы, показавшие, что образование 3' конца важно для экспорта мРНК [6,7]. Группа Rosbash's недавно сообщила, что транскрипты, генерируемые с помощью T7 полимеразы (т.е. не с помощью RNA polymerase II) экспортируются только, если образование 3'-конца происходит нормально [23]. Это подтверждено и в работе Hammel et al. [24]. При скрининге генов, необходимых для экспорта мРНК, выявлено несколько факторов, участвующих в терминации и 3' процессинге. Это исследование показало также, что делеции последовательностей в мРНК, которые участвуют в купировании завершения и образования 3' конца, ведут к синтезу транскриптов, которые не м.б. экспортированы. Следовательно, терминация, 3' процессинг и экспорт мРНК взаимосвязаны.
Coupling transcription and splicing to
mRNA export in metazoans
Исследования на metazoans подтвердили, что транскрипция м. влиять на сплайсинг и наоборот [25-28]. В частности,
Strasser et al. [15] идентифицировали скорее всего аналог комплекса TREX у млекопитающих. Как и у дрожжей этот комплекс содержит белки экспорта мРНК (Aly и UAP56), а также компоненты комплекса THO (hTho2 и hHpr1). Пока неясно, может ли этот предполагаемый комплекс
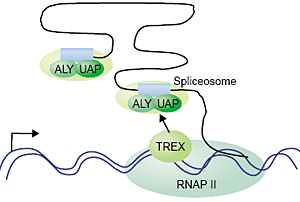 In this model, coupling transcription, splicing and export via the TREX
complex targets the export machinery to exons. Metazoan introns
are typically very large whereas the exons are minute. The TREX
complex may associate with the spliceosome to allow co-transcriptional
loading of the export machinery (Aly and UAP56) onto exons, which are
destined for export, and to exclude this machinery from the introns,
which are retained in the nucleus.
In this model, coupling transcription, splicing and export via the TREX
complex targets the export machinery to exons. Metazoan introns
are typically very large whereas the exons are minute. The TREX
complex may associate with the spliceosome to allow co-transcriptional
loading of the export machinery (Aly and UAP56) onto exons, which are
destined for export, and to exclude this machinery from the introns,
which are retained in the nucleus.
TREX млекопитающих ассоциировать с синтезируемой пре-мРНК во время транскрипции. Однако, все компоненты комплекса TREX млекопитающих обнаружены в очищенных сплайсесомах [29-32]. Т.о., TREX комплекс м. функционировать, чтобы связать и транскрипцию и сплайсинг с экспортом мРНК у метазоа. У metazoans многочисленны интроны обычно в тысячи и десятки тысяч нуклеотидов, а могут быть и больше до нескольких сотен тысяч нуклеотидов. Экзоны в среднем длиной в 100 нуклеотидов. Как показано на Рис. 3, комплекс TREX м.б. ассоциирован с сплайсесомами в качестве механизма для ко-транскрипционного таргетинга факторов экспорта мРНК только в экзоны, которые предназначены для экспорта, а не в интроны, которые деградируют в ядре.
Conclusions
Recent studies strengthen the view that mRNA export is
coupled to other steps in gene expression including
splicing, transcription, and 30-end formation. In addition,
new links between mRNA export, transcription and the
nuclear exosome were revealed. Future directions will
include a detailed characterization of the spliced mRNP
and EJC that couples splicing to mRNA export. In addition,
the role of the TREX complex in export and
transcription, and the relationship between these processes
and the nuclear exosome remain to be determined.
Finally, the molecular basis for coupling 30-end formation
to mRNA export must be identified.
Сайт создан в системе
uCoz