Cadherin 23 is a component of the tip link in hair-cell stereocilia | |
|
Mechanoelectrical transduction, the conversion of mechanical
force into electrochemical signals, underlies a range of sensory
phenomena, including touch, hearing and balance. Hair cells of
the vertebrate inner ear are specialized mechanosensors that
transduce mechanical forces arising from sound waves and
head movement to provide our senses of hearing and balance
1,2 ; however, the mechanotransduction channel of hair cells and the
molecules that regulate channel activity have remained elusive.
One molecule that might participate in mechanoelectrical trans-duction
is cadherin 23 (CDH23), as mutations in its gene cause
deafness and age-related hearing loss 3–6. Furthermore, CDH23 is
large enough to be thetip link,the extracellularfilament
proposed to gate the mechanotransduction channel 7. Here we
show that antibodies against CDH23 label the tip link, and that
CDH23 has biochemical properties similar to those of the tip
link. Moreover, CDH23 forms a complex with myosin-1c, the
only known component of the mechanotransduction apparatus
8, suggesting that CDH23 and myosin-1c cooperate to regulate the
activity of mechanically gated ion channels in hair cells.
|
Механически чувствительные органеллы волосковых клеток, пучки волосков, содержат десятки богатых актином стереоцилий (stereocilia) и одиночный базирующийся на микротрубочках kinocilium (Fig. 1a). Каналы механотрансдукции, расположены в направлении кончиков стереоцилий, открыты или закрыты в зависимости от изгиба стереоцилий1-2. Возбуждающие стимулы натягивают воротный механизм (gating spring), эластичный элемент, который открывает и закрывает каналы механотрансдукции9. Из внеклеточных филамент, которые взаимосвязывают стереоцилии или стереоцилии и киноцилиум, только в 150-200-nm верхушечные связи (tip link) располагаются корректно, чтобы контролировать открытие механотрансдуцирующих каналов7,10. Молекулярный состав верхушечных связей неизвестен, но они сходны со связями между kinocilia и стереоцилиями; обе структуры распознаются антителами против неизвестного белка, названного tip link antigen11. Верхушечная связь обладает также общими свойствами с кадхеринами. Не только верхушечные связи обеспечивает адгезивные взаимодействия между соседними плазматическими мембранами, но и Ca2+ chelating агенты, разрушают одинаково и верхушечные связи10 и адгезивную функцию кадхеринов12. Т.к. одиночные cadherin домены распространяются приблизительно на 4 nm13, то гомофилически взаимодействующие молекулы CDH23 с 27 cadherin доменами каждый, м. иметь длину более 200 nm.
Описаны две альтернативно сплайсированные изоформы CDH23 отличаются в отношении включения экзона 68, кодирующего часть внутриклеточного домена CDH23,3,5,14 (Рис. 1b). Используя polymerase chain
reaction with reverse transcription (RT-PCR), мы выявили мРНК, кодирующие CDH23(+ 68) и CDH23(- 68) во внутреннем ухе взрослых мышей; CDH23(+ 68) превалировал во внутреннем ухе, но не обнаруживался в др. тканях (Рис. 1c и данные не показаны). Чтобы локализовать белок CDH23 мы использовали антитела (CDH23*cyto), которые распознают цитоплазматический домен обеих изоформ, и др. антитела (CDH23*68), которые специфичны к CDH23(+ 68) (Sup-plementary Fig. 1). На постнатальный 0 и 5 дни развития (P0 и P5, соотв.), когда волосковые клетки улиток были незрелые и содержали kinocilium, CDH23*cyto выявляли CDH23 в развивающихся пучках волоковых клеток и в Reissner's мембране (Рис. 1e, g, h). Напротив, антитела CDH23*68 выявляли CDH23(+ 68) только в волосковых пучках (Рис. 1f ). На ст. P42, когда волосковые клетки зрелые и теряют свой kinocilium, CDH23 всё ещё экспрессируется в волосковых клетках улитки, но только вблизи кончиков стереоцилий (Рис. 1i). В вестибулярных волосковых клетках, которые достигают зрелости примерно при рождении,
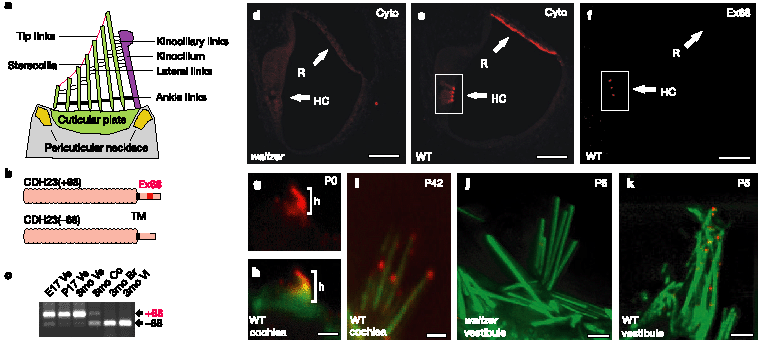 Figure 1 CDH23 expression in mouse inner ears. a, Stereocilia are connected through tip, lateral and ankle links, and to the kinocilium through kinocilia links. b, CDH23 protein. Exon 68 is present only in CDH23(+68). TM, transmembrane domain. c, Analysis of CDH23 expression in the vestibule (VE), cochlea (Co), brain (Br) and vibrissae (Vi). E17,
embryonic day 17; P17, postnatal day 17; 3mo, 3 months. d-f, Section of a P5 cochlea. d, e, CDH23*cyto (red) stained hair cells (HC) and Reissner's membrane (R) in wild-type (WT) but not in Cdh23-deficient waltzer mice. f, CDH23*68 stained hair bundles only. g, h, CDH23 (red) in immature P0 cochlear hair cells was distributed throughout the hair bundle (h) (green, phalloidin). i-k, CDH23 in mature hair cells was confined to stereociliary tips, but was absent in waltzer mice. Scale bars: d-f,40µm; g-k, 1.25µm.
CDH23 ограничивается уже на P5 кончиками стереоцилий (Рис. 1k). Иммунореактивность на CDH23 не выявляется у Cdh23-дефицитных waltzer мышей (Fig. 1d, j). Антисыворотка CDH23*cyto перекрестно реагирует с CDH23 лягушки-вола (bullfrog)(Supplementary Fig. 2), это позволяет анализировать экспрессию CDH23 в волосковых клетках bullfrog, которые крупнее, чем волосковые клетки мышей и не теряют свои kinocilium. Оптические срезы, ориентированные перпендикулярно к пучкам волосков, показывают, что CDH23 концентрируется вблизи кончиков стереоцилий (Рис. 2a, b). В изолированных волосковых клетках CDH23 концентрируется там, где наиболее высокая стереоцилия контактирует с kinocilium и на кончиках стереоцилий (Рис. 2c, d). Figure 1 CDH23 expression in mouse inner ears. a, Stereocilia are connected through tip, lateral and ankle links, and to the kinocilium through kinocilia links. b, CDH23 protein. Exon 68 is present only in CDH23(+68). TM, transmembrane domain. c, Analysis of CDH23 expression in the vestibule (VE), cochlea (Co), brain (Br) and vibrissae (Vi). E17,
embryonic day 17; P17, postnatal day 17; 3mo, 3 months. d-f, Section of a P5 cochlea. d, e, CDH23*cyto (red) stained hair cells (HC) and Reissner's membrane (R) in wild-type (WT) but not in Cdh23-deficient waltzer mice. f, CDH23*68 stained hair bundles only. g, h, CDH23 (red) in immature P0 cochlear hair cells was distributed throughout the hair bundle (h) (green, phalloidin). i-k, CDH23 in mature hair cells was confined to stereociliary tips, but was absent in waltzer mice. Scale bars: d-f,40µm; g-k, 1.25µm.
CDH23 ограничивается уже на P5 кончиками стереоцилий (Рис. 1k). Иммунореактивность на CDH23 не выявляется у Cdh23-дефицитных waltzer мышей (Fig. 1d, j). Антисыворотка CDH23*cyto перекрестно реагирует с CDH23 лягушки-вола (bullfrog)(Supplementary Fig. 2), это позволяет анализировать экспрессию CDH23 в волосковых клетках bullfrog, которые крупнее, чем волосковые клетки мышей и не теряют свои kinocilium. Оптические срезы, ориентированные перпендикулярно к пучкам волосков, показывают, что CDH23 концентрируется вблизи кончиков стереоцилий (Рис. 2a, b). В изолированных волосковых клетках CDH23 концентрируется там, где наиболее высокая стереоцилия контактирует с kinocilium и на кончиках стереоцилий (Рис. 2c, d).
Чтобы проверить, действительно ли CDH23 является компонентом tip link, была использована иммуноэлектронная микроскопия с теми же самыми CDH23*cyto антителами, специфически метящих кончики стереоцилий у дикого типа, но не у waltzer мышей (Fig. 1i-k). Антитела, метящие tip link волосковых клеток у мышей и bullfrog (Fig. 2e-i). Более половины (57%) от всех частиц золота (n =192) были найдены на кончиках стереоцилий, где нижний конец tip link, как ожидается вступает в стереоцилии. Положение боковой бляшки, метящей верхний конец каждой верхушечной связи (tip link), м.б. выведено из положения более короткой соседней стереоцилии и находится на несколько сотен наномер выше (см. Методы); 23% золотых частиц выявлено в этом положении. 10% золотых частиц распределено случайно вдоль стереоцилий и 10% находится вне стереоцилий. Мы наблюдали мечение иммуно-золотом внутриклеточно на tip link инсерционных точках и внеклеточно вблизи плазматической мембраны. Длина сендвича из двух антител (приблизительно 20-30 nm) и разрывы мембраны на tip links15-17
м. объяснить кажущуюся внеклеточную локализацию частиц золота. Мы наблюдали сходную внеклеточную локализацию иммуно-золота, когда определяли мембранный phospholipid phosphatidyl-inositol-4,5-biphosphate в пучках волосков (данные не показаны). Мы наблюдали от 1 до 12 частиц золота на сайт инсерции tip link: некоторые частицы золота наблюдались из-за того, что присутствовало больше, одной CDH23 молекул; более того, антитела, как ожидается, распознают несколько эпитопов внутри ~268-аминокислотного цитоплазматического домена CDH23. Мечения не наблюдалось только лишь со вторичными антителами (Fig. 2j). У bullfrog антитела CDH23*cyto также метят kinociliary связи (Supplementary Fig. 3; gold particles excluded from quantification).
Верхушечные связи разрушаются при воздействии на волосковые клетки Ca2+ chelators и La3+ (refs 10, 18). Воздействие на волосковые клетки EGTA (Рис. 3a-d) или BAPTA (данные не показаны)устраняет окрашивание пучков на CDH23 у приблизительно 75% волосковых клеток. Вместо этого интенсивное окрашивание наблюдается в перикутикулярном ожерелье (Рис. 3b), в богатом пузырьками компартменте на апикальной поверхности волосковых клеток19. Этот пул CDH23 м. возникать в результате нового синтеза, перераспределения из тела клеток в стереоцилии. В пучках,
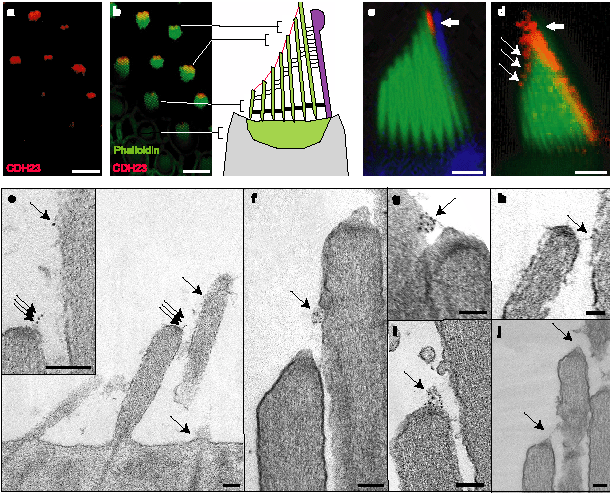 Figure 2 CDH23 expression in hair cells. a, b, Whole-mount bullfrog saccules were stained with CDH23*cyto antibody (red) and with phalloidin (green). Optical sections were cut through hair bundles at levels approximately as indicated. CDH23 was localized towards stereociliary tips. c, d, Isolated bullfrog hair cells were stained with anti-tubulin (blue) (c), and CDH23*cyto (red) and phalloidin (green) (c, d). In c the intensity gain was decreased during imaging to highlight CDH23 localization at the stereocilium-kinocilium interface (thick arrow). CDH23 was also localized at stereociliary tips (thin arrows).
e-j, Immunogold electron microscopy in mouse (e) and bullfrog (f-j) hair cells; CDH23 was found at the tip link (arrows indicate localization of all gold particles in image).j, Primary antibody was omitted (arrows point to tip link). Scale bars: a, b,11µm; c, d,5mm; e-j, 100 nm.
который остаются иммунореактивными, мечение в стереоцилиях обычно нарушено более по длине, чем в контроле (данные не показаны), что подтверждает последнюю гипотезу. Верхушечные связи появляются вновь спустя 12-24 ч после удаления Ca2+ chelators20; сходным образом, мы выявляли сильную CDH23 иммунореактивность спустя 24 ч после удаления EGTA или BAPTA (Fig. 3d). Figure 2 CDH23 expression in hair cells. a, b, Whole-mount bullfrog saccules were stained with CDH23*cyto antibody (red) and with phalloidin (green). Optical sections were cut through hair bundles at levels approximately as indicated. CDH23 was localized towards stereociliary tips. c, d, Isolated bullfrog hair cells were stained with anti-tubulin (blue) (c), and CDH23*cyto (red) and phalloidin (green) (c, d). In c the intensity gain was decreased during imaging to highlight CDH23 localization at the stereocilium-kinocilium interface (thick arrow). CDH23 was also localized at stereociliary tips (thin arrows).
e-j, Immunogold electron microscopy in mouse (e) and bullfrog (f-j) hair cells; CDH23 was found at the tip link (arrows indicate localization of all gold particles in image).j, Primary antibody was omitted (arrows point to tip link). Scale bars: a, b,11µm; c, d,5mm; e-j, 100 nm.
который остаются иммунореактивными, мечение в стереоцилиях обычно нарушено более по длине, чем в контроле (данные не показаны), что подтверждает последнюю гипотезу. Верхушечные связи появляются вновь спустя 12-24 ч после удаления Ca2+ chelators20; сходным образом, мы выявляли сильную CDH23 иммунореактивность спустя 24 ч после удаления EGTA или BAPTA (Fig. 3d).
Наконец, обработка La3+ не только разрушала верхушечные связи, но и обусловливала немедленную потерю CDH23 иммунореактивности из стереоцилий. В противоположность результатам с Ca2+ chelators, не отмечено увеличения мечения перикутикулярного ожерелья после обработки La3+ (Fig. 3e, f ). Верхушечные связи чувствительны к протеолитическому перевариванию с помощью эластазы, но не с помощью subtilisin, который расщепляет "щиколоточные" (ankle) связи21,22
. Мы экспрессировали мРНК CDH23 полоной длины в клетках HEK293, обработанных elastase и subtilisin, и определяли CDH23 с помощью western blotting. CDH23 деградируется с помощью elastase, но не subtilisin (Fig. 3g). CDH23 м. соединять стереоцилии с помощью механизма гомофильного связывания. Чтобы проверить адгезивную функцию CDH23, была получена линия клеток L929 cell, экспрессирующая полной длины CDH23 (L-CDH23 клетки) или, в качестве контроля, E-cadherin (L-ECDH клетки) (Supplementary Fig. 4). При анализе агрегации клеток L-ECDH клетки и L-CDH23 клетки, но не родительские L929 клетки, формировали агрегаты; агрегация ингибировалась с помощью EGTA (Fig. 3h, i). Т.к. агрегация L-CDH23 клеток м.б. обусловлена гомофильными взаимодействиями между молекулами CDH23 или с помощью гетерофильных взаимодействий в др. рецепторами клеточной поверхности, то мы метили клеточные линии флюоресцентными красками DiI и DiO, и анализировали образование агрегатов с помощью электронной микроскопии. DiI-меченные L-CDH23 клетки формировали смешанные агрегаты с DiO-меченными L-CDH23 клетками, но не с родительскими L929 клетками или с L-ECDH клетками (Рис. 3j). L-CDH23 и L-ECDH клетки сегрегировали на отдельные агрегаты (Рис. 3j), тогда как родительские L929 клетки оставались разрозненными (данные не показаны). Эти результаты демонстрируют, что CDH23 обеспечивают Ca2+-зависимую гомофильную адгезию клеток.
Myosin-1c (MYO1C) локализуется на кончиках стереоцилий23 и действует в качестве адаптационного мотора для каналов механотрансдукции8. Чтобы проверить, могут ли MYO1C и CDH23 взаимодействовать непосредственно или опосредованно, мы ко-экспрессировали в HEK293 клетках MYO1C и слитый белок, содержащий цитоплазматический домен CDH23 , а также трансмембранные и внеклеточный домены interleukin-2 receptor (IL2R)14 (Рис. 4a). В качестве контроля мы экспрессировали конструкцию, лишенную цитоплазматического домена CDH23 (IL2R-DCyto). Все конструкции экспрессировались эффективно (Рис. 4b, средняя и нижняя панели). MYO1C ко-преципитировался с IL2R-CDH23(-68) и IL2R-CDH23(+68), но не с IL2R-DCyto (Рис. 4b, верхняя панель). Сходным образом, IL2R-CDH23(+ 68), но не IL2R-DCyto, ко-преципитировался с MYO1C
(Рис. 4c). Используя иммунофлюоресцентную микроскопию трансфицированных клеток (Рис. 4d; see also Supplementary Fig. 5), мы нашли, что обе молекулы ко-локализуются на периферии клеток. Ко-локализация зависела от CHD23 цитоплазматического домена.
Мы привели здесь 6 линий доказательств, подтверждающих предположение, что CDH23 является компонентом tip link. Во-первых, CDH23 локализуется на tip links. Во-вторых, CDH23 локализуется на kinociliary связях, которые иммунологически родственны верхушечным связям11
. В-третьих, реагенты, которые разрушают интеграцию верхушечных связей, такие как La3+ и EGTA10,18, нарушают и субклеточное распределение CDH23 в волосковых клетках. В-четвертых, elastase разрушает tip link21 и расщепляет CDH23 белок, тогда как и верхушечные связи и CDH23 резистентны к протеолизу с помощью subtilisin, который как известно расщепляет ankle связь22. В-пятых, CDH23 обеспечивает гомофильные взаимодействия, а Ca2+ chelators, которые разрушают верхушечные связи, разрушают и адгезивную функцию CDH23.
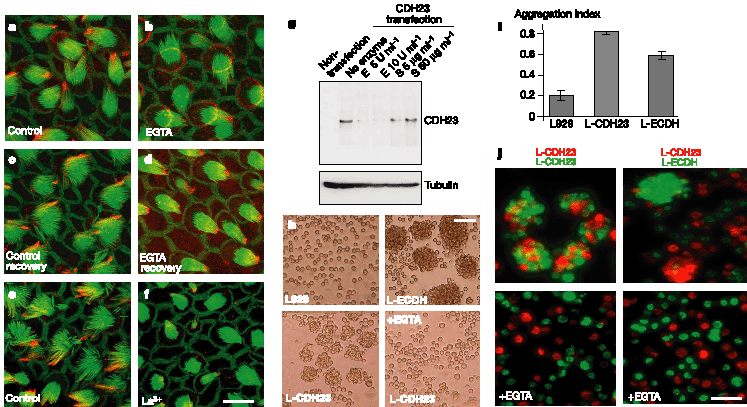 Figure 3 Biochemical properties of CDH23. a-d, Bullfrog saccules were treated with EGTA and stained with CDH23*cyto (red) and phalloidin (green). After EGTA treatment, CDH23 disappeared from stereocilia and appeared at the apical hair-cell surface; on EGTA removal, CDH23 reappeared in the bundle after 24 h (recovery). e, f,La3+
treatment caused loss of CDH23 immunostaining. g, Recombinant CDH23 protein expressed in HEK293 cells was sensitive to elastase (E) but not subtilisin (S). Control tubulin protein was insensitive to both proteases. h-j, Cell aggregation assays. h, L-CDH23 and L-ECDH cells formed aggregates. L-CDH23 aggregates were disrupted by EGTA. i, The aggregation index was determined 28 (N 0 2 N T /N 0 ; where N 0 is the
number of particles with EGTA and N T is the number of particles without EGTA). Mean and standard deviation are shown. j, DiI-labelled L-CDH23 cells (red) formed mixed aggregates with DiO-labelled L-CDH23 cells (green), but not with L-ECDH cells (green).Aggregation was blocked by EGTA. Scale bars: a-f,8µm; h, j,60µm. Figure 3 Biochemical properties of CDH23. a-d, Bullfrog saccules were treated with EGTA and stained with CDH23*cyto (red) and phalloidin (green). After EGTA treatment, CDH23 disappeared from stereocilia and appeared at the apical hair-cell surface; on EGTA removal, CDH23 reappeared in the bundle after 24 h (recovery). e, f,La3+
treatment caused loss of CDH23 immunostaining. g, Recombinant CDH23 protein expressed in HEK293 cells was sensitive to elastase (E) but not subtilisin (S). Control tubulin protein was insensitive to both proteases. h-j, Cell aggregation assays. h, L-CDH23 and L-ECDH cells formed aggregates. L-CDH23 aggregates were disrupted by EGTA. i, The aggregation index was determined 28 (N 0 2 N T /N 0 ; where N 0 is the
number of particles with EGTA and N T is the number of particles without EGTA). Mean and standard deviation are shown. j, DiI-labelled L-CDH23 cells (red) formed mixed aggregates with DiO-labelled L-CDH23 cells (green), but not with L-ECDH cells (green).Aggregation was blocked by EGTA. Scale bars: a-f,8µm; h, j,60µm.
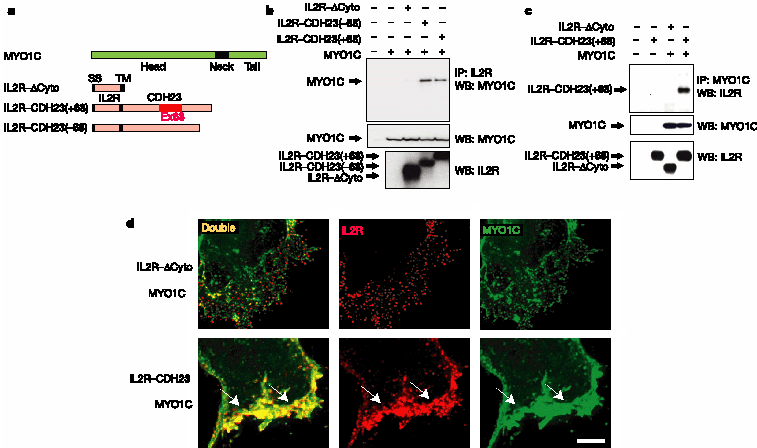 Figure 4 Interaction of IL2R-CDH23 with MYO1C. a, Diagram of MYO1C and of fusion proteins containing the extracellular and transmembrane domain of IL2R and the cytoplasmic domain of CDH23. b, Extracts from HEK293 cells transfected to express the constructs indicated on top of the panel were immunoprecipitated (IP) with IL2R or MYO1C antibodies. Proteins were visualized by western blotting (WB). As expression control, extracts were analysed without immunoprecipitation. c, MYO1C co-precipitated with
IL2R-CDH23(2 68) and IL2R-CDH23(+ 68), but not with IL2R-DCyto. c, IL2R-CDH23(+ 68) but not IL2R-DCyto co-immunoprecipitated with MYO1C. d, Transfected cells were stained with IL2R (red) and MYO1C (green) antibodies. MYO1C co-localized with IL2R-CDH23(+ 68) but not with IL2R-DCyto. Scale bar: 3.5µm.
В-шестых, CDH23 ко-иммунопреципитирует с MYO1C, мотором для медленной адаптации каналов механотрансдукции, которые располагаются по соседству с кончиками стереоцилий8. В согласии с нашими данными и то, чтоtip links отсутствуют у рыбок данио, которые несут мутацию в гене cdh2324. Наши находки позволют объяснить, почему экспрессия CDH23 не была выявлена ранее в влосковых клетках мышей после P30
(ref. 25); это потому, что kinocilium не сохраняются в волосковых клетках у взрослых мышей, а низкая экспрессия его на кончиках стереоцилий предупреждала его обнаружение. Figure 4 Interaction of IL2R-CDH23 with MYO1C. a, Diagram of MYO1C and of fusion proteins containing the extracellular and transmembrane domain of IL2R and the cytoplasmic domain of CDH23. b, Extracts from HEK293 cells transfected to express the constructs indicated on top of the panel were immunoprecipitated (IP) with IL2R or MYO1C antibodies. Proteins were visualized by western blotting (WB). As expression control, extracts were analysed without immunoprecipitation. c, MYO1C co-precipitated with
IL2R-CDH23(2 68) and IL2R-CDH23(+ 68), but not with IL2R-DCyto. c, IL2R-CDH23(+ 68) but not IL2R-DCyto co-immunoprecipitated with MYO1C. d, Transfected cells were stained with IL2R (red) and MYO1C (green) antibodies. MYO1C co-localized with IL2R-CDH23(+ 68) but not with IL2R-DCyto. Scale bar: 3.5µm.
В-шестых, CDH23 ко-иммунопреципитирует с MYO1C, мотором для медленной адаптации каналов механотрансдукции, которые располагаются по соседству с кончиками стереоцилий8. В согласии с нашими данными и то, чтоtip links отсутствуют у рыбок данио, которые несут мутацию в гене cdh2324. Наши находки позволют объяснить, почему экспрессия CDH23 не была выявлена ранее в влосковых клетках мышей после P30
(ref. 25); это потому, что kinocilium не сохраняются в волосковых клетках у взрослых мышей, а низкая экспрессия его на кончиках стереоцилий предупреждала его обнаружение.
Полученные данные согласуются с моделью, согласно которой CDH23 соединяет кончики стереоцилий, возможно благодаря механизму гомофильного связывания. Благодаря тому, что tip link разветвляется на две нити на своем верхнем конце и является крупнее в диаметре, чем кадхериновый димер18, верхушечная связь возможно конструируется более чем одним гомофильным димером CDH23. Она м. содержать дополнительные молекулы, такие как антиген верхушечной связи11, который д. вовлекаться в гетерофильные взаимодействия с CDH23. Из-за адаптации необходимо ~50 MYO1C молекул на верхушечную связь26 , а канал трансдукции д.б. по порядку между верхушечной связью и моторным комплексом, MYO1C и CDH23, по-видимому, взаимодействуют в волосковых клетках и в клетках культуры ткани посредством промежуточных молекул. Хотя было показано, что CDH23 играет роль в поддержании пучков волосков во время развития3, наши находки указывают на то, что его роль во взрослых волосковых клетках заключается в формировании связей kinocilia и верхушечных связей, которые передают силу механически перекрываемым ионным каналам. Двойная функция CDH23 в развивающихся и взрослых волосковых клетках м. объяснить фенотипическую вариабельность, обусловленную мутациями в гене Cdh23. Мутации, которые затрагивают сборку и поддержание пучков волосков, возможно инактивируют функцию Cdh233. Напротив, связанная с возрастом потеря слуха обусловливается полиморфизмом в экзоне, который кодирует часть внеклеточного домена6. Эта мутация м. редуцировать адгезивную функцию CDH23 и влиять на функцию трансдукции каналов.
|