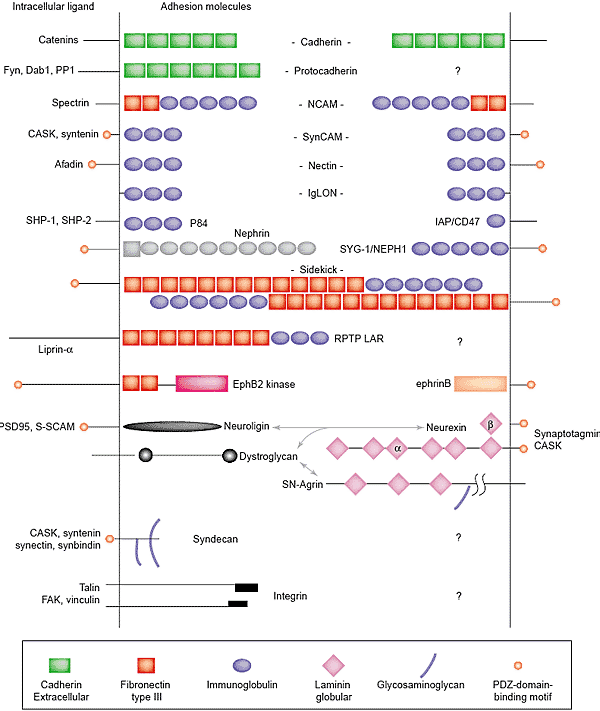
52 protocadherin гена тандемно расположенрных α, β и
γ кластеров также являются привлекательными кандидатами на роль медиаторов синаптической специфичности; в самом деле, их первоначальное описание привело к сумасшедшим спекуляциям по этому вопросу. К сожалению, генетические нарушения кластеров α и β ещё не описаны, а наиболее поразительные фенотипы у мышей, лишенных всего γ кластера, которые погибают незадолго до рождения, характеризуются заметной дегенерацией и апоптозом избранных субпопуляций нейронов, в частности спинальных промежуточных нейронов [27]. Апоптоз наблюдается также в нейронах, культивируемых от мутантов, подтверждая, что он м.б. просто вторичным следствием аберрантных синаптических соединений. Очень возможно, что protocadherins необходимы отдельно для жизнеспособности и для специфичности синапсов, но генетический анализ этой возможности отслежен перинатальной летальностью.
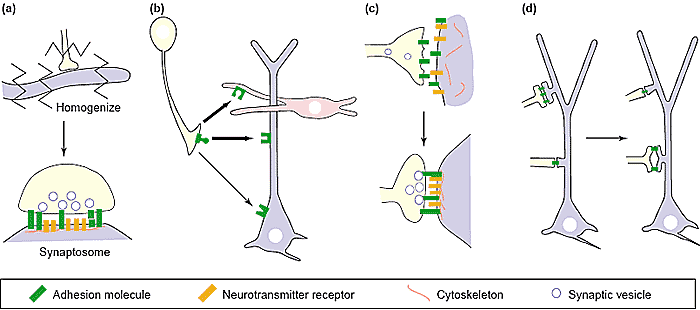
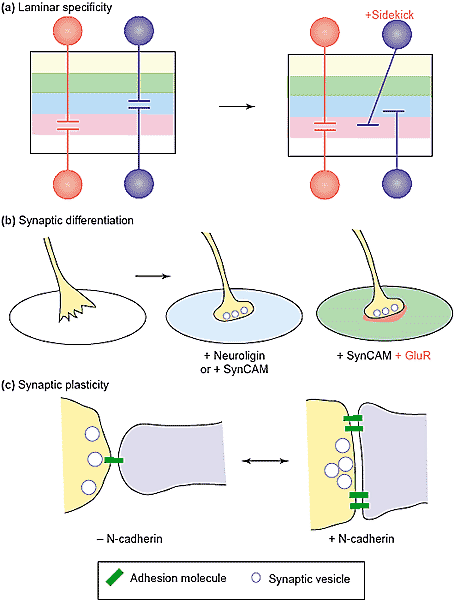
Многие аксоны м. высвобождать небольшие количества нейротрансмиттеров даже до того, как они контактируют с пост-синаптическим партнером, а многие пост-синаптические клетки несут функциональные рецепторы нейротрансмиттеров до того, как они становятся иннервированы [2]. Установив контакт пре- и пост-синаптических отростков, machineries для высвобождения и реакции на нейротрансмиттеры становятся более надежными, фокусируются на местах контактов и помещаются в точном соответствии др. к др. Ключевым свойством пресинаптической дифференцировки является агрегация синаптических пузырьков и ассоциация с активной зоной; ключевым свойством пост-синаптической дифференцировки является образование кластеров постсинаптических рецепторов и ассоциация с сигнальными белками [9]. Тот факт, что эти специализации формируются специфически в местах контакта, и что они формируют точные соответствия, демонстрируют, что межклеточные общения необходимы для синаптогенеза. В отсутствие синапсов сигнальные мехнизмы хорошо известны, но идентифицировано мало молекул, организующих синапсы, в скелетных NMJ: производный нервов proteoglycan z-agrin является ключевым организатором пост-синаптической дифференцировки; а производные мышц laminin тримеры, содержащие β2 субъединицу, необходимы для завершения пре-синаптической дифференцировки [2]. Важно, что обе эти молекулы стабильно закреплены на базальной ламине, которая формирует материал щели этого синапса, и обе они взаимодействуют с рецепторами, включая интегрины, на нервной и мышечной части мембраны. Др. словами, они являются адгезивными молекулами. Следовательно, рассматривая, как синаптогенез регулируется в межнейронных синапсах адгезивные молекулы д. находиться под подозрением. Важным методом для выяснения молекул, организующих синапсы, является экспрессия их в гетерологичных клетках, ко-культивирование их с нейронами и выяснение, формируются ли пре- и пост-синаптические специализации в местах контактов. Этот подход был использован с agrin и было установлено, что помимо своих пост-синаптических эффектов, он м. останавливать элонгацию аксонов и способствовать образованию кластеров пузырьков в двигательных аксонах [79]. Этот подход использован Scheiffele et al. [80], которые установили, что экспрессия пост-синаптических белков neuroligin-1 и -2 в не-нейрональных клетках, достаточна для индукции пре-синаптической дифференцировки (кластеров синаптических пузырьков, которые подвержены обмену) в аксонах, которые контактируют с ними (Рис. 3b). Использование растворимой версии β-neurexin, пре-синаптического neuroligin
лиганда, редуцирует образование кластеров в ко-культурах pontine
нейронов с их
in vivo мишенями, мозжечковыми гранулярными клетками. Известно, что мутации в двух генах neuroligin обнаружены у небольшого количества индивидов с аутизмом [81], это указывает на то, что нарушение синаптической адгезии м.б. причиной сложного нейрологического нарушения.
Biederer et al. [32], используя этот подход, чтобы охарактеризовать член сверхсемейства immunoglobulin, SynCAM-1, который ранее был охарактеризован как ген супрессора опухолей, TSLC-1 [82]. SynCAM является гомофильной адгезивной молекулой, экспрессирующейся в головном мозге и локализующимся на обеих сторонах синапсов. Экспрессия SynCAM в не-нейрональных клетках индуцирует пре-синаптичесекую дифференцировку нейронов гиппокампа в местах контакта (Рис. 3b). Авт. также ко-экспрессировали GluR2 glutamate рецепторы вместе с SynCAM в не-нейрональных клетках и установили, что эти рецепторы образуют кластеры оппозитно месту высвобождения синаптических пузырьков (stained with FM dyes) в ко-культурах нейронов гиппокампа. Возбуждение нейритов приводит к glutamatergic деполяризации в не-нейрональных клетках. Др. словами, реконструируются синапсы.
Совместные данные по neuroligin и SynCAM указывают на то, что адгезивные взаимодействия м.б. достаточны, по крайней мере, для некоторых аспектов синаптической дифференцировки стабилизации CNS. Общим свойством SynCAM, neurexin и neuroligin является то, что они соединяются с PDZ-каркасными белками, подтверждая модель, согласно которой обусловленное адгезией образование кластеров ключевых PDZ белков формирует рудиментарные поддержки вокруг которых развиваются в дальнейшем синаптические специализации. Очень важен следующих эксперимент, который позволит ответить, необходимы ли такие взаимодействия и
in vivo. Важно отметить результаты с agrin, упомянутые выше [79]: их отношенеи к NMJ
in vivo остаётся неясным (see Update).
Др. пара ассоциированных с мембранами молекул, участвующих в дифференцировке синапсов, является EphB рецепторная тирозин киназа и ее лиганды, the ephrinBs. Помимо того лиганд ephrinB в культивируемых нейронах индуцирует взаимодействие между внеклеточными доменами EphBs и NMDA-type glutamate рецепторами [47]. Это взаимодействие дает в результате увеличение синаптической плотности и притока NMDA-рецептором-обеспечиваемого calcium и генной экспрессии [83];напротив, нарушение передачи сигналов Eph/ephrin вмешивается в синаптическую пластичность [84]. Т.к. связывание ephrin/Eph м. вызывать в результате двунаправленные сигнальные события, так что взаимодействия в синапсах м. оказаться важными для скоординированного пре- и пост-синаптического развития, хотя EphB2 мутантные мыши имеют нормальную морфологию синапсов [15]. При потенциально аналогичном взаимодействии RPTP LAR ассоциирует с рецепторами в синапсах посредством внутриклеточных взаимодействий: цитоплазматический домен LAR ассоциирует с liprin-α/SYD-2, который связывает ассоциированный с рецепторами PDZ белок GRIP (glutamatereceptor-interacting protein) [39]. Это взаимодействия, по-видимому, важно для поверхностной экспрессии и образования кластеров в синаптических сайтах. Всё это подчеркивает важность фосфорилирования tyrosine для дифференцировки синапсов и подтверждает, что межклеточные взаимодействия м. действовать, отчасти, регулируя фосфорилирование. Это напоминает развитие NMJ, где мышце-специфичная рецепторная тирозин киназа (MuSK) является критической для всех аспектов постсинаптической дифференцировки, включая локальный синтез и образование кластеров nicotinic acetylcholine рецепторов [2].
Regulation of synaptic structure
Большинство возбуждающих синапсов в CNS образуется на дендритных шипах (spines), узловатых выпячиваниях дендритного ствола, которые действуют как сигнальные микродомены. Шипы являются высоко динамичными и подвергаются разнообразным базирующимся на актиновом цитоскелете изменениям формы во время синаптогенеза, когда они появляются, то происходят из подвижных филоподий и в ответ на изменения активности [85,86]. Благодаря изменениям в морфологии шипов был предположен лежащий в основе механизм долговременной потенциации.
Togashi et al. [87] показали, что экспрессия доминантно-негативной формы N-cadherin дает в результате более длинные filopodia-подобные шипы и снижает количество synaptic puncta (Рис. 3c). В культурах от мышей, лишенных αN-catenin, который является критическим для cadherins, чтобы связать их с актиновым цитоскелетом, шипы также были аномально удлинены, но в др. аспектах структура шипов и синаптических компонентов были не изменены.
В работе Murase et al. [88] изучали локализацию и функцию β-catenin в синапсах. Когда нейроны деполяризовали, то интенсивность окрашивания β-catenin увеличивалась внутри шипов и снижалась в соседних частях дендритного ствола. Этот сдвиг β-catenin зависел от его состояния фосфорилирования: мутаные формы, которые были не способны фосфорилироваться, концентрировались в шипах, тогда как мутанты, которые вели себя так, как будто были постоянно фосфорилированы, концентрировались в стволе. В нейронах, трансфицированных мутантом с блоком фосфорилирования, PSD95 кластеры были больше, также как и соседние кластеры синаптических пузырьков. Это исследование особенно интригует в свете более ранних результатов, показавших изменения локализации N-cadherin
и силы адгезии в ответ на активность [89,90].
Сходные исследования нейронов гиппокампа также выявили участие в формировании зрелых шипов heparan sulfate proteoglycan syndecan-2 [52,91,92]. Syndecan-2 локализуется в зрелых шипах, а трансфекция незрелых нейронов syndecan-2 ускоряет созревание шипов. Syndecan-2 является мишень для фосфорилирования с помощью EphB2 kinase и это фосфорилирование является критическим для локализации syndecan-2 и образования зрелых шипов в культуре. Т.о., один из механизмов, с помощью которого передача сигналов ephrin/Eph способствует дифференцировке синапсов, м. осуществляться за счёт syndecan-2-зависимого формирования шипов.
Conclusions
Over the past few years, several adhesion molecules have
been identified at CNS synapses. A rapidly accumulating
body of experimental evidence, obtained mainly through
studies of in vitro models, has suggested likely roles in
synapse formation and function for many of these molecules.
Emerging technologies — genomics, proteomics,
interaction screens, expression profiling, and so on—will
surely lead to many more, and to their binding partners,
scaffolding molecules and signaling cascades. The challenge
for the future will be to sift through all of these data
and to assess the actual functions of synaptic adhesion
molecules in vivo.
Update
Recent work has demonstrated that neurexins are concentrated
at synapses, that neuroligin-mediated b-neurexin
clustering induces pre-synaptic differentiation [93], and
that targeted deletion of all three α-neurexins in mice
impairs calcium channel function but does not prevent
synapse formation [94].
Сайт создан в системе
uCoz