Изучали сердца кур и мышей во время valvuloseptal ремоделирования и дифференцировки для выявления компартментализованной экспрессии ранних кардиальных регуляторных генов и молекул внеклеточного матрикса. Кроме того, определены времнной и пространственный контроль клеточной пролиферации и эндотелиальные источники клапанов и поддерживающего аппарата. Органиченная экспрессия в отдельных клеточных клонах и кардиальных структурах наблюдалась для
у эмбрионов кур и мышей, чтонаходится в контрасте с с их паттернами перекрывающейся экспрессии во время инициальных стадий детерминации и дифференцировки кардиальных клонов. Специфические компартменты зрелых клапанов, включая створки, chordae tenduneae и myotendinous соединения, были идентифицированы на базе ограниченной экспрессии молекул внеклеточного матрикса. Экспрессия некоторых маркёров хондрогенеза и и развития сухожилий, включая bHLH ген
, в зрелых клапанах м. указывать на общие регуляторные механизмы между этмим соединетельно тканными клонами и поддерживающими структурами клапанов. Локальные области клеточной пролиферации в зачатках клапанов у кур согласуются с механизмом дистальных выростов элонгации клапанов и демонстрируют, что дифференцировка клапанов сопровождается пониженной пролиферацией. Эндотелиальные источники зрелых створок клапанов и поддерживающих структур, включая клапанно-пергородчатое фиброзное соединение между митральными и трёстворчатыми клапанами, были продемонстрированы у Tie2-cre x ROSA26R мышей. Всё это указывает на регуляторные события , которые трансформируют эндокардиальные подушки в зрелые клапаны и поддерживающие структуры.
Анализ пространственно-временной экспрессии ранних карлиальных регуляторных генов во время клапанно-перегородчатого развития выявил ассоциацию с разными типами клеток в ртдельных компартментах сердца Экспрессия
Nkx2.5 в клонах атриальных и вентрикулярных миоцитов и в мышечной стенке трёхстворчатого клапана эмбрионов кур согласуется с его функцией в качестве транскрипционного регулятора экспрессии карлиальных мышечных генов (Bruneau, 2002). В противоположность
nkx2.5 gata4 экспрессируется в зачатках клапанов у кур и мышей и это м.б. индуктивной новой функцией в клетках немышечного типа во время клпанно-перегородчатого развития. Сходным образом мышиный
gata5 экспрессируется в эндокарде, где он регулирует дифференцировку эндокардиальных клеток и экспрессию гена
endothelin-1 в сочетании с NFATc1 (Nemer, Nemer, 2002). Колокализованная экспрессия куринных
tbx5 и
nkx2.5 в субпопуляции клеток, ассоциированных со специализированной проводящей системой, это согласуется с аномалиями проводящей системы, ассоциированных с мутациями генов
NKX2.5 и
TBX5 человека (Basson et al., 1997; Schott et al., 1998)/ Эта колокализация
tbx5 и
nkx2.5 не обнаруживается в сердце эмбрионов мыши, однако, мыши, гетерозиготные по мутациям
tbx5 обнаруживают аномалии проводящей системы (Bruneau et al., 2001). И у эмбрионов кур и мышей экспрессия
tbx20 превалирует в зачатках клапанов и зрелых клапанах, однако, его регуляторная функция во время клапанно-перегородчатого развития неизвестна. Т.к. Экспрессия всех этих транскрипционных факторов перекрывается во время раннего разития сердца, то кажется вполне вероятным, что их регуляторные функции дивергируют во время поздних событий спецификации камер сердца.
Имеются обширные доказательства важности передачи сигналов DVH во время клапанно-перегородчатого развития, но точные регуляторные функции и вовлекаемые типы клеток окончательно не определены (Delot, 2003). В некоторых исследованиях передача сигналов DVH была ассоциирована с пониженной пролиферацией, миграцией, дифференцировкой и апоптозом клеток эндокардиальных подушек во время созревания и ремоделирования клапанов (Nakajima et al., 2000; Abdelwahid et al., 2001; Jackson et al., 2003). У мышей мутации в DVH лигандах, рецепторах или сигнальных белках ведут к дефектам клапанов и перегородки в AV канале и тракте оттока (Galvin et al., 2000; Kim et al., 2001; Jiao et al., 2003; Delot et al., 2003). В отличие от кур, где
bmp2 экспрессируется в AV подушках, экспрессия
bmp2 у мышей, по-видимому, более ограничена трактом оттока. Однако, др. ВМР лиганды , включая ВМР4 экспрессируются в AV канале мышей и необходим для нормального AV клапанно-перегородчатого развития (Jiao et al., 2003). Дополнительные BMPs, включая ВМР5, -6, -7 также экспрессируются в AV valvuloseptal структурах мышей и кур и скорее всего регулруют аспекты клеточного роста, миграции, дифференцировки и гибели (Kim et al., 2001; Yamagishi et al., 2001). Роль ВМР2 в зачатках AV клапанов сложна, она м. включать индуктивные функции в специфических клонах клеток клапанов, также как и контроль морфогенетических событий.
Анализ экспрессии регуляторных генов и распределения молекул внеклеточного матрикса демонстрирует видо-специфические различия в типах клеток створок зрелых клапанов и поддерживающих структур у эмбрионов кур и мышей. У кур муральная часть створок трёхстворчатого клапана обладает уникальным мышечным составом и не поддерживается с помощью инсерций фиброзных поддерживающих структур в вентрикулярные папиллярные мышцы (Chin et al., 1992; Sedmera et al., 2000; данное исследование). Митральный клапан у птиц не является мышечным и состоит из определенного фенотипа внеклеточного матрикса в створках клапанов, chordae tenduneae и myotendinous соединения. У мышей наблюдаются сходные паттерны экспрессии коллагена типа I, коллагена типа II и tenascin в створках митрального и трёстворчатого клапанов и в поддерживающих структурах. Преимущественно мышечные трехстворчатые клапаны без вентрикулярной фиброзной поддержки у цыплят, по-видимому, являются уникальрными для птиц, т.к. фиброзные створки клапанов и поддерживающие структуры очевидны в AV клапанах эмбрионов Xenopus, рыбок данио, мышей и человека (Wessels et al., 1996; Sedmera et al., 2000). Дополнительным признаком AV клапанов человека является тесная аппозиция предшественников створок клапанов и chordae tenduneae смышечными поддерживающими структурами в зачатках клапанов (Oosthoek et al., 1998). Ассоциация производных подушек структур фиброзных клапанов со слоем дифференцированных мышечных клеток не обнаруживается в митральном клапане цыплят или в любом из AV клапанов мышей. Следовательно, вычленение фиброзных створок клапанов из пдлежащего миокарда м.б. уникальным свойством развития клапанов человека (Wessels et al., 1996; Oosthoek et al., 1998). Все эти гистологические анализы демонстрируют, что т.к. ранние события кардиогенеза сильно законсервированы у разных видов, тогда как поздние события созревания и ремоделирования клапанов оказываются специализированными среди позвоночных.
Молекулярные маркёры хондрогенеза и развивающихся сухожилий присутствуют в створках зрелых клапанов и поддерживающих структурах сердца как у Е14 цыплят, так и у новорожденных мыышей (Рис. 7).
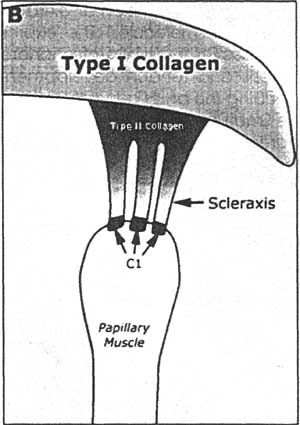 Fig. 7. Compartmentafizatlon of mature valve leaflets and supporting structures. B: The E14 avian mitral valve structures highlighted in the boxed area are shown schematically. The valve leaflets (yellow) predominantly express type I collagen. The valve leaflet is attached to the papillary muscles by means of chordae tendineae (blue). The chordae tendineae show further diversification between the junctions with the valve leaflet, marked by type II collagen (dark biue), and scleraxis in the region adjacent to the myatendinous junctions (light blue). The myatendinous junctions (red) with the papillary muscle are marked by Cl reactivity.
Fig. 7. Compartmentafizatlon of mature valve leaflets and supporting structures. B: The E14 avian mitral valve structures highlighted in the boxed area are shown schematically. The valve leaflets (yellow) predominantly express type I collagen. The valve leaflet is attached to the papillary muscles by means of chordae tendineae (blue). The chordae tendineae show further diversification between the junctions with the valve leaflet, marked by type II collagen (dark biue), and scleraxis in the region adjacent to the myatendinous junctions (light blue). The myatendinous junctions (red) with the papillary muscle are marked by Cl reactivity. Коллаген типа II является характерным для хряща и экспрессируется в chordae tenduneae, соседствующими со створкой клапанов (Chimal-Monroy et al., 2003).
Scleraxis, транскрипционный регулятор, важный для развития предшественников сухожилий в конечностях и сомитах, экспрессируется также в соединениях поддерживающего аппарата клапанов и папиллярных мышц митральных клапанов птиц (Schweitzer et al., 2001). Tenascin и антигены С1 и С5, которые присутствуют в хрящах и сухожилиях развивающихся конечностей и сомитов, экспрессируются также в поддерживающем аппарате клапанов и кариальных myotendinous соединениях (George-Weinstein et al., 1988; Edom-Vovard et al., 2002). В развивающихся конечностях и сомитах развитие сухожилий детерминируется с помощью передачи сигналов fibroblast growth factor и активности Scleraxis, регулирующей экспрессию tenascin (Edom-Vovard et al., 2002). Хондрогенез конечностей характеризуется индукцией с помощью ВМР Sox9, транскрипционного фактора, который активирует экспрессию гена
type II collagen (Ng et al., 1997; Chimal-Monroy et al., 2003). В развивающемся сердце птиц критические регуляторные компоненты как детерминации сухожильного клона, так и хондрогенеза пространственно и во времени регулируются в зачатках клапанов и в зрелых клапанах (данное исследование; Karabagli et al., 2002; Sugi et al., 2003). Однако, точная функция этих регуляторных путей в дифференцировке и формировании паттерна зрелых клапанов и поддерживающих структур ещё не установлена.
Происхождение структур зрелых клапанов из недифференцированных эндокардиальных подушек является спорным (Ву laCruz et al., 1983; Lamers et al., 1995; Wessels et al., 1996; Oosthoek et al., 1998). Использовали Tie2-Cre x ROSA26R генетический подход у мышей, позволяющий метить клетки, происходящие из эндотелиальных клонов. Ранее эта система была использована, чтобы показать, что мезенхима эндокардиальных подушек на Е12.5 целиком происходит из эндотелиальных предшественников (Kisanuki et al., 2001). У новорожденных мышей створки AV и OFT клапанов и поддерживающие chordae tenduneae AV клапанов преимущественно происходят из эндотелиальных клонов подушек. Кроме того, поразительное фиброзное соединение (continuity) между створками от перегородки трёхстворчатого и митрального клапанов через межжелудочковую перегородку также происходит из эндотелия подушек. Это valvuloseptal фиброзное соединение очевидно в сердце эмбрионов людей и скорее всего поддерживает септальные створки AV клапанов в течение всей жизни (oosthoek et al., 1998). У кур популяция клеток, происходящих из эпикарда, вносит существенный вклад в AV клапаны (Gittenberger-de Groot et al., 1998). Следовательно, неполное происхождение mural створок AV клапанов из эндотелиальных клеток в сердце
Tie2-cre x ROSA26R м.б. обусловлено вкладом эпикарда в митарльные и трёхстворчатые клапаны у мышей. В OFT экспрессия
Tie2-cre x ROSA26R является комплементрной той, что наблюдается для маркёра клона нерального гребня, wnt1-cre, это демонстрирует разное клеточное происхождение структур OFT septal и полуллунных клапанов (Jiang et al., 2000). Итак, огромное большинство клеток как в полулунных, так и AV клапанах мышей имеет эндотелиальное происхождение.
Аномальное образование и морфология клапанов являются признаком многих врожденных аномалий клпанов (Bartram et al., 2001). Нарушения функции сердечных клапанов часто обусловлены аномалиясми структуры створок клапанов или неэффективностью поддерживающего аппарата, включая chordae tenduneae и папиллярные мышцы. Имеется множество доказательств генетических причин ВПС, включая уродства клапанов, ассоциированные с DioGeorge синдромом, трисомией 18, трисомией 21 и мутациями генов транскрипционных факторов и молекул внеклеточного матрикса (Johnson et al., 1997; Pierpont et al., 2000; Bruneau , 2002; Hoffman, Kaplan, 2002).
Сайт создан в системе
uCoz
