BMPs в основном действуют посредством BMP receptor (BMPR) type I
и type II (BMPRI и BMPRII). Три типа I (ALK2, ALK3 или BMPRIA и ALK6 или BMPRIB) и три типа II receptors (BRII, ActRIIA and ActRIIB), как известно обеспечивают передачу сигнала (Nohe et al., 2004). В общем, типа I рецепторы являются рецепторами связывания с высоким сродством, в то время как типа II рецепторы связывают BMPs с низким сродством. Связывание BMP с BMPR приводит к фосфорилированию нижестоящих Smad белков и тем самым запускается внутриклеточный сигнальный каскад. BMP сигнал активирует Smad1,
Smad5 и Smad8, которые после фосфорилирования могут ассоциировать с Smad4 (common Smad) в гетеродимерный комплекс, который в дальнейшем транслоцируется в ядро, где он активирует транскрипцию
(Nohe et al., 2004). Smad6 и Smad7, с др. стороны, являются ингибирующими для передачи этих сигналов (Nohe et al., 2004). Помимо Smad пути, BMPs , как полагают, активирует несколько разных киназных путей, включая MAPK, PI3 kinase и PKC (Kishigami and Mishina, 2005).
BMP signalling in the development of the cranial neural
crest and facial primordia
Neural crest cells (NCCs) возникают униформно на дорсо-латеральном крае смыкающихся нервных складок вдоль почти всей длины нейральной оси у эмбрионов позвоночных, в регионе, соответствующем interface между не-нейральной эктодермой и нервной пластинкой. Они рассматриваются как подобные стволовым клеткам, и обнаруживают высокую пластичность (Trainor et al., 2003). После нейруляции, NCCs вычленяются и мигрируют вдоль определенных путей, чтобы дифференцироваться в разнообразные клетки и ткани. NCCs, которые возникают из передней части нервной трубки (forebrain, midbrain и anterior hindbrain), называются cranial neural crest cells (CNCCs), они проникают в лицевые зачатки и фарингеальные дуги и в конечном счете дифференцируются в типичные производные нервного гребня, такие как скелет, нейроны, краниальные ганглии и соединительные ткани.
Образование нервного гребня является сложным процессом, который нуждается в кооперации ряда критических сигнальных систем, включая BMP,
WNT и FGF пути. Передача сигналов BMP давно уже распознана как паттерн-формирующий сигнал для образования нервного гребня. Установлено, что Bmp4 и Bmp7 присутствуют в эктодерме и могут замещать не-нейральную эктодерму для индукции клеток нервного гребня (Liem et al., 1995). Bmp4 ответственен за поддержание разнообразных гено дорсальной части нервной трубки, таких как Msx1, Msx2 и Slug (Trainor et al., 2003, Tribulo et al., 2003), а градиент Bmp, по-видимому, существенен для спецификации нервной пластинки и нервного гребня (Tribulo et al., 2003). Помимо индуктивной роли передача сигналов Bmp необходима также для миграции CNCCs в примордии лица (Kanzler et al., 2000, Knecht and Bronner-Fraser,2002, Tribulo et al., 2003). Блокирование Bmp2/Bmp4 в краниальном нервном гребне мышей с помощью Xnoggin ведет к истощению CNCCs в затронутых областях; как следствие, бранхиальные дуги, обычно заполняемые с помощью NCCs, оказываются гипоморфными и их скелетные и нервные производные не развиваются (Kanzler et al., 2000).
Во время раннего черепно-лицевого развития Bmp4, Bmp2 и Bmp7 обнаруживают заметную экспрессию (Bennett et al., 1995, Francis-West et al., 1998, Francis-West et al., 1994). В ранних лицевых примордиях высокая экспрессия в эпителии Bmp4 и Bmp7 ассоциирует с мезенхимной экспрессией Bmp2, Msx1 и Msx2 (Barlow and Francis-West, 1997, Bennett et al., 1995, Francis-West et al., 1998). Позднее, Bmp4 экспрессируется также в мезенхиме лицевых зачатков (Barlow and Francis-West, 1997). Эктопическое применение рекомбинантных BMP2 или BMP4 также активирует экспрессию генов Msx в местах, где обычно экспрессия Msx не наблюдается (Barlow and Francis-West, 1997). Этот сигнальный каскад коррелирует с измененной экспрессией Fgf4 и Shh и также ведет к аномальному развитию лицевых примордиев (Barlow and Francis-West, 1997).
К сожалению, обычный нокаутный подход к Bmps не дает достаточно информации о роли Bmps в черепно-лицевом развитии или из-за ранней гибели эмбрионов или функционального перекрывания среди этого семейства. Напр., , делеции Bmp2 или Bmp4, прототипов гомологов (decapentaplegic) дрозофилы, ведут к ранней эмбриональной гибели во время гаструляции у мышей (Winnier et al., 1995, Zhang and Bradley, 1996), это препятствует попыткам проанализировать их функции в более позднее время; делеции др. членов, однако, не обнаруживают существенных дефектов в черепно-лицевых структурах у мышей. Инактивация Bmprs также ведет к ранней летальности до черепно-лицевого развития (Beppu et al., 2000, Mishina et al., 1999, Mishina et al., 1995). Условные нокаутные и двойные нокаутные подходы более пригодны. Мыши, дефицитные по Alk2 в нервном гребне (Alk2 nc-/-), или по Bmpr1a из лицевых примордиев (Bmpr Iafp-/-) обнаруживают удивительные онтогенетические аномалии лицевых структур, указывающие на существенную роль передечи сигналов Bmp в разнообразных онтогенетических процессах (Dudas et al., 2004, Liu et al., 2005). Bmp5/Bmp7 двойные мутанты обнаруживают недоразвитие бранхиальных дуг (Solloway and Robertson, 1999). Профили экспрессии некоторых из Bmps и нокаутные фенотипы приведены в Tables 1 и 2.
Нокаут
Bmp7, др. члена Bmp, экспрессирующегося в раннем лицевом эпителии, не дает видимых дефектов в лицевых структурах, за исключением глаз (Dudley et al., 1995, Luo et al., 1995, Solloway and Robertson, 1999), тогда как двойные нокаутные
Bmp5/Bmp7 мыши обнаруживают раннюю гибель эмбрионов и недостаточность развития лицевых примордиев, указывая тем самым на функциональное перекрывание среди подгруппы 60A семейства
Bmp генов. Функциональное перекрывание является скорее всего эволюционной стратегией для некоторых критических генов.
BMP signalling in craniofacial skeletogenesis
Сигнал BMP является критическим для скелетогенеза во всем теле, регулируя хондрогенез и остеогенез на многих стадиях. Молекулярный механизм действия BMPs в этих процессах активно исследовался. Передача сигналов BMP участвует в детерминации, миграции, конденсации, пролиферации, дифференцировке и апоптозе скелетных клеток. В этих процессах пути передачи сигналов Bmp взаимодействуют с путями передачи сигналов Fgf, Hedgehog и Wnt и регулируют экспрессию нескольких критических транскрипционных факторов, таких как Sox9, Cbfa1 и Msx (Karsenty, 1999, Karsenty, 2003, Minina et al., 2002, Minina et al., 2001, Naski et al., 1998). В Bmp семействе генов, Bmp2, -4, -7, -3, -5 и Gdf5 являются критическими в скелетогенезе. Огромное большинство исследований скелетогенеза было проведено с использованием модельной системы аппендикулярных костей. Ряд обзоров посвящен роли Bmps в скелетогенезе (Chen et al., 2004, Karsenty, 1999, Karsenty, 2003, Yoon and Lyons, 2004). Однако, черепно-лицевой скелетогенез не идентичен таковому для аппендикулярных костей (Eames and Helms, 2004, Helms and Schneider,
2003).
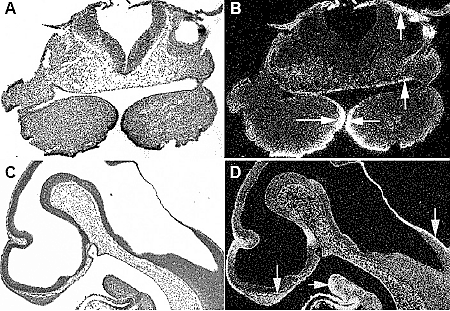 Fig. 1. Bmp4 expression in the developing mouse head at embryo day 10 (E10) localized by radioactive in situ hybridization. At E10, Bmp4 is intensely expressed in the epithelia of the first branchial arches, stomodeum and ectoderm of cranial neural crest (arrows). (A,C) bright
field section; (B,D) dark field section.
Fig. 1. Bmp4 expression in the developing mouse head at embryo day 10 (E10) localized by radioactive in situ hybridization. At E10, Bmp4 is intensely expressed in the epithelia of the first branchial arches, stomodeum and ectoderm of cranial neural crest (arrows). (A,C) bright
field section; (B,D) dark field section.
Кости в черепно-лицевой области в основном происходят из CNCCs
и формируются посредством трансмембранозной оссификации, при котором мезенхимные клетки непосредственно конденсируются и дифференцируются в остеобласты без какой-либо хрящевой модели. Единственное исключение basicranium, который формируется посредством эндохондральной оссификации, в этом процессе формирование кости управляется с помощью хрящевой матрицы, сходной с той, что в аппендикулярных костях. Базикраниум позвоночных возникает из родоначального основания для головного мозга с эволюционно новыми элементами, происходящими из CNCCs в своей передней части (Nie, 2005b). Во время развития свода черепа, открытые фиброзные структуры среди внутримембранозных костей сформировались как центры роста. В эндохондральном базикраниуме центры хрящевого роста, которые морфологически и функционально сходны с ростовыми пластинками, называются synchondroses, они возникли для выполнения этой функции. Лицевые кости соединяются с помощью относительно узких фиброзных структур, за исключением нижней челюсти, которая относительно независимая и подвижная часть скелета черепно-лицевой области. В нижней челюсти вторичные хрящевые структуры, mandible condyles, развиваются как ростовые центры для задней части нижней челюсти. Хотя condyle хрящ и вносит вклад в базальную часть растущей нижней челюсти посредством образования эндохондральной кости, так как это делает ростовая пластинка, он обладает также уникальными свойствами в развитии и регуляции. Condyle хрящ отличается от первичного хряща эмбрионального происхождения, гистологической организацией, способом и регуляцией роста (Delatte et al., 2004, Shibata et al., 1996).
Передача сигналов BMP законсервирована в черепно-лицевом скелете, регулируя как эндохондральное, так и внутримембранозное формирование кости (Fig. 2). Она является критической для формирования клеток скелетогенных предшественников в нервном гребне, а их миграция предопределяется предназначением (Kanzler et al., 2000). Bmps экспрессируются на высоком уровне в мигрирующих CNCCs и позднее на ранних стадиях хрящей и костей. Избыточная экспрессия Bmp или применение белков Bmp изменяют процессы формирования паттерна скелета, приводя к изменениям размеров и морфологии скелета как лица, так и конечностей (Barlow and Francis-West, 1997, Duprez et al., 1996a). Более того, нехватка передачи сигналов Bmp у мышей в краниальном нервном гребне дает множественные дефекты в черепно-лицевом скелете (Dudas et al., 2004).
После раннего развития, Bmps сохраняют свою экспрессию в скелете и центрах скелетного роста и играют важную роль в регуляции активности ростовых центров. Краниальные структуры являются критическими местами роста для свода черепа. Преждевременное слияние этих структур ведет к патологическим условиям, извест ным как craniosynostosis. Сигнал Bmp является важным игроком в регуляции морфогенеза и функции швов (Holleville et al., 2003, Kim et al., 1998). Bmp2 и Bmp4 присутствуют на остеогенных фронтах краниальных швов (Kim et al., 1998). Воздействие Bmp4 белка увеличивает объем ткани в швах и индуцирует экспрессию генов Msx (Kim et al., 1998), которые также ассоциируют с краниосиностозами в мутантных условиях. В швах птиц передача сигналов Bmp индуцирует и позитивно регулирует экспрессию гомеобоксного гена Dlx5 (Holleville et al., 2003), критического фактора для развития черепно-лицевого скелета (Acampora et al., 1999, Depew et al., 1999). Gdf6 является др. важным сигналом, участвующим в регуляции швов. Он обнаруживается в коронарном шве, в то время как др. члены этой подгруппы,
Gdf5 и Gdf7, не выявляются (Settle et al., 2003). У Gdf6 мутантных мышей коронарный шов свода черепа, обычно соединяющий лобную и теменные кости, соотв. отсутствует (Settle et al., 2003). Эта роль Gdf6 позволяет предположить, что он является кандидатом на роль гена craniosynostosis. Bmpr1b является важным для скелетогенеза. В черепно-лицевой области он представлен на высоком уровне как в развивающихся, так и взрослых скелетных элементах. Трансгенная экспрессия укороченного Bmpr1b в остеобластах мышей с использованием промотора type I коллагена, ведет к задержке оссификации в своде черепа (Zhao et al., 2002).
Во время развития basicranium, Bmp2-6 обнаруживают пространственно временную экспрессию, которая в основном подтверждает то, что и у др. эндохондральных костей (Nie et al., unpublished data). Эффект передачи сигналов Bmp на synchondrosis в основании черепа специфически анализировался с использованием систем безсывороточных органных культур (Shum et
al., 2003). Bmp белок стимулирует рост хряща, отложение матрикса и пролиферацию хондроцитов дозово-зависимым способом. Регуляция synchondrosis с помощью передачи сигналов Bmp, по-видимому,
TABLE 2
SOME ADDITIONAL MEMBERS OF THE BMP FAMILY:
EXPRESSION PROFILES AND RELATED DISORDERS
Expression profile
Bmp9 (Gdf2) Central nervous system, Liver (Lopez-Coviella et al., 2000, Miller et al., 2000)
Bmp10 High in heart, lower in lung and liver (Neuhaus et al., 1999)
Bmp15 Ovary (Dube et al., 1998)
Related disorder: Ovary dygenesis 2 (OMIM, 300510)
Gdf9 Ovary (Dube et al., 1998, Teixeira Filho et al., 2002)
Related disorder: Polycystic ovary syndrome (Teixeira Filho et al., 2002)
Gdf 3 Embryonal carcinoam cell line (Caricasole et al., 1998)
Nodal Early embryo, involved in establishing proximal-distal polarity (Kishigami and Mishina, 2005)
lefty Notochord, presumptive floor plate, involved in left-right patterning (Kishigami and Mishina, 2005)
очень сходна или идентична таковой для морфологического аналога - ростовой пластинки.
Передача сигналов BMP важна также для развития нижней челюсти. Инактивация Alk2 в нервном гребне мышей дает удивительно гипотрофичную нижнюю челюсть (Dudas et al., 2004). У таких мышей передний хрящ, происходящий из дистального окончания Meckelґs хряща, отсутствует; в последствии mental symphysis, критическое место роста для передней части нижней челюсти, не формируется, давая постоянно раздельные кости нижней челюсти (Dudas et al., 2004). В согласии с этим одновременное устранение двух Alk2 лигандов, Bmp5 и Bmp7, ведет к дефектам в пролиферации и поддержке клеток бранхиальных дуг (Solloway and Robertson, 1999). Bmp/Msx сигнальная петля является критической для образования альвеолярной кости нижней челюсти. У Msx1-/- мышей развитие зубов арестовано на ст. зачатков и ассоциированное с этим отсутствие periodontal кости - альвеолярных отростков. С др. стороны, эктопическая экспрессия Bmp4, управляемая с помощью Msx1 промотора мыши в Msx1-/- дентальной мезенхиме, не только частично восстанавливает развитие зубов, но и также восстанавливает образование альвеолярной кости (Zhao et al., 2000). Позднее было продемонстрировано, что Bmp4 обеспечивает функцию Msx1 по контролю за развитием альвеолярной кости путем регуляции экспрессии Dlx5 и Cbfa1 (Zhang et al., 2003).
Механизм развития temporomandibular joints (TMJ) изучен плохо. Bmp2 и Bmp4 выполняют роль по детерминации места образования TMJ путем репрессии Bapx1 (Wilson and Tucker, 2004). Подгруппа Gdf5, -6 и -7 необходима для образования синовиального соединения (Settle et al., 2003, Storm and Kingsley, 1996), но их роли в развитии TMJ ещё предстоит определить. Как передача сигналов Bmp регулирует развитие вторичного хряща нижней челюсти, condyles, также предстоит ещё проанализировать.
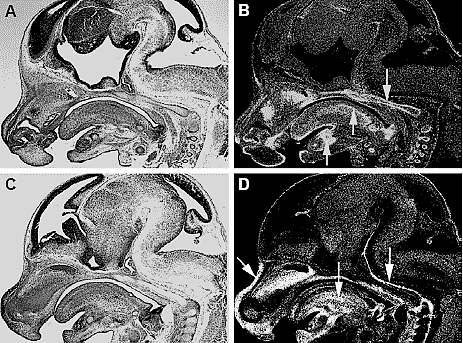 Fig. 2. Expression of Bmp2 and Bmp4 in the developing mouse head at E13. Bmp2 is seen in the chondrocranium, myogenic mesenchyme of the tongue and nasal and mandibular cartilages (A,B). Bmp4 is widespread in the perichondria of the chondrocranium, nasal cartilage,tongue and
mesenchyme of the facial prominences (C,D). Arrows indicate expression domains.
Fig. 2. Expression of Bmp2 and Bmp4 in the developing mouse head at E13. Bmp2 is seen in the chondrocranium, myogenic mesenchyme of the tongue and nasal and mandibular cartilages (A,B). Bmp4 is widespread in the perichondria of the chondrocranium, nasal cartilage,tongue and
mesenchyme of the facial prominences (C,D). Arrows indicate expression domains.
Семейство BMP также является гетерогенной группой в отношении функций. BMP3 и BMP3b (GDF10) вместе составляют уникальную подгруппу этого семейства. Роль BMP3 в скелетогенезе противоречива из-за противоречивых результатов (Bahamonde and Lyons, 2001, Han et al., 2002). Сегодня имеются более строгие доказательства в пользу ингибирующей роли в отношении образования кости. Bmp3 нокаутные мыши имеют повышенную плотность кости, которая вдвое таковую у трабекулярных костей дикого типа (Bahamonde and Lyons, 2001, Daluiski et al., 2001). Bmp3 противодействует Bmp2-индуцированной остеогенной дифференцировке in vitro независимого от рецептора пути (Bahamonde and Lyons, 2001). Bmp3b обладает сходной антагонистической активностью в отношении Bmp2, но регулируется по другому (Daluiski et al., 2001).
Индуктивная и регуляторная роли передачи сигналов BMP в скелетогенезе предоставляют важный подход к регенерации и engineering скелетной ткани. Использование BMP белков, BMP-индуцированных или BMP-экспрессирующих стволовых клеток, или перенос генов BMP могут значительно облегчать регенеративный процесс кости и хряща (Chang et al., 2004, Lieberman et al.,
1999, Lieberman et al., 1998, Suzuki et al., 2002). Скелетная ткань может быть также продуцирована
in vitro путем комбинации стволовых клеток с подходящим матриксом и индуктивными молекулами, такими как Bmps. Прорыв в этой области безусловно создаст мощную основу для репарации черепно-лицевого скелета.
BMP signalling in palatogenesis
Развитие нёба является сложным процессом. Объединение первичного нёба из frontonasal отростков и парных латеральных maxillary нёбных пластинок, которые формируют вторичное нёбо, и образуют нёбо у млекопитающих. Образование вторичного нёба млекопитающих является многоступенчатым процессом, который включает пролиферацию мезенхимных клеток, рост нёбных пластинок, их подъем, слияние и , наконец, исчезновение эпителиального шва по срединной линии. Нарушение любого события может приводить к расщеплению нёба. Наиболее распространенный механизм возникновения расщепления это недостаточность мезенхимной пролиферации или неспособность к слиянию эпителия. Расщепление нёба с или без расщепления губ происходит или как изолированный случай или одновременно с синдромами у человека. Синдромные и изолированные расщепления нёба имеют разные механизмы, оба имеют высокую генетическую обусловленность.
Сигналы Bmp важны для палатогенеза.
Bmp2, Bmp3, Bmp4 и Bmp5 экспрессируются в нёбе мышей как в эпителии, так и мезенхиме до, во время и после слияния небных половин (Lu et al., 2000, Nie, 2005c, Zhang et al., 2002). Экспрессия высоко динамична во время палатогенеза и по-разному регулируется вдоль передне-задней оси (Nie, 2005c). Важность передачи сигналов Bmp в палатогенезе подтверждается мышиными моделями расщепления нёба. У таких мышей расщепление нёба, индуцируемое с помощью ретиноевой кислоты, ассоциирует с пониженной экспрессией
Bmp2, -4 и -5 (Lu et al., 2000). Более убедительные доказательства предоставлены
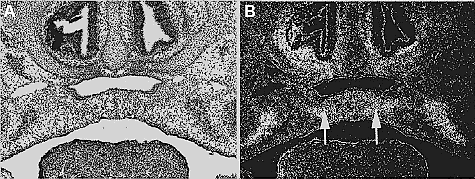 Fig. 3. Expression of Bmp2 in palatogenesis. Bmp2 is highly expressed in the palatal mesenchyme adjacent to the midline during palatal fusion (arrows). (A) Bright field section; (B) Dark field image.
Fig. 3. Expression of Bmp2 in palatogenesis. Bmp2 is highly expressed in the palatal mesenchyme adjacent to the midline during palatal fusion (arrows). (A) Bright field section; (B) Dark field image.
исследованиями модельных трансгенных мышей с инактивацией
Alk2 или BmprIa специфически в нервном гребне или лицевых примордиях, в обоих случаях обнаруживаются оро-фациальные расщепления (Dudas et al., 2004, Liu et al., 2005). Это также указывает на то, что передача сигналов Bmp обеспечивается посредством Alk2 и BmprIa, играющих не перекрывающиеся роли в палатогенезе.
В то время как инактивация BmprIa в лицевых примордиях ведет к расщеплению нёба, удаление BmprIa далее из эпителия не приводит к очевидным нарушениям палатогенеза у мышей (Andl et al.,2004). Вторичное нёбо у BmprIafp-/- мышей ассоциирует с уменьшенной пролиферацией и повышенным апоптозом и половинки нёба мутантов сохраняют компетентность к слиянию, если они помещаются вместе в культуре, указывая тем самым, что расщепление у дефицитных по BmprIa мышей обусловлено отсутствием мезенхимной пролиферации скорее, чем неспособностью эпителия к слиянию (Liu et al., 2005). В согласии с этим высокая экспрессия Bmp2 наблюдаемая в мезенхиме. соседствующей со срединной линией во время слияния нёба (Fig. 3),
в то время как эпителиальные сигналы, обеспечиваемые Bmp4 и Bmp7, или несущественны или функционально перекрываются с теми, что затрагиваются у стандартных нокаутных моделей (Dudley et al., 1995, Liu et al., 2005, Nie, 2005c). Др. члены семейства Bmp, по-видимому, несущественны для палатогенеза, как показывают функциональные исследования (Tables 1 и 2). Следовательно, логично предположить, что Bmp2-обусловленная мезен7химная пролиферация является ключевым событием в палатогенезе. Bmp сигналы, как предполагается, находятся внутри индуцируемого Msx1 сигналного пути при палатогенезе. Делеция Msx1 ведет к полному расщеплению во вторичное нёбе у мышей (Satokata and Maas, 1994), в то время как трансгенная экспрессия Bmp сигнала, управляемая с помощью промотора Msx1, устраняет расщепления (Zhang et al., 2002), указывая тем самым, что Bmp сигнал является нижестоящим по отношению к Msx1 в палатогенезе. Недавно, Bmp11 (Gdf11) обнаружил роль в палатогенезе с помощью трансгенного подхода (McPherron et al., 1999). К сожалению, не приводится детальный фенотипический анализ. Относительно слияния эпителия, Tgf-β3, как было установлено, является кардинальным фактором (Gato et al., 2002).
Эти данные также показывают различную потребность в передаче сигналов Bmp при формировании нёба и губ и следовательно, потенциально различные механизмы лежат в основе эти х процессов. Напр., Bmp4 является критическим для процесса слияния развивающихся губ, тогда как в палатогенезе передача сигналов Bmp участвует в пролиферации мезенхимы (Liu et al., 2005). Развитие и слияние нёба также относительно позднее событие в эмбриогенезе и на него критически влияет развитие родственных структур. Все эти аспекты делают палатогенез очень хрупким процессом, который легко повреждается генетическими и средовыми факторами.
BMP signalling in craniofacial skeletal muscle development
Сигналы Bmp не существенны для ранней инициации миогенеза. Напротив, репрессия Bmp сигнала необходима для раннего развития черепно-лицевых мышц (Tzahor et al., 2003). Во время мышечной регенерации Bmp сигналы также отсутствуют (Zhao and Hoffman, 2004). Ингибирующая роль в миогенезе приписывается передаче сигналов Bmp во многих исследованиях (Duprez et al.,
1996b, Huang et al., 2001, Inada et al., 1996, Musgrave et al.,
2001, Tzahor et al., 2003). Отметим, что myostatin (Gdf8) был идентифицирован как ключевой регулятор в развитии и росте скелетных мышц (McPherron et al., 1997). Gdf8 специфически экспрессируется в развивающихся и взрослых скелетных мышцах. Gdf8 нулевые мутантные мыши являются существенно более крупными, чем мыши дикого типа и обнаруживают драматическое и распространенное увеличение массы скелетных мышц (McPherron et al., 1997). Важно. что гетерозиготные мыши также затрагиваются, хотя и в меньшей степени, указывая тем самым, что myostatin является дозово зависимым (McPherron et al., 1997).
Черепно-лицевые мышцы в большинстве происходят из мезодермы и формируются внутри окружающей среды из производных нервного гребня элементов (Noden, 1983, Noden, 1988). Их развитие характеризуется ранней экспрессией myogenic regulatory factors (MRFs) и поэтому ранним созреванием. Передача сигналов Bmp происходит во время развития черепно-лицевых мышц. Язык является прекрасной моделью для изучения черепно-лицевого миогенеза. Многие Bmps были локализованы в мышцах развивающегося языка (Bennett et al., 1995, Huang et al., 2001, Nie, 2005a). Воздействие Noggin, антагонистов Bmps, на язык птиц приводит к утолщению языка (Huang et al., 2001), что согласуется с негативной ролью передачи сигналов Bmp в развитии мышц в целом. У myostatin-дефицитных мышей височная масса становится значительно большей (Byron et al., 2004). Следовательно, передача сигналов Bmp играет роль в контроле пространства миогенной пролиферации и дифференцировки черепно-лицевых мышц. Мутация
BMP4 ассоциирует с fibrodysplasia ossificans progressiva (FOP, OMIM no.135100), характеризующейся прогрессивной постнатальной гетеротопической оссификацией мышц. Fibroproliferative повреждения возникают в результате эндохондральной оссификации в зрелую ламинарную кость с элементами костного мозга. Трансгенные мыши, избыточно экспрессирующие Bmp4 дают сходный фенотип, подобный FOP (Kan et al., 2004). У детей с обширной мышечной гипертрофией, выявлена мутация потери функции в гене
myostatin
(Schuelke et al., 2004), указывающая что инактивация myostatin оказывает сходные эффекты на мышей и людей.
BMP signalling in tooth development
Морфогенез зубов начинается с утолщения stomodeal эпителия. Эта зубная ламина дает эпителиальные зачатки для дальнейшего развития. После этого ранние зубные зачатки взаимодействуют с подлежащей мезенхимой и подвергаются существенным морфологическим изменениям известным как стадия бокала и стадия колокола. Сигналы Bmp также являются фундаментальным регулятором развития зубов, на что указывает арест развития зубов у Bmpr1a дефицитных мышей
(Andl et al., 2004, Liu et al., 2005). На ст. инициации ранних зубов, Bmp4, Bmp2 и Bmp7, экспрессируются в зубном эпителии и играют важную роль в эпителиально-мезенхимных взаимодействиях в индукции формирования зубов (Aberg et al., 1997, Vainio et al., 1993). Во время ст. перехода от зачатка к шапочке, Bmp4 индуцирует экспрессию Msx1 и Msx2 в мезенхиме. Последняя передает сигналы далее, индуцируя экспрессию Bmp4 в мезенхиме. Эктопическая экспрессия Bmp4, управляемая с помощью промотора Msx1 мыши, частично восстанавливает развитие зубов у Msx1-дефицитных мышей (Zhao et al., 2000).
Следовательно, Bmp/Msx сигнальная петля обеспечивает реципрокные взаимодействия между эпителием и мезенхимой во время инициации зубов и морфогенеза коронок.
В развивающихся зачатках зубов у мышей Bmp4 регулирует экспрессию др. критических паттерн-формирующих генов, таких как
Shh (Zhang et
al., 2000). Ингибирование активности Bmp4 с помощью Noggin приводит к репрессии
Shh и Bmp2 в эпителии зубов дикого типа (Zhang et al., 2000), тогда как эктопическая экспрессия человеческого
BMP4 в зубной мезенхиме, управляемая мышиным промотором
Msx1, восстанавливает экспрессию
Shh у мутантов
Msx1 в зубном эпителии (Zhang et
al., 2000, Zhao et al., 2000). В последующем развитии,
Bmp4 экспрессируется preodontoblasts и его экспрессия резко подавляется после их дифференцировки, в то время как экспрессия
Bmp2 активируется во время терминальной дифференцировки одонтобластов (Nakashima, 1994, Nakashima and Reddi, 2003, Yamashiro et al., 2003). Эти данные подтверждают, что сигналы Bmp являются индуктивными для дифференцировки одонтобластов. На Рис. 4 показана экспрессия мРНК
Bmp2 в развивающихся резцах мышей. Помимо этого Bmp3 был локализован в cementoblasts и зубных фолликулах
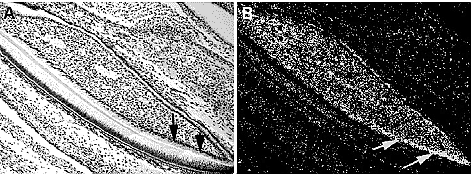 Fig. 4. Bmp2 expression in the mouse incisor in the lower jaw at newborn stage. Intense expression is seen in odontoblasts near the tooth root. Arrows indicate expression domains. (A)
Bright field image; (B) dark field image.
Fig. 4. Bmp2 expression in the mouse incisor in the lower jaw at newborn stage. Intense expression is seen in odontoblasts near the tooth root. Arrows indicate expression domains. (A)
Bright field image; (B) dark field image.
(Yamashiro et al., 2003);
Bm6, Bmp8 и Gdf7 были идентифицированы в зубной пульпе (Nakashima et al., 1998);
Gdf11 наблюдался в терминально дифференцированных одонтобластах (Nakashima et al., 1999); тогда как Gdf5, -6 и -7 были обнаружены в periodontium (Sena et al., 2003).
Роль по индукции дифференцировки одонтобластов предоставляет потенциал воздействия на engineering и регенерацию зубных тканей. Недавно стволовые клетки зубной пульпы были индуцированы в одонтобласты в культуральной системе с помощью Bmp2, как показал маркерный ген подобного дентину sialophosphoproteinn (Iohara et al., 2004). Базируясь на экспериментах
in vitro, Bmp-обработанные культуральные комочки стволовых клеток пульпы, трансплантированные в ампутированную пульпу, заметно стимулировали образование дентина (Iohara et al., 2004). Эти успехи создают потенциал для клинического использования стволовых клеток для регенерации зубных тканей или даже для замещения отсутствующих зубов за счет конструкции зачатков зубов.
BMP signalling involved in apoptosis in craniofacial
development
Передача сигналов Bmp участвует в апоптозе развивающихся конечностей (Macias et al., 1997, Omi et al., 2000, Yokouchi et al., 1996). Msx2, как было продемонстрировано, является медиатором Bmp-индуцированного апоптоза в системе in vitro (Marazzi et al., 1997). В развивающейся голове передача сигналов Bmp ассоциирована также с апоптозом во время развития краниального нервного гребня, лицевых примордиев и глаз (Barlow and Francis-West, 1997, Graham et al., 1994, Guha et al., 2002). В краниальном гребне кур Bmp4 индуцирует апоптоз в ромбомерах (r) 3 и r5 путем активации экспрессии Msx2 (Graham et al., 1994). Добавление рекомбинантного
BMP4 белка к культуре эксплантов r3 или r5, которые продуцируют нервный гребень, если изолированы от своих соседних ромбомеров, усиливает экспрессию Msx2 и возобновляет апоптоз в популяции нервного гребня (Graham et al., 1994). Более того, избыточная экспрессия Msx2 внутри цефалической части нервной трубки также увеличивает апоптоз (Takahashi et al., 1998). Апоптоз в нервной гребне считается механизмом элиминации тех клеток, которые не нужны для дифференцировки, и в результате формируются дискретные миграторные потоки нервных клеток у эмбрионов кур.
В противоположность курам мыши не обнаруживают специфичной для ромбомеров клеточной гибели. Хотя соответствующая и воспроизводимая гибель клеток наблюдается в заднем мозге, не выявляется специфического паттерна, который мог бы быть приписан или четным или нечетным ромбомерам (Kulesa et
al., 2004). Мышиный Bmp4 не экспрессируется в r3 и r5 и действительно отсутствует в дорсальной части нервной трубки (Kulesa et al., 2004). Более того, Msx2 экспрессируется униформно на дорсальном крае нервной трубки вдоль всей передне-задней оси во время периода формирования и миграции клеток нервного гребня, отличаясь существенно от паттернов экспрессии куриных гомологов (Kulesa et al., 2004). Следовательно, Bmp4/Msx2 обеспечиваемый апоптоз в клетках нервного гребня нечетных ромбомеров, не отвечает за формирование паттерна путей миграции клеток нервного гребня у мышей. Это верно и для рыбок данио и Xenopus. Эти данные подтверждают, что апоптоз в r3 и r5 эмбрионов кур является эволюционно закрепленным видо0специфическим свойством.
Передача сигналов Bmp ассоциирует также с апоптозом в раннем лицевом развитии. Экспрессия
Bmp2 и Bmp4 перекрывается с доменами клеточной гибели в фронтоназальных массах и регионах соединения примордиев (Barlow and Francis-West, 1997). Более того, экзогенный белок Bmp индуцирует клеточную гибель в лицевых примордиях (Barlow and Francis-West, 1997). Кстати, у
Bmp5/Bmp7 двойных мутантных мышей паттерн апоптоза в бранхиальных дугах и дорсальной срединной линии изменен (Solloway and Robertson, 1999). Итак, эти результаты подтверждают апоптическую роль передачи сигналов Bmp в некоторых процессах черепно-лицевого развития.
Concluding remarks
In summary, functions of BMP signaling have been under
revealing in a variety of craniofacial structures. The BMP signal is
conserved in many developmental processes, but mediates distinct
functions in different tissues and stages. Its specific roles and
mechanisms in the development of craniofacial elements clearly
need further elucidation. Crosstalk between the BMP and other
signalling pathways remains to be clarified. Particularly the downstream
factors of the BMP signal are not completely identified in
many processes. These factors are usually site-specific. Therefore,
unraveling the BMP signalling pathway within the genetic
cascade of a certain developmental process is important for
understanding of the overall mechanism. The developmental
roles of BMPs also provide an important approach in tissue
engineer and regeneration. Therefore, the BMP signalling pathway
will undoubtedly continue to attract attention in future studies.
Summary
The BMP signalling pathway is conserved throughout evolution
and essential for mammalian embryonic and postnatal development
and growth. In the vertebrate head, this signal is involved
in the development of a variety of structures and shows divergent
roles. During early head development, BMP signalling participates
in the induction, formation, determination and migration of
the cranial neural crest cells, which give rise to most of the
craniofacial structures. Subsequently, it is also important for
patterning and formation of facial primordia. During craniofacial
skeletogenesis, BMP signalling is an early inductive signal required
for committed cell migration, condensation, proliferation
and differentiation. Thereafter, BMP signalling maintains regulatory
roles in skeletons and skeletal growth centres. For myogenesis,
BMP signalling is a negative regulator. Importantly, myostatin has
been identified as a key mediator in this process. During
palatogenesis, the crucial role of BMP signalling is demonstrated
by mouse models with Alk2 or Alk3 (BMP type I receptors)
deletion from the neural crest or craniofacial region, in which cleft
palate is one of the major anomalies. BMP signalling is also an
important participant for tooth development, regulating early tooth
morphogenesis and subsequent odontoblast differentiation. In
this review these aspects are discussed in detail with a focus on
recent advances.
Сайт создан в системе
uCoz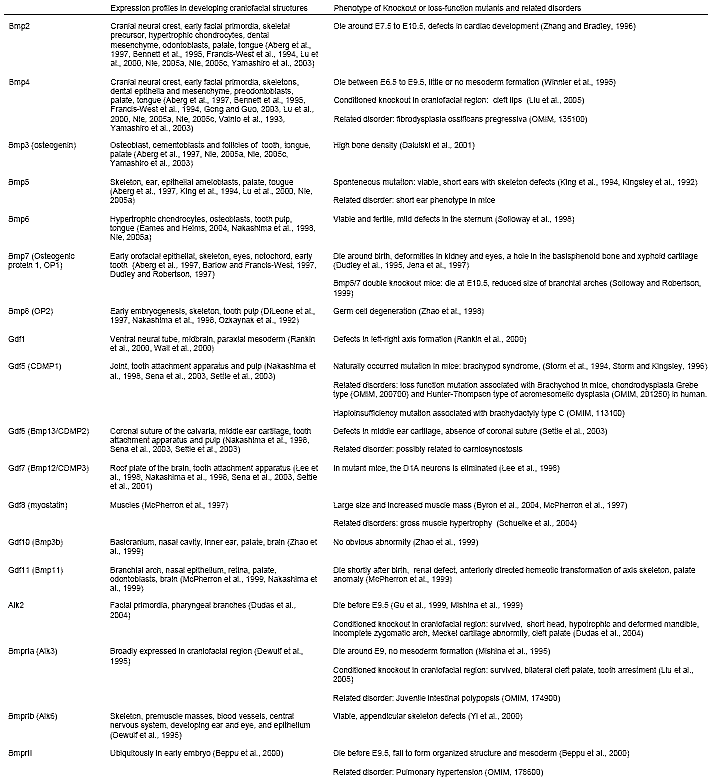
 Fig. 1. Bmp4 expression in the developing mouse head at embryo day 10 (E10) localized by radioactive in situ hybridization. At E10, Bmp4 is intensely expressed in the epithelia of the first branchial arches, stomodeum and ectoderm of cranial neural crest (arrows). (A,C) bright
field section; (B,D) dark field section.
Fig. 1. Bmp4 expression in the developing mouse head at embryo day 10 (E10) localized by radioactive in situ hybridization. At E10, Bmp4 is intensely expressed in the epithelia of the first branchial arches, stomodeum and ectoderm of cranial neural crest (arrows). (A,C) bright
field section; (B,D) dark field section.  Fig. 2. Expression of Bmp2 and Bmp4 in the developing mouse head at E13. Bmp2 is seen in the chondrocranium, myogenic mesenchyme of the tongue and nasal and mandibular cartilages (A,B). Bmp4 is widespread in the perichondria of the chondrocranium, nasal cartilage,tongue and
mesenchyme of the facial prominences (C,D). Arrows indicate expression domains.
Fig. 2. Expression of Bmp2 and Bmp4 in the developing mouse head at E13. Bmp2 is seen in the chondrocranium, myogenic mesenchyme of the tongue and nasal and mandibular cartilages (A,B). Bmp4 is widespread in the perichondria of the chondrocranium, nasal cartilage,tongue and
mesenchyme of the facial prominences (C,D). Arrows indicate expression domains.  Fig. 3. Expression of Bmp2 in palatogenesis. Bmp2 is highly expressed in the palatal mesenchyme adjacent to the midline during palatal fusion (arrows). (A) Bright field section; (B) Dark field image.
Fig. 3. Expression of Bmp2 in palatogenesis. Bmp2 is highly expressed in the palatal mesenchyme adjacent to the midline during palatal fusion (arrows). (A) Bright field section; (B) Dark field image.  Fig. 4. Bmp2 expression in the mouse incisor in the lower jaw at newborn stage. Intense expression is seen in odontoblasts near the tooth root. Arrows indicate expression domains. (A)
Bright field image; (B) dark field image.
Fig. 4. Bmp2 expression in the mouse incisor in the lower jaw at newborn stage. Intense expression is seen in odontoblasts near the tooth root. Arrows indicate expression domains. (A)
Bright field image; (B) dark field image.