Наши исследования показали, что значительная степень пластичности EC наблюдается во время артериально-венозной дифференцировки. В первой серии экспериментов мы выделяли артериальные или венозные фрагменты их эмбрионов перепела на разных стадиях развития вместе с их сосудистой стенкой. Эти фрагменты трансплантировали в целом или на место сомита в E2 хозяев кур (Moyon et al., 2001a). Потомство трансплантированных EC отслеживали у эмбрионов хозяев, используя антитела QH1, специфичные для EC перепела, но не распознающие хозяйские EC (Pardanaud et al., 1987). Мы использовали гибридизацию
с ephrinB2 или NRP-1 зондами, которые распознавали артериальные, но не венозные EC у обоих видов. Затем задались вопросом, будут ли ЕС, трансплантированные из артерий перепела колонизировать только артерии кур или также и вены. Эксперименты показали, что вплоть до поздних стадий развития (E11), перепелиные EC из артерий или вен колонизировали с одинаковой эффективностью и артерии и вены хозяев. Более того, экспрессия артериальных маркеров менялась в соответствии с новым окружением: когда перепелиные клетки колонизировали артерии, то они экспрессировали артериальные маркеры, если же они колонизировали вены, то нет независимо от своего происхождения. Т.о., EC являются пластичными в отношении артериально-венозной дифференцировки вплоть до ст. E11. После E11, EC, происходящие из трансплантированных артерий колонизировали только артерии хозяев, тогда как из вен колонизировали только вены хозяев. Количественная оценка трансплантированных EC показала, что эта потеря пластичности затрагивает огромное большинство (98%) от всех пересаженных EC. Эти эксперименты указывают на некоторые внутренне присущие изменения трансплантированных артерий и вен после E11, которые ограничивают их способность колонизировать соответственно артерии и вены хозяев. Чтобы определить источник сигнала, ограничивающего пластичность, мы удаляли сосудистую стенку от E14 фрагментов аорты перепела, тогда они полностью восстанавливали свою способность
колонизировать вены: примерно 50% трансплантированных клеток обнаруживалось в артериях и 50% в венах. Точная природа сигнала, ограничивающего пластичность и исходящего из стенки сосуда неизвестна.
Чтобы определить, может ли EC пластичность в отношении артериальрно-венозной дифференцировки происходит также и в отношении нормального эмбрионального развития, мы изучали желточные мушки эмбрионов разных стадий, используя комбинацию time-lapse видео-микроскопии живых эмбрионов и гибридизацию in situ с маркерами, специфичными для артерий и вен (LeNoble et al., 2004). Мы наблюдали, что до начала циркуляции артериальные маркеры экспрессируются в артериальном капиллярном сплетении и заднего полюса эмбрионов, территории, где формируется vitelline артерия. Многие мелкие капиллярные веточки этого артериального сплетения оказываются отсоединенными от основной ветви вителлиновой артерии во время её образования. Экспрессия артериальных маркеров в этих несоединенных веточках быстро подавляется (Рис. 4D). Напротив, экспрессия артериальных маркёров поддерживается во вновь формируемой вителлиновой артерии (Рис. 4D). Не соединившиеся капилляры, в которых подавлены артериальные маркеры теперь служат для образования вителлиновой вены. Эти наблюдения показывают, что задняя вителлиновая вена формируется благодаря инкорпорации ранее артериальных капиллярных сегментов, демонстрируя, что EC пластичность необходима и во время нормальной артерио-венозной дифференцировки. Более того, эти эксперименты подтвердили, что гемодинамические силы играют главную роль во время артериально-венозной дифференцировки и формирования паттерна.
Чтобы проверить эту идею непосредственно мы вызывали некоторые альтерации в кровотоке развивающихся эмбрионов кур (LeNoble et al.,
2004). Сначала мы получали эмбрионов, лишенных циркуляторной системы, нарушая эмбриональное сердце. У таких эмбрионов желточный мешок продолжает расти, по крайней мере в течение 7 дней, несмотря на дегенерацию эмбриона и отсутствие перфузии. Однако, желточный мешок не мог формировать артерии и вены и сохранял конфигурацию первичного сосудистого сплетения. При гибридизации
In situ с артериальными маркерами было установлено, что некоторые области этого желточного мешка экспрессируют артериальный маркер ephrinB2, тогда как др. нет. Т.о., инициация экспрессии артериальных маркеров происходит независимо от тока. Затем мы производили перевязку вителлиновой артерии на одной из сторон желточного мешка (Рис. 5) (Stephan, 1952). У таких эмбрионов вся перевязанная сторона становилась venularized в течение более 24 ч, на это в первую очередь указывало направление кровотока, которое становилось направленным в обратную сторону в перевязанном сосуде и, во-вторых, по экспрессии артериальных маркеров, которые быстро исчезали после перевязки (LeNoble et al., 2004). Т.о., манипуляции с паттерном кровотока могут морфологически и генетически трансформировать артерии в вены. Те же самые манипуляции с кровотоком могут также трансформировать вены в артерии. В самом деле вителлиновая артерия на противоположной стороне значительно увеличивалась после перевязки, т.к. она получала больше крови. Постепенно эти артерии пересекали срединную линию оси эмбрион-желточный мешок как на переднем, так и заднем полюсе эмбриона (Рис.5). Time-lapse видио-микроскопия показала, что веточки передней вителлиновой вены интегрируются в вителлиновую артерию, когда она пересекает срединную линию. Следовательно, кровоток служит как мастер-регулятор артериально-венозной дифференцировки в желточном мешке. Скорее это, чем предетерминированность, ЕС сосуды желточного мешка, по-видимому, служат 'кирпичиками', которые могут быть использованы развивающейся сосудистой системой для формирования артерий или вен.
Formation of the lymphatic vascular system
Лимфатическая система является последним сосудистым компартментом, который формируется во время развития. Florence Sabin впервые предложила теорию образования лимфатических сосудов. Она пришла к заключению, что самые ранние примитивные лимфатические сосуды являются результатом отделения EC от кардинальных вен. Затем эти клетки пролиферируют и мигрируют в направлении органов эмбриона и формируют лимфатическую систему (Sabin,1902). Др. исследования показали, что соединение лимфатической и венозной систем вторично. Было предположено, что лимфатические стволовые клетки, наз. lymphangioblasts, пронизывают мезенхиму чтобы сформировать примитивные лимфатические мешки (Huntington and McClure, 1908; Kampmeier, 1912). Недавние исследования с использование зачатков конечностей эмбрионов кур показали, что лимфатические сосуды могут происходить благодаря как отделению сосудов от кардинальной вены, так и благодаря мезодермальным lymphangioblasts (Schneider et al., 1999; Wilting et al., 2001; Wilting et al., 2000).
Специфические маркеры для лимфатических EC, идентифицированные недавно, стали новым инструментом для изучения лимфангиогенеза. Кроме того были идентифицированы различные молекулы, участвующие в последовательных ступенях развития лимфатической системы (Рис. 6). Самым ранним маркером лимфатических EC является гомеобоксный транскрипционный фактор Prox-1 (prospero-related homeobox protein-1) (Wigle and Oliver, 1999). Prox-1 впервые обнаруживает свою экспрессию в сосудистой системе в латеральном аспекте задней кардинальной вены на ст. E9, незадолго перед началом отделения (sprouting)
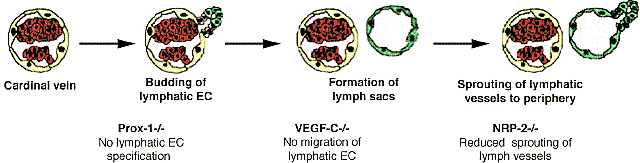 Рис. 6. Formation of the lymphatic vascular system. Schematic drawing representing the initial steps of lymphatic vessel formation. Mouse mutants
implicated in these steps are indicated. See text for details.
Рис. 6. Formation of the lymphatic vascular system. Schematic drawing representing the initial steps of lymphatic vessel formation. Mouse mutants
implicated in these steps are indicated. See text for details.
лимфатических EC от этой вены. Инактивация Prox-1 приводит к полному отсутствию образования лимфатических EC. Детальный анализ фенотипа Prox-1
-/- мышей показал, что происходит отпочкование лимфатических ЕС от латерального аспекта кардинальных вен. Однако, отпочковавшиеся клетки неспособны приобретать экспрессию специфичных лимфатических маркеров и вместо этого продолжают экспрессировать маркеры кровеносных сосудов, которые обычно подавляются после отпочкования (Wigle et al., 2002). Спецификация лимфатических EC т.о. зависит от присутствия Prox-1.
После спецификации лимфатические EC эти клетки обычно мигрируют, чтобы сформировать первые эмбриональные лимфатические мешки. Миграция лимфатических EC в направлении лимфатических мешков сильно зависит от присутствия фактора роста VEGF-C: у мышей, дефицитных по этому фактору роста, экспрессирующие
Prox-1 лимфатические EC образуются, но неспособны мигрировать в направлении лимфатических мешков и постепенно погибают (Karkkainen et al., 2004).
VEGF-C-/- погибают примерно на ст. E17 из-за образования массивного отёка, т.к. kyb не образуют лимфатических сосудов. VEGF-C специфически связывается с высоким сродством со своими тирозин киназными рецепторами VEGFR3 (Alitalo and
Carmeliet, 2002 for review). Во время эмбриогенеза, VEGFR3 впервые экспрессируется в субнаборе EC кровеносных клеток, а затем становится ограниченным лимфатическими EC (Kaipainen et al., 1995; Wilting et al., 1997). В соответствии с этой ранней экспрессией VEGFR3 подтвержено вовлечение его в эмбриональный ангиогенез (Dumont et al., 1998).
Дефицитные по VEGFR3 мыши обнаруживают дефектное развитие кровеносных сосудов на ранних стадиях эмбриогенеза и эмбрионы погибают на ст. E9.5. Васкулогенез и ангиогенез происходят. но крупные сосуды становятся аномально организованными с дефектными просветами, что приводит к накоплению жидкости в перикардиальной полости и к сердечно-сосудистой недостаточности (Dumont et al., 1998). Т.о., VEGFR3 существенен для функции ремоделирования первичной капиллярной васкулатуры еще до образования лимфатических сосудов. VEGF-C также соединяется с NRP-2 рецептором, который специфически экспрессируется венами и постепенно становится ограниченным лимфатическими сосудами (Karkkainen et al., 2001; Yuan et al., 2002). В соответствии с этой специфической экспрессией мы показали, что мыши, дефицитные по NRP-2 обнаруживают избирательные дефекты в образовании лимфатических сосудов (Yuan et al., 2002). Интересно, однако, что фенотипы
VEGF-C и NRP-2 дефицитных мышей, по-видимому, различны. У
NRP-2-/- мышей формирование лимфатических мешков происходит нормально, тогда как отделение лимфатических сосудов от лимфатических мешков к периферии редуцировано (Рис. 6). Точные молекулярные механизмы, регулирующие различные ступени эмбрионального лимфангиогенеза еще предстоит выяснить.
Perspectives
Research carried out over the past decade has provided major
insights into the mechanisms regulating the emergence of
endothelial progenitors from the mesoderm, their coalescence
into the primary vascular system, the remodeling of this system
into arteries and veins as well as into the formation of lymphatic
endothelium. The molecules implicated in these different
developmental processes are also essential for the maintenance
of the adult vascular system. For example, patients suffering from
hereditary lymphedema have been found to carry a mutation in
the tyrosine kinase domain of VEGFR3 (Karkkainen et al., 2000).
Elucidation of the precise function and interaction of the different
molecular players will thus certainly lead to the development of
novel treatments for vascular disorders. A particularly interesting
aspect of recent research carried out on the vascular system is the
identification of neural guidance receptors such as ephrins and
neuropilins, which are expressed on arteries, veins and lymphatic
vessels. In the nervous system, these molecules are implicated in
the establishment of cell boundaries and in the guidance of
developing axons. It is thus tempting to speculate that these
receptors may also play a role in vessel guidance during embryonic
development. Indeed, recent studies have shown that specialized
cells termed ‘tip cells’ are present at the ends of developing vessel
sprouts, which extend filipodia that explore their environment in
much the same way as the growth cone of a developing axon
(Gerhardt et al., 2003; Ruhrberg et al., 2002). Moreover, the
patterning of developing arteries in the limb skin of mouse
embryos has been shown to depend on interactions with nerves
(Mukouyama et al., 2002), emphasizing the close interaction
between the two systems. Future studies will be directed at
exploring the precise interactions between blood vessels and
nerves during development as well as in pathologies.
 Рис. 1. Schematic representation of the circulatory system. (Modified
from Karkkainen et al., 2002). Blood is pumped from the heart through
arteries, arterioles and capillaries to the tissues, where exchanges occur.
Blood is returned to the heart via the venous circulation. The lymphatic
system, composed of lymphatic capillaries and vessels, drains excess
fluid, the lymph, containing proteins, lipids and immune cells, from the
extracellular space and returns it to the venous circulation.
Рис. 1. Schematic representation of the circulatory system. (Modified
from Karkkainen et al., 2002). Blood is pumped from the heart through
arteries, arterioles and capillaries to the tissues, where exchanges occur.
Blood is returned to the heart via the venous circulation. The lymphatic
system, composed of lymphatic capillaries and vessels, drains excess
fluid, the lymph, containing proteins, lipids and immune cells, from the
extracellular space and returns it to the venous circulation. 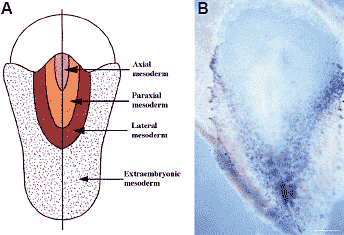 Рис. 2. Origin of endothelial cells in the gastrulating chick embryo.
(A) Map of presumptive embryonic territories (from Vakaet, 1985). (B)
Labeling of a chick embryo at stage 4 of Hamburger and Hamilton
(Hamburger and Hamilton, 1951), corresponding to the stage shown in A,
with an antisense riboprobe specific for VEGFR2. The presumptive
extraembryonic and lateral mesoderm expresses this receptor.
Рис. 2. Origin of endothelial cells in the gastrulating chick embryo.
(A) Map of presumptive embryonic territories (from Vakaet, 1985). (B)
Labeling of a chick embryo at stage 4 of Hamburger and Hamilton
(Hamburger and Hamilton, 1951), corresponding to the stage shown in A,
with an antisense riboprobe specific for VEGFR2. The presumptive
extraembryonic and lateral mesoderm expresses this receptor. 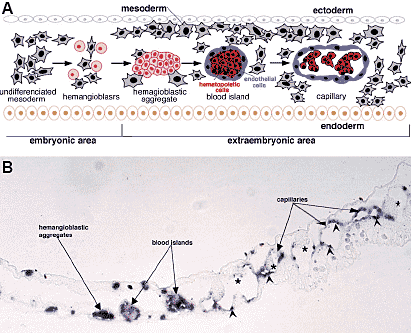 Рис. 3. Differentiation of yolk sac blood islands. (A) Schematic representation: see
text for details. (B) Transverse section through the extraembryonic area of a 15-somite stage embryo, labeled with an antisense riboprobe specific for VEGFR2. Hemangioblastic aggregates are positive. In the blood islands and capillaries, expression of the receptor decreases in the hematopoietic cells (asterisks), but is maintained in the endothelial
cells (arrowheads). Bar, 75 мm.
Рис. 3. Differentiation of yolk sac blood islands. (A) Schematic representation: see
text for details. (B) Transverse section through the extraembryonic area of a 15-somite stage embryo, labeled with an antisense riboprobe specific for VEGFR2. Hemangioblastic aggregates are positive. In the blood islands and capillaries, expression of the receptor decreases in the hematopoietic cells (asterisks), but is maintained in the endothelial
cells (arrowheads). Bar, 75 мm. 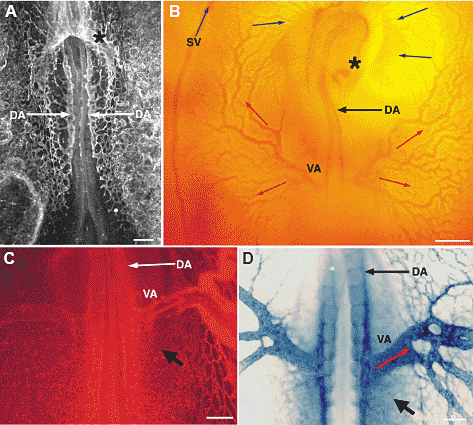 Рис. 4. Arterial-venous differentiation in
the yolk sac. (A) Primary capillary plexus
stage. Labeling of a 10-somite stage quail
embryo with the QH1 antibody. Note labeling
of the endocardium (asterisk) and the paired
dorsal aorta (DA, arrows). At this stage, only
these two major vessels are formed, the
remainder of the vascular system is seen as a
capillary plexus. (B) Photo-micrograph of a
living chick embryo 24 hours older than the
embryo in A. The heart is indicated (asterisk).
Note that in the yolk sac, two main arteries,
the vitelline arteries (VA) have formed. Arterial
blood (red arrows) is pumped from the heart
through the dorsal aorta (DA) and the vitelline
arteries into the yolk sac and is returned to the
heart via the venous circulation (blue arrows)
either directly or through the sinus vein (SV).
(C) Onset of formation of the posterior vitelline
vein. Embryo at the same stage as in B.
Intracardiac injection of DiI-Ac-LDL, which
specifically recognizes endothelial cells. Note
the dorsal aorta and vitelline artery. As more
flow passes through these vessels, they
enlarge. Smaller vessels of the initial arterial
capillary plexus (black arrow) carry
progressively less flow and are disconnected
from the main branch of the dorsal aorta. As
shown by the intracardiac injection, these vessels are still perfused through more distal parts of the capillary plexus. They will be used to form the posterior vitelline vein. (D) Arterial marker expression. In situ hybridization with an antisense riboprobe specific for NRP-1. Note strong expression in the vitelline artery (VA), but reduced expression in the disconnected capillaries that will form the vitelline vein (black arrow). Bars 250 мm.
Рис. 4. Arterial-venous differentiation in
the yolk sac. (A) Primary capillary plexus
stage. Labeling of a 10-somite stage quail
embryo with the QH1 antibody. Note labeling
of the endocardium (asterisk) and the paired
dorsal aorta (DA, arrows). At this stage, only
these two major vessels are formed, the
remainder of the vascular system is seen as a
capillary plexus. (B) Photo-micrograph of a
living chick embryo 24 hours older than the
embryo in A. The heart is indicated (asterisk).
Note that in the yolk sac, two main arteries,
the vitelline arteries (VA) have formed. Arterial
blood (red arrows) is pumped from the heart
through the dorsal aorta (DA) and the vitelline
arteries into the yolk sac and is returned to the
heart via the venous circulation (blue arrows)
either directly or through the sinus vein (SV).
(C) Onset of formation of the posterior vitelline
vein. Embryo at the same stage as in B.
Intracardiac injection of DiI-Ac-LDL, which
specifically recognizes endothelial cells. Note
the dorsal aorta and vitelline artery. As more
flow passes through these vessels, they
enlarge. Smaller vessels of the initial arterial
capillary plexus (black arrow) carry
progressively less flow and are disconnected
from the main branch of the dorsal aorta. As
shown by the intracardiac injection, these vessels are still perfused through more distal parts of the capillary plexus. They will be used to form the posterior vitelline vein. (D) Arterial marker expression. In situ hybridization with an antisense riboprobe specific for NRP-1. Note strong expression in the vitelline artery (VA), but reduced expression in the disconnected capillaries that will form the vitelline vein (black arrow). Bars 250 мm. 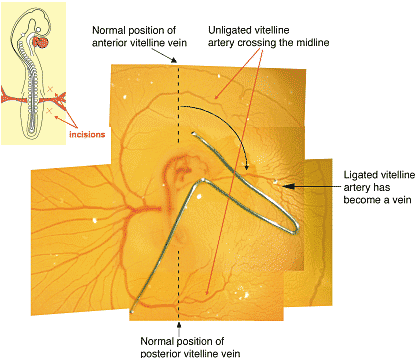 Рис. 5. Flow manipulations transform arteries into veins and veins into arteries.
Ligation of the right vitelline artery of a chick embryo (Stephan, 1952). The schematic drawing shows the experimental manipulation: two small incisions are made on each side of the vitelline artery, a metal clip is then inserted underneath this artery. The clip is devised such that it lifts the right vitelline artery and blocks blood flowing through it. The
photomicrograph shows such an embryo 24 hours after ligation: note that the right vitelline artery has been transformed into a vein. The normally present anterior and posterior vitelline veins are absent: they have been incorporated into the unligated left vitelline artery, which crosses the midline of the embryo/yolk sac axis.
Рис. 5. Flow manipulations transform arteries into veins and veins into arteries.
Ligation of the right vitelline artery of a chick embryo (Stephan, 1952). The schematic drawing shows the experimental manipulation: two small incisions are made on each side of the vitelline artery, a metal clip is then inserted underneath this artery. The clip is devised such that it lifts the right vitelline artery and blocks blood flowing through it. The
photomicrograph shows such an embryo 24 hours after ligation: note that the right vitelline artery has been transformed into a vein. The normally present anterior and posterior vitelline veins are absent: they have been incorporated into the unligated left vitelline artery, which crosses the midline of the embryo/yolk sac axis. 