Очевидно, без избирательного мечения крестцовых NCC, которое могло бы быть использовано вместе с техникой иммуногистохимии, чтобы идентифицировать энтерические нейрональные и глиальные фенотипы, реально отследить развитие крестцовых NCC трудно. Кроме того, без специфического мечения этой субпопуляции, если крестцовые NCC колонизируют кишку после проникновения туда vagal клеток, так что их присутствие в задней кишке будет "замаскировано" проникшими ранее vagal клетками нервного гребня, их определение окажется невозможным. Эта проблема была преодолена в серии сравнительно недавних исследований инициированных в лаб. Nicole
Le Douarin, с использованием перепел-курица межвидовых трансплантаций, избирательно метящих субпопуляции NCC, вместе с двойным мечением антителами для идентификации клеток перепела и нейрональных и глиальных фенотипов в энтерических ганглиях кур. Комбинация этих техник позволила отследить пути пространственно-временной миграции vagal и крестцовых NCC вместе с идентификацией последующих фенотипов клеток, производных нервного гребня, внутри кишечника (Burns et al., 2000, Burns and Le Douarin, 1998; Burns and Le Douarin, 2001). Эти исследования продемонстрировали, что vagal NCC первоначально накапливаются в каудальных частях бранхиальных дуг, затем проникают в мезенхиму передней кишки на ст. E3 и мигрируют в ростро-каудальном направлении, колонизируя заднюю кишку на E7-9. Крестцовые NCC обнаруживаются первоначально в скоплениях дорсальной стенки задней кишки, где они образуют нерв Remak на ст. E3.5. Крестцовые NCC, располагающиеся в нерве Remak вплоть до ст. E7, когда нервные волокна проецируются в заднюю кишку, затем мигрируют в кишку вдоль нервных волокон, колонизируя заднюю кишку в больших количествах, начиная со ст. E10. Эти находки чётко продемонстрировали, что крестцовые NCC колонизируют заднюю кишку спустя 2-3 дня после её колонизации vagal NCC. Эта задержка миграции и пролиферации крестцовых NCC в заднюю кишку подтверждает идею, что крестцовые клетки нервного гребня нуждаются в присутствии факторов или сигнальных молекул, высвобождаемых vagal производными нервного гребня или их потомками, чтобы проникнуть в заднюю кишку. Однако, когда vagal нервный гребень удален, то это препятствует миграции vagal-производных NCC в кишку и в конечном счете колонизации задней кишки (Burns et al., 2000), крестцовые клетки колонизируют кишку и дифференцируются, по-видимому, обычным способом, т.к. установлено, что вклад в ENS крестцовых NCC не нуждается во взаимодействии с vagal-происхождения клетками. Исследования Burns et al., (Burns et al., 2000, Burns and Le Douarin, 1998) показали, что крестцовые NCC мигрируют в заднюю кишку независимо от vagal NCC, позднее и дифференцируются в нейроны и глию. Хотя крестцовые NCC были обнаружены во всей post-umbilical кишке, их вклад в основном ограничен концом задней кишки, где они представляют собой 17% энтерических нейронов (Burns and Le Douarin, 1998). Подтверждение поле позднего поступления крестцовых NCC в заднюю кишку получены также и на эмбрионах мышей (Kapur, 2000). Используя экспрессию Wnt1-lacZ трансгена в качестве раннего маркёра мышиных NCC, этот авт. описал раннюю колонизацию pelvic ganglia в мезенхиму, окружающую заднюю кишку, тогда как кишка оставалась свободной от меченных клеток до поступления vagal-происхождения энтерических предшественников. Далее, когда ранняя свободная от vagal NCC задняя кишка удалялась и культивировалась под почечной капсулой мыши, то нейроны в эксплантате не развивались, указывая на отсутствие рано мигрирующих крестцовых производных клеток в задней кишке до поступления туда vagal клеток. Эти находки указывают на то, что крестцовые NCC первоначально колонизируют extramural ганглии (т.e. нерв Remak у кур; pelvic ganglia у мышей) и вторично проникают в заднюю кишку после их колонизации vagal NCC.
Межвидовые трансплантации перепел-курица выявили различия в путях миграции vagal NCC внутри разных регионов кишечника кур (Burns and Le Douarin, 1998), Напр., когда колонизируется pre-umbilical кишечник, то слои гладкомышечных клеток недоразвиты и мигрирующие клетки нервного гребня случайно распределены внутри мезенхимы. Однако, в post-umbilical кишечнике фронт миграции vagal NCC располагается в наиболее наружных слоях мезенхимы, соседствующих с серозным эпителием. По мере продвижения клеток нервного гребня вдоль кишечника, чтобы достичь слепой кишки (caecum), начинает развиваться циркулярный слой мышц в результате чего мигрирующие NCC сталкиваются с др. средой, через которую они мигрируют. Здечь клетки нервного гребня становятся ориентированными в любую сторону от циркулярного мышечного слоя, в областях, соответствующих презумптивным myenteric и submucosal ганглиям. Дальнейшие изменения паттерна миграции происходят в colorectum. Vagal NCC первоначально колонизируют подслизистую область прежде чем мигрировать наружу через слой циркулярных мышц, чтобы заселить область myenteric сплетения. Хотя подслизистое сплетение колонизируется первым с помощью NCC, но myenteric сплетение первым созревает и экспрессирует нейрональные маркёры (Burns and Le Douarin, 1998). Причины подобных различий колонизации ENS неясны, но используются взаимодействия с нервными волокнами, произошедшими из нерва Remak, которые пенетрируют кишку на уровне myenteric сплетения.
В отличие от colorectum у птиц, в кишечнике птиц и млекопитающих, включая и человека, NCC первоначально колонизируют myenteric сплетение, а подслизистое сплетение возникает в результате вторичной миграции клеток в myenteric область (Payette et al., 1984; Burns and Le Douarin, 1998; McKeown et al., 2001). Недавние исследования в лаб. Michael Gershon с использовали netrins для отслеживания этих вторичных миграций из наружной мезенхимы кишечника в направлении подслизистой и в поджелудочную железу (Jiang et al., 2003). Было показано, что netrins (netrin-1 и netrin-3 у мышей и netrin-2 у кур) и нетринровые рецепторы DCC (deleted in colorectal cancer), neogenin и adenosine A2b рецепторы экспрессируются в слизистой плодов и поджелудочной железе и что производные нервного гребня клетки, экспрессирующие DCC, мигрируют в направлении клеток, экспрессирующих netrin и т.о. занимают область презумптивного подслизистого сплетения.
В противоположность vagal клеткам у кур крестцовые NCC первоначально
объединяются в дорсальном аспекте стенки кишки, чтобы сформировать нерв Remak, а затем уж мигрируют в наружные слои кишки, вдоль аксонов, которые проецируются из Remak в область презумптивного myenteric сплетения. Эти клетки, следовательно, первоначально колонизируют наружные слои кишки, затем мигрируют вглубь через слоё циркулярных мышц, чтобы колонизировать область подслизистого сплетения (Burns and Le Douarin, 1998). Исследование Shepherd and Raper (Shepherd and Raper, 1999) пролило свет на факторы, влияющие на формирование паттерна проекций аксонов, которые затем в свою очередь влияют на пространственно-временную колонизацию задней кишки крестцовыми NCC. Эти авт. сообщили, что в раннем развитии, до врастания аксонов с заднюю кишку, collapsin-1, секретируемый гликопротеин, который относится к семейству Semaphorin молекул (Luo et al., 1993) и действует как репелент для аксонов (Behar et al., 1996, Messersmith et al., 1995, Puschel et al., 1995), экспрессируется по всей стенке задней кишки. Однако, на ст. E8, экспрессия collapsin-1 отступает от наружных мышечных слоёв и ограничивается внутренним подслизистым и слизистым слоем. Удаление этого ингибирующего наведение сигнала позволяет аксонам проецироваться из нерва Remak в кишку, это в свою очередь облегчает вступление крестцовых NCC в заднюю кишку. хотя collapsin-1, как сообщалось, является отталкивающим сгналом для мигрирующих NCC в областях заднего мозга и туловища, где эти популяции клеток экспрессируют collapsin-1 рецептор, neuropilin-1 (Eickholt et al., 1999), по данным Shepherd and Raper (Shepherd and Raper, 1999) collapsin-1 не играет роли в формировании паттерна vagal NCC в задней кишке, т.к. на ст. E6/E7эти клетки колонизируют каудальные области кишки, где присутствует collapsin-1 мРНК. Однако, не ясно затрагивает ли collapsin-1 формирование паттерна крестцовых NCC непосредственно, т.к. он, по-видимому, ингибирует рост аксонов, вдоль которых они мигрируют, чтобы проникнуть в заднюю кишку, чем на миграцию самих крестцовых NCC per se.
Do vagal and sacral NCC have special properties which
allow them to colonise the gut?
ENS происходит из клеток, которые возникают в двух очень специфически х регионах нейрооси - vagal и sacral нервном гребне. Почему NCC мигрируют в кишку из этих особых мест? Благоприятны или пригодны условия для колонизации кишки или эти клетки нервного гребня обладают определенными "homing" зарактеристиками, которые позволяют им находить кишку? Экстенсивные гетеротопические трансплантации, осуществленные в лаб. Nicole Le
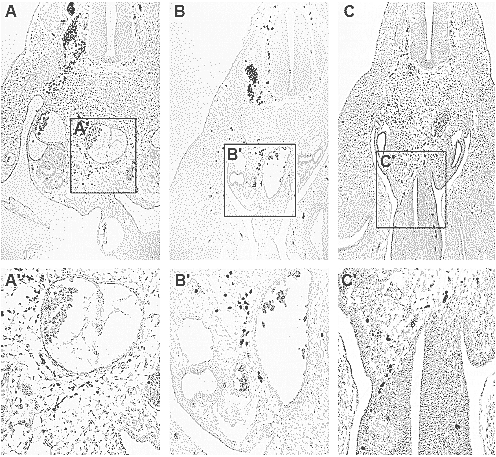 Fig. 1. Sections through chick hosts
which received grafts of quail dorsal
neural tubes and then were fixed 48 h
later (at stage 22/23). Quail cells are
identified with the QCPN antibody and
appear black in these sections. (A,A')
Neural crest cells derived from a sacrallevel
neural tube were grafted to the
thoracic level. The boxed area shown at
higher magnification in (A') reveals that
the cells migrate no farther than just ventral
to the dorsal aorta. (B,B') Similarly when
thoracic-level neural crest cells are grafted
to the thoracic level of a chick host, the
grafted cells go no farther than the lateral
edge of the dorsal aorta. In both instances,
the grafted cells are coincident with the
host neural crest cells. (C,C') However,
thoracic-level quail neural crest cells do
reach the gut mesenchyme if they are
grafted to the sacral level. Reprinted from
Dev. Biol., Vol 219, No 1, Erickson and
Goins, "Sacral neural crest cell migration
to the gut is dependent upon the migratory
environment and not cell-autonomous
migratory properties", pages 79-97,
Copyright (2000), with permission from
Elsevier.
Fig. 1. Sections through chick hosts
which received grafts of quail dorsal
neural tubes and then were fixed 48 h
later (at stage 22/23). Quail cells are
identified with the QCPN antibody and
appear black in these sections. (A,A')
Neural crest cells derived from a sacrallevel
neural tube were grafted to the
thoracic level. The boxed area shown at
higher magnification in (A') reveals that
the cells migrate no farther than just ventral
to the dorsal aorta. (B,B') Similarly when
thoracic-level neural crest cells are grafted
to the thoracic level of a chick host, the
grafted cells go no farther than the lateral
edge of the dorsal aorta. In both instances,
the grafted cells are coincident with the
host neural crest cells. (C,C') However,
thoracic-level quail neural crest cells do
reach the gut mesenchyme if they are
grafted to the sacral level. Reprinted from
Dev. Biol., Vol 219, No 1, Erickson and
Goins, "Sacral neural crest cell migration
to the gut is dependent upon the migratory
environment and not cell-autonomous
migratory properties", pages 79-97,
Copyright (2000), with permission from
Elsevier.
Douarin продемонстрировали, что судьбы NCC больше зависят от сигналов, встречаемых в микроусловиях на путях миграции, скорее, чем от аксиального уровня происхождения (Le Douarin and Kalcheim, 1999). Если фрагменты нейральных примордиев от перепела трансплантировать эмбрионам кур, то NCC мигрируют в места. характерные для их нового аксиального уровня скоре, чем для места их происхождения. Напр., если vagal нервный гребень замещается нервным гребнем из туловища эмбриона перепела, который обычно дает сенсорные и симпатические ганглии, то трансплантированные клетки колонизируют кишку и дают нейроны, которые обладают соотв. cholinergic, peptidergic и monoaminergic энтерическими фенотипами (Fontaine-Perus et al., 1982, Le Douarin et al., 1975, Le Douarin and Teillet, 1974,
Rothman et al., 1986). Кроме того, когда цефалический и vagal нервный гребень трансплантируется на аксиальный уровень adrenomedullary, соседствующий с сомитами 18-24, то эти клетки давали адренэргические клетки в симпатических ганглиях и клетки надпочечника (Le Douarin and Teillet, 1974). Следовательно, нет доказательств, что
vagal и sacral NCC предетерминированы, чтобы приобрести энтерические фенотипы до миграции, т.к. они дифференцируются в сайт-специфические нейрональные фенотипы, когда трансплантируются на др. уровни нейрооси, однако всё ещё возможно, что эти клетки могут обладать специальными миграторными свойствами или неким уровнем пре-спецификации, которые позволяют им колонизировать кишку и формировать ENS. Для проверки использовали гетеротопически межвидовые трансплантации, где vagal нервный гребень, полученный от E1.5 эмбрионов перепела, трансплантировался в крестцовую область E2.5 куриных эмбрионов. Трансплантированные vagal NCC быстро мигрировали в кишку и многочисленные клетки наблюдались в мезенхиме задней кишки уже на ст. E4. Сolorectum экстенсивно колонизировался на ст. E7 и E10, стадии, когда крестцовые NCC обычно начинают вступать в заднюю кишку в больших количествах, myenteric и submucosal ganglia были хорошо сформированы донорскими клетками, а фронт миграции прогрессировал в pre-umbilical часть кишечника (Burns et al., 2002). Напротив, крестцовые NCC, будучи трансплантированными в vagal область нейрооси, также колонизировали кишку, но значительно в меньших количествах, чем vagal клетки, способом, более похожим на колонизацию ими задней кишки. Эти находки демонстрируют клеточно автономные различия миграторных свойств двух популяций NCC, причем ростаральные и vagal NCC являются более инвазивными в отношении кишечника, чем каудальная, крестцовая популяция NCC. Причины подобных инвазивных различий пока не установлены, но в качестве вносящих вклад факторов могут быть изменения в экспрессии клеточных сигнальных молекул, участвующих в миграции/пролиферации NCC. Кроме того, vagal NCC может быть преспецифицирован в качестве предшественников ENS, как это было первоначально предположено Le
Douarin and Teillet (Le Douarin and Teillet, 1974). Эта теория подтверждается исследованиями, в которых продемонстрирована способность vagal NCC достигать кишки из разных мест (Burns et al., 2002). Rothman et al., (1993) продемонстрировали, что если сегменты эмбриональной кишки, содержащие vagal NCC трансплантировать обратно в vagal и sacral области молодых эмбрионов, то vagal NCC ре-эмигрируют и колонизируют развивающуюся юную кишку.
Согласно представленным выше доказательствам, касающимся судьбы vagal NCC, трансплантированных в др. регионы нейрооси, проводили гетеротопические трансплантации, осуществленные в лаб. Carol Erickson, для проверки гипотезы, что крестцовые NCC обладают клеточно автономными свойствами, которые позволяют им колонизировать кишку. Путем трансплантации крестцового нервного гребрня в область туловища и vice versa, Erickson and Goins (Erickson and
Goins, 2000) установили, что клетки нервного гребня ведут себя в соответствии со своим новым положением скорее, чем с местом происхождения. Так, торакальные клетки, трансплантированные в крестцовую область, первоначально распределялись как и нормальные крестцовые клетки и также оказывались в мезенхиме кишечника на поздних стадиях развития, тогда как крестцовые клетки, трансплантированные на торакальном уровне не достигали дорсальной мезенхимы кишки (Рис. 1). Авт. интерпретировали эти находки как указывающие на то что: - (i) крестцовые NCC не облают клеточно автономными свойствами, которые позволили бы им колонизировать кишку и (ii) на крестцовом уровне средовые условия достаточны, чтобы позволить клеткам с др. уровней оси проникать в кишечную мезенхиму (Erickson and Goins, 2000).
Что может наделить пре-спецификацией vagal NCC в выборе энтерической судьбы? Премиграторные vagal NCC, как было показано, экспрессируют RET (Robertson and Mason, 1995), который существенен для развития нормальной ENS у мышей и людей (Edery et al., 1994, Pasini et al., 1995, Romeo et al., 1994, Schuchardt et al., 1994) и может быть вовлечен в пре-спецификацию vagal NCC в энтерический клон. Важность RET в развитии ENS хорошо документирована (Taraviras et al., 1999; Manie et al., 2001), а исследования, предпринятые в лаб. Vassilis Pachnis, продемонстрировали роль RET-позитивных NCC как мультипотенциальных предшественников ENS.
Когда RET+ клетки были выделены и инъецированы в небольшом количестве или индивидуально в желудок aganglionic мышиного ЖКТ и затем после культивирования в течение 7 дней были выявлены энтерические нейроны и глия по всему кишечнику, это указывает на экстенсивную миграцию и пролиферацию RET+ vagal NCC (Natarajan et al., 1999). Хотя недавно мы показали, что RET
экспрессируется также и крестцовыми NCC (Burns et al., 2002), но остаётся неясным, могут ли др. факторы объяснить различия в инвазивной способности vagal и sacral NCC. Внутри кишки недифференцированные NCC, как было показано, являются p75NTR/RET/Phox2b/Sox10 иммуно-позитивными (Young et al., 2003; Young et al., 1999), , следовательно, сложные наборы перекрывающихся сигналов могут быть необходимы для наделения клеток нервного гребня энтерическими клональными свойствами. По ходу развития экспрессия сигнальных молекул, по-видимому, модифицируется, чтобы направить развитие клеток нервного гребня в направлении нейронального и глиального фенотипов в кишке. Напр., дифференцирующиеся нейроны последовательно приобретают более высокие уровни RET, низкие p75NTR и не обнаружимые Sox10 при иммуно-окрашивании, тогда как глиальные предшественники являются BFABP+/Sox10+/p75NTR+, с S100b и GFAP
обнаруживаемыми позднее в ходе развития (Young et al., 1999).
Итак:- (i) vagal и sacral NCC не детерминированы только к становлению ENS клоном, (ii) vagal клетки (и вообще-то и крестцовые клетки) могут быть пре-специфицированы в направлении ENS клонов, возможно в результате, по крайней мере частично, экспрессии RET рецепторов, (iii) vagal NCC наделены более высокой миграторной и пролиферативной способностью, чем крестцовые клетки и (iv) средовые условия на уровнях vagal и sacral благоприятны для колонизации кишки клетками нервного гребня со всех уровней нейрооси.
Unidirectional migration of vagal and sacral NCC during
gut colonisation
Vagal NCC колонизируют кишку в виде одной ростро-кудальной волны миграции (Burns and Le Douarin, 1998, Young et al., 1998), при этом
vagal клетки достигают уровня пупка у кур на ст. E5, области слепой кишки к
E6 и colorectum к E7.5. По всей длине кишечник эмбрионов кур колонизируется к E8.5 (Burns and Le Douarin, 1998). У мышей и людей кишечник колонизируется vagal NCC на ст. E14 (Young et al., 1998) и 7-й неделе (Wallace and Burns, 2005) соотв. Крестцовые NCC колонизируют кишку с противоположном каудально-рострально направлении; эти клетки первоначально формируют нерв Remak у кур, затем вступают в заднюю кишку, начиная с E7. Хотя крестцовые NCC наиболее многочисленны в терминальной области задней кишки, они могут быть обнаружены вдоль всего post-umbilical кишечника. Что же управляет этими двумя популяциями клеток нервного гребня, направляя их распространение в разные стороны кишки? Одним из возможных объяснений является то, что "population pressure" служит источником migratory drive, как было предположено (Hearn et al., 1998) для NCC
in vitro. Согласно этой модели, vagal NCC д. форсировать движение прочь от точки своего вступления в переднюю кишку, заставляя их мигрировать в направлении незанятых каудальных регионов кишки. Однако, это вряд ли может быть приложимо к крестцовым NCC, т.к. эти клетки вступают в кишку, когда кишка уже обильно колонизирована vagal клетками, следовательно, не существует больше "незанятых" областей для перемещения. Дальнейшим аргументом против теории "population pressure"
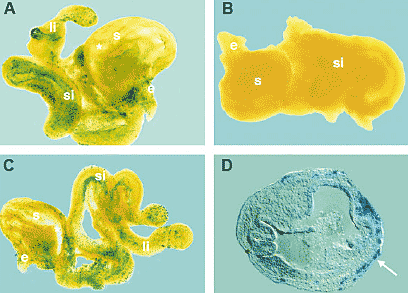 Fig. 2. RET+ cells from fetal gut can colonise wild-type or RET-deficient gut in organ culture. Immunoselected RET+ cells were injected into the stomach wall of E11.5 gut derived from +/Ret.k - (A) or Ret.k -/Ret.k - (C) mouse embryos. The site of injection into the
stomach wall is indicated by an asterisk. A non-injected control gut is shown in (B). Sections of X-gal-stained guts revealed that the в-gal+ progeny of the RET+ cells (arrow) were localised at the periphery of the gut wall (D). Abbreviations: e, esophagus; li, large intestine;
s, stomach; si, small intestine. Reproduced from Natarajan et al., (1999) Development 126, 157-168, with permission from The Company of Biologists Ltd.
Fig. 2. RET+ cells from fetal gut can colonise wild-type or RET-deficient gut in organ culture. Immunoselected RET+ cells were injected into the stomach wall of E11.5 gut derived from +/Ret.k - (A) or Ret.k -/Ret.k - (C) mouse embryos. The site of injection into the
stomach wall is indicated by an asterisk. A non-injected control gut is shown in (B). Sections of X-gal-stained guts revealed that the в-gal+ progeny of the RET+ cells (arrow) were localised at the periphery of the gut wall (D). Abbreviations: e, esophagus; li, large intestine;
s, stomach; si, small intestine. Reproduced from Natarajan et al., (1999) Development 126, 157-168, with permission from The Company of Biologists Ltd.
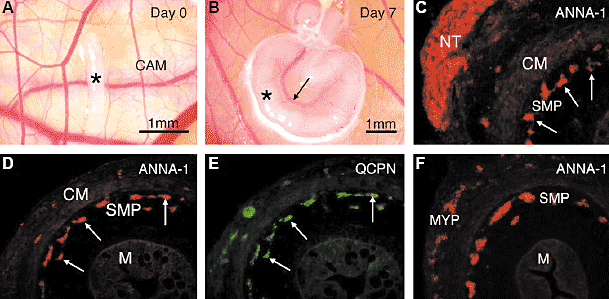 Fig. 3. Colonisation of aganglionic gut grown on the chick chorioallantoic membrane. (A) E6 chick hindgut (*) was placed on chick chorioallantoic
membrane (CAM), that had been lightly scraped to encourage growth of blood vessels. (B) After 7 days on the CAM, the gut (*) increased dramatically
in length and was supplied with a large blood vessel (arrow). (C) When quail neural tube (NT) and associated neural crest cells, was positioned adjacent to the aganglionic gut on the CAM and grown for 3 days, NCC from the neural tube migrated into the gut and became positioned in the submucosal plexus region (SMP, arrows), towards the inner aspect of the circular muscle layer (CM). (D,E) Cells within the sub-mucosal plexus that were immunopositive for the pan-neuronal marker ANNA-1 (D, arrows), were shown to be of quail origin using double labelling with the quail cell specific marker, QCPN (E, arrows). (F) After 5 days on the CAM, crest cells were present in the submucosal plexus (SMP) and myenteric plexus (MYP) regions. M, mucosa.
Fig. 3. Colonisation of aganglionic gut grown on the chick chorioallantoic membrane. (A) E6 chick hindgut (*) was placed on chick chorioallantoic
membrane (CAM), that had been lightly scraped to encourage growth of blood vessels. (B) After 7 days on the CAM, the gut (*) increased dramatically
in length and was supplied with a large blood vessel (arrow). (C) When quail neural tube (NT) and associated neural crest cells, was positioned adjacent to the aganglionic gut on the CAM and grown for 3 days, NCC from the neural tube migrated into the gut and became positioned in the submucosal plexus region (SMP, arrows), towards the inner aspect of the circular muscle layer (CM). (D,E) Cells within the sub-mucosal plexus that were immunopositive for the pan-neuronal marker ANNA-1 (D, arrows), were shown to be of quail origin using double labelling with the quail cell specific marker, QCPN (E, arrows). (F) After 5 days on the CAM, crest cells were present in the submucosal plexus (SMP) and myenteric plexus (MYP) regions. M, mucosa.
получены в работе Natarajan et al., (Natarajan et al., 1999). В этом исследовании, когда небольшие количества или даже одиночные RET+ vagal NCC
микроинъецировали в желудок aganglionic ЖКТ и затем выращивали в культуре, то индивидуальные усиленно мигрировали от места введения или ростро-каудально вдоль кишки или каудо-рострально в пищевод (Рис. 2). В таких случаях незначительное или отсутствие популяционного давления управляло движением клеток прочь др. от др., так что др. механизмы необходимы для объяснения их обширной миграции.
Безусловно межклеточные сигнальные механизмы играют жизненно важную роль в направлении миграции vagal NCC в и внутри кишки. Присутствие диффундирующих хемоаттактивных молекул, которые исходят от кишечной мезенхимы, было продемонстрировано и показана их важная роль в привлечении клеток нервного гребня. Эта идея была подтверждена обратными трансплантациями, описанными выше (Rothman et al., 1993) и экспериментами первоначально осуществленными Fontaine-Perus et al., (Fontaine-Perus et al., 1988) и позднее Burns and Cooper (unpublished), используя сенсорные (nodose) ганглии, трансплантированные в ранних эмбрионов или vagal нейральный гребень, культивируемый рядом с aganglionic сегментами кишки, соотв. В последних работах, когда сенсорные ганглии или vagal часть нервной трубки эмбриона перепела помещалась рядом с сегментами aganglionic кишки эмбрионов кур и затем культивировалась или выращивалась на хориоалантоисной мембране кур, то NCC мигрировали в кишку и первоначально располагались внутри презумптивного подслизистого сплетения прежде чем колонизировать myenteric сплетение (Рис. 3). Эти исследования предоставили строгие доказательства существования хемоаттрактивных взаимодействий между кишкой и NCC, т.к. клетки нервного гребня, происходящие или из nodose ganglia или vagal части нервной трубки, если воспринимали сигнал(ы), исходящие из aganglionic кишки, то мигрировали и дифференцировались в клетки ENS. Какова же природа сигнальных взаимодействий, которые управляют этими миграторными процессами? Наиболее вероятным кандидатом является сигнальный путь RET/GFRα/GDNF. Используя органную культуру кишки и экспланты, растущие на коллагеновом геле, Young et al. (Young et al., 2001) продемонстрировали, что GDNF, лиганд для RET/GFRα рецепторного комплекса, является хемоаттрактантом для энтерических нейральных клеток, который обеспечивает выросты аксонов и направленную миграцию vagal NCC вдоль кишки. Хотя механизмы, с помощью которых GDNF влияет на ростро-каудальную миграцию NCC неясны, но Young et al., полагают, что уровень белка GDNF д.б. более высоким в более каудальных, не колонизованных областях, что д. действовать как GDNF "sinks". NCC д. привлекаться в направлении этих областей с более высокими уровнями GDNF, зависимым от градиента способом. Дальнейшее подтверждение этой идеи получено Natarajan et al., (Natarajan et al., 2002). Эти авт. выявили взаимодействие между NCCи GDNF, они обнаружили, что клетки нервного гребня внутри тонкого кишечника плодов мышей мигрируют в направлении экзогенного источника GDNF RET-зависимым образом. Они также показали, что GDNF экспрессируется на высоких уровнях в областях кишки, что предваряет фронт миграции vagal NCC. Когда vagal клетки колонизируют переднюю кишку, то экспрессия GDNF высокая в желудке и едва присутствует в средней кишке, экспрессия GDNF значительно усиливается в каудально расположенной слепой кишке, что хорошо согласуется с теорией действия GDNF в качестве центра хемоаттрактанта для мигрирующих NCC. Однако, последующее усиление экспрессии GDNF в задней кишке, пред фронтом мигрирующих NCC, не выявлено, так что вполне возможно, что механизмы, управляющие колонизацией задней кишки отличны от действующих в передней и средней кишке.
Помимо своей хемоаттрактантной роли для развития ENS, GDNF , как сообщалось, необходим также для пролиферации и жизнеспособности предшественников ENS (Chalazonitis et al., 1998, Hearn et al., 1998, Heuckeroth et al., 1998), процесс, который может модулироваться с помощью
endothelin-3 (EDN3), который, как было показано, ингибирует дифференцировку мигрирующих NCC (Hearn et al., 1998); (Wu et al., 1999). Такое ингибирование дифференцировки клеток нервного гребня может гарантировать, что необходимое количество предшественников ENS сможет полностью колонизировать кишку. Спонтанные или специально полученные мутации EDN3 (Baynash et al., 1994, Bolande, 1975, Jacobs-Cohen et al., 1987), вызывали неспособность к колонизации дистальных частей задней кишки с помощью NCC , которая оставалась лишенной ганглиев (aganglionic), что подтверждает предположение, что в отсутствие EDN3 энтерические предшественники дифференцируются преждевременно и неспособны колонизировать кишку по всей длине.
Сайт создан в системе
uCoz Fig. 1. Sections through chick hosts
which received grafts of quail dorsal
neural tubes and then were fixed 48 h
later (at stage 22/23). Quail cells are
identified with the QCPN antibody and
appear black in these sections. (A,A')
Neural crest cells derived from a sacrallevel
neural tube were grafted to the
thoracic level. The boxed area shown at
higher magnification in (A') reveals that
the cells migrate no farther than just ventral
to the dorsal aorta. (B,B') Similarly when
thoracic-level neural crest cells are grafted
to the thoracic level of a chick host, the
grafted cells go no farther than the lateral
edge of the dorsal aorta. In both instances,
the grafted cells are coincident with the
host neural crest cells. (C,C') However,
thoracic-level quail neural crest cells do
reach the gut mesenchyme if they are
grafted to the sacral level. Reprinted from
Dev. Biol., Vol 219, No 1, Erickson and
Goins, "Sacral neural crest cell migration
to the gut is dependent upon the migratory
environment and not cell-autonomous
migratory properties", pages 79-97,
Copyright (2000), with permission from
Elsevier.
Fig. 1. Sections through chick hosts
which received grafts of quail dorsal
neural tubes and then were fixed 48 h
later (at stage 22/23). Quail cells are
identified with the QCPN antibody and
appear black in these sections. (A,A')
Neural crest cells derived from a sacrallevel
neural tube were grafted to the
thoracic level. The boxed area shown at
higher magnification in (A') reveals that
the cells migrate no farther than just ventral
to the dorsal aorta. (B,B') Similarly when
thoracic-level neural crest cells are grafted
to the thoracic level of a chick host, the
grafted cells go no farther than the lateral
edge of the dorsal aorta. In both instances,
the grafted cells are coincident with the
host neural crest cells. (C,C') However,
thoracic-level quail neural crest cells do
reach the gut mesenchyme if they are
grafted to the sacral level. Reprinted from
Dev. Biol., Vol 219, No 1, Erickson and
Goins, "Sacral neural crest cell migration
to the gut is dependent upon the migratory
environment and not cell-autonomous
migratory properties", pages 79-97,
Copyright (2000), with permission from
Elsevier.  Fig. 2. RET+ cells from fetal gut can colonise wild-type or RET-deficient gut in organ culture. Immunoselected RET+ cells were injected into the stomach wall of E11.5 gut derived from +/Ret.k - (A) or Ret.k -/Ret.k - (C) mouse embryos. The site of injection into the
stomach wall is indicated by an asterisk. A non-injected control gut is shown in (B). Sections of X-gal-stained guts revealed that the в-gal+ progeny of the RET+ cells (arrow) were localised at the periphery of the gut wall (D). Abbreviations: e, esophagus; li, large intestine;
s, stomach; si, small intestine. Reproduced from Natarajan et al., (1999) Development 126, 157-168, with permission from The Company of Biologists Ltd.
Fig. 2. RET+ cells from fetal gut can colonise wild-type or RET-deficient gut in organ culture. Immunoselected RET+ cells were injected into the stomach wall of E11.5 gut derived from +/Ret.k - (A) or Ret.k -/Ret.k - (C) mouse embryos. The site of injection into the
stomach wall is indicated by an asterisk. A non-injected control gut is shown in (B). Sections of X-gal-stained guts revealed that the в-gal+ progeny of the RET+ cells (arrow) were localised at the periphery of the gut wall (D). Abbreviations: e, esophagus; li, large intestine;
s, stomach; si, small intestine. Reproduced from Natarajan et al., (1999) Development 126, 157-168, with permission from The Company of Biologists Ltd. 