Скоординированная генерация различных типов клеток и их организация в функциональные структуры являются ключевыми процессами во время морфогенеза тканей. В сердечно-сосудистой системе эндотелиальные клетки (ЕС), которые формируют внутреннюю выстилку кровеносных сосудов, рекрутируют разные типы муральных клеток, чтобы сформировать стабильные и функциональные структуры. Перициты, которые обладают общей базальной ламиной с эндотелием, выпускают многочисленные клеточные отростки, которые находятся в непосредственном контакте с ЕС . Это взаимодействие ведет к неподвижному фенотипу васкулатуры (т.е. образование новых эндотелиальных отрастаний супрессировано) и предупреждает протекание через стенку сосудов путем снижения проницаемости эндотелиального монослоя. Перициты направляются ко вновь формируемым сосудистым структурам, капиллярам и посткапиллярным венулам. Более крупные сосуды покрываются сосудистыми гладкомышечными клетками (vSMCs), которые прикрепляются в виде одиночного или множественных слоёв к наружной (abluminal) стороне эндотелиальной базальной ламины. vSMCs продуцируют внеклеточный матрикс и эластичные волокна, которые обеспечивают сосудам необходимой структурной стабильностью и эластичностью. Оба типа муральных клеток связаны с патологией у людей: потеря перицитовых покровов в сетчатке диабетических пациентов ведет к увеличению сосудистой проницаемости, аберрантному разрастанию эндотелия и в конечном итоге к слепоте (Betsholtz et al., 2005). Повреждения в гладкомышечном слое клеток и аномальная миграция vSMCs может блокировать кровоток благодаря артериосклерозу артерий (Faxon et al., 2004). Молекулярные механизмы, обеспечивающие взаимодействие между эндотелиальными и муральными клетками изучены недостаточно, но ранние работы показали важность transforming growth factor β, aphingosine 1-phosphate, angiopoiethin-1, platelet-derived growth factor B (PDGF-B) и и их соотв. рецепторов в этом процессе (Betsholtz et al., 2005; Jain, 2003).
Eph receptor tyrosine kinases (RTKs) и их ephrin лиганды. закрепленные на клеточной поверхности являются разносторонними регуляторами тканевого морфогенеза и образования кровеносных сосудов. Ephrin-B2, трансмембранный белок с коротким цитоплазматическим хвостом преимущественно экспрессируется на артериальных ЕС у некоторых видов позвоночных, тогда как один из его партнеров по связыванию, рецептора EphB4 в основном связан с венами. эксперименты по генному таргетингу у мышей показали, что ephrin-B2 (кодируемый геном Efnb2) и EphB4 (Ephb4) одинаково важны для ангиогенного ре-моделирования кровеносных сосудов у ранних эмбрионов, это указывает на то, что они обеспечивают сосудистый морфогенез посредством реципрокных взаимодействий и двунаправленной передачи сигналов. Летальность этих глобальных нокаутов, по-видимому, указывает на важную функцию в эндотелии, т.к. ЕС-специфическая инактивация Efnb2 несовместима с эмбриональным ангиогенезом и жизнеспособностью после середины беременности (Gerety, Anderson, 2002). Однако, ephrin-B2 экспрессируется также в ряде др. типов клеток и тканей, таких как PCs и vSMCs (Galr et al., 2001; Shin et al., 2001), но ранняя летальность имеющихся модельных мутантных мышей ограничивает исследования in vivo. Поэтому мы разработали подход условного генного таргетинга (Cre-loxP), чтобы избирательно прерывать экспрессию лиганда в перицитах и vSMCs.
Discussion
Сосудистый морфогенез связан с генерацией эндотелиальных и муральных клеток, их миграции в соотв. место и, наконец, их сборки в функциональные структуры. Здесь было установлено, что ephrin-B2, лиганд, закрепленный на клеточной поверхности для Eph RTKs, является критическим регулятором миграции муральных клеток, распластывания и адгезии во время сборки стенки кровеносных сосудов. Неожиданно, дефекты, вызываемые дефицитом ephrin-B2, показали, что лиганд обладает клеточно-автономной и зависящей от межклеточных контактов функциями, обе из которых м.б. необходимы для морфогенеза нормальной ткани.
Blood-Vessel-Wall Assembly
Фенотип
Efnb2ΔPC/vSMC суммируется как неспособность муральных клеток инкорпорироваться в стенку кровеносных сосудов: ephrin-B2-дефицитные перициты оказываются неспособными контактировать с ECs, неспособны покрывать эндотелиальный монослой и остаются слабо прикрепленными. Мутантные vSMCs также плохо прикреплены, покрывают лишь небольшого диаметра кровеносные сосуды прерывистым образом и эктопически оккупируют лимфатические капилляры в коже. Хотя неясно, все ли эти аномалии распределения клеток являются исключительно прерогативой vSMCs - ранее было показано, что отсоединенные перициты экспрессируют α-SMA (Morikawa et al., 2002) - дефекты у
Efnb2ΔPC/vSMC мышей не ограничиваются каким-либо одним из двух субклассов муральных клеток. Это важно, т.к. перициты и vSMCs ассоциируют с кровеносными сосоудами принципиально разными способами: перициты устанавливают непосредственные контакты с ECs, тогда как vSMCs ассоциируют с abluminal стороной базальной мембраны. Мы предполагаем, что ephrin-B2 контролирует взаимодействия между муральными клетками, а также меду перицитами и эндотелием (Рис. 7А). Эти
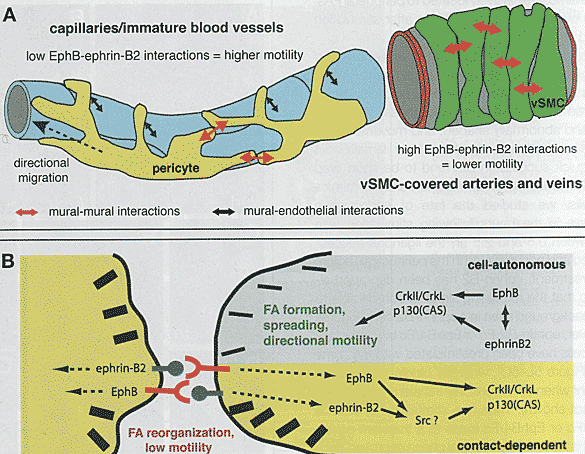 Fig.7. Regulation of Vessel-Wall Assembly, Cell Motility, and Adhesion by Ephrin-B2. (A) Model showing possible sites of EphB-ephrin-B2 interactions between endothelial cells and pericytes (in microvessels, black arrows) as well as between adjacent mural cells (in both small- and large-caliber vessels, red arrows). Ephrin-B2 might control directional migration of PCs and the stabilization of mural-cell coating on maturing blood vessels. (B) EphB-ephrin-B2 interactions between adjacent cells lead to reduced cell motility and the reorganozation of focal adhesions. A cell-autonomous function of ephrin-B2 (possible through interactions with coexpressed EphB КЕЛы) is required for new FA formation at front end of migrating cells, diractional migration, and spreading. Our date indicate an involvement of Скл-p130(CAS) signalling complex in these processes.
Fig.7. Regulation of Vessel-Wall Assembly, Cell Motility, and Adhesion by Ephrin-B2. (A) Model showing possible sites of EphB-ephrin-B2 interactions between endothelial cells and pericytes (in microvessels, black arrows) as well as between adjacent mural cells (in both small- and large-caliber vessels, red arrows). Ephrin-B2 might control directional migration of PCs and the stabilization of mural-cell coating on maturing blood vessels. (B) EphB-ephrin-B2 interactions between adjacent cells lead to reduced cell motility and the reorganozation of focal adhesions. A cell-autonomous function of ephrin-B2 (possible through interactions with coexpressed EphB КЕЛы) is required for new FA formation at front end of migrating cells, diractional migration, and spreading. Our date indicate an involvement of Скл-p130(CAS) signalling complex in these processes.
взаимодействия м. редуцировать миграцию PCs/vSMCs и гарантируют, что они покроют созревающие cосуды адекватно и стабильно. Паттерны экспрессии относящихся к делу игроков
in vivo соответствуют такой роли: RT-PCR только что изолированных Pdgfeb-Cre-позитивных муральных клеток подтверждают экспрессию некоторых EphB рецепторов. Экспрессия репортера Efnb2-lacZ сравнительно низка и гетерогенна в микрососудистом ложе, но увеличивается с диаметром сосудов и м. выглядеть более крепкой на крупных артериях. EphB2, выявляемый с помощью Ephb2-lacZ knockin репортера, также присутствует в муральных клетках, покрывающих крупные сосуды (в основном артерии) в ряде тканей. Иммуногистохимические данные показывают. что муральные клетки сходным образом экспрессируют рецептор EphB3 иерархическим способом. Т.о., экспрессия мурального ephrin-B2 и EphB RTK коррелирует с созреванием кровеносных сосудов, а фенотип мутантов
Efnb2 м. отражать их роль в этом процессе.
Др. аспектом Efnb2ΔPC/vSMC фенотипа является то, что он почти исключительно затрагивает архитектуру микрососудов, тогда как крупного калибра кровеносные сосуды обнаруживают лишь минимальные дефекты. Это м. отражать более высокую чувствительность сравнительно недавно сформированных и, следовательно, менее зрелых микрососудов, сходные наблюдения и у Pdgfb мутантов. Удивительно, но Efnb2ΔPC/vSMC мыши имеют и др. признаки, общие с мутантами пути PDGF-B/PDGFRβ нарушения затрагивают сходные ткани (т.е., кожу, почки, кишечник), а рыхлое прикрепление дефицитных по ephrin-B2 перицитов фенокопирует дефекты мутантных мышей, экспрессирующих укороченную ( и более диффузную) форму PDGF-B (Lindblom et al., 2003). Неправильная экспрессия PDGF-B лимфатическими сосудами ведет к аномальному рекрутированию vSMCs у мышей, лишенных forkhead транскрипционного фактора FoxC2 и связана с болезнью у человека lymphedema distichiasis (Petrova et al., 2004). Efnb2 и Pdgfrb мутанты обнаруживают эктопическое покрытие vSMCs лимфатических капилляров, указывающее на то. что оба пути предоставляют важные сигналы, ведущие муральные клетки к соответствующим мишеням.
Role of Ephrin-B2 in Cell Spreading, Adhesion, and Migration
Анализ культивируемых SMCs показал, что Ephrin-B2 контролирует образование фокальных адгезий, клеточную слипчивость, распластывание (spreading) и направленную миграцию (Рис. 7В). Какова природа связи между молекулами Eph/ephrin и этими клеточными процессами? Сначала предполагалось, что взаимодействия Eph-ephrin модулируют обусловленную интегринами адгезию и клеточную миграцию посредством FAK или Src киназ, адапторных молекул Crk и р130 (CAS) и GTPases Rho-семейства. Наши данные выявили точку в комплексах Crk адапторных белков и p130(CAS), которая способствует клеточной подвижности, spreading и росту ламмелиподиальных выростов (Chodniewicz, Klemke, 2004). Crk-p130(CAS) ассоциация повышена в Δephrin-B2 SMCs, это согласуется с повышенной подвижностью и быстрым выпусканием отростков, в то время как фосфорилирование тирозиновых остатков на участке из 15 SH2 domen-docking мотива p130(CAS) снижено. Эти две находки м. показаться противоречащими - но только фосфорилированный CAS м. связываться с Crk - известен также небольшой субнабор SH2 связывающих сайтов, важных для ассоциации Crk и миграции эмбриональных фибробластов мышей (Shin et al., 2004). Тем не менее, т.к. степень фосфорилирования тирозина p130(CAS) позитивно скореллирована со связывающей способностью, то комплекс с Crk белками м.б. менее стабильным и, следовательно, жить короче в отсутствие ephrin-B2. Наши результаты также показывают, что распределение и/или фосфорилирование белков семейства Crk м. регулироваться посредством EphB/ephrin-B2 молекул, напр., стимулированные клетки обнаруживают накопление фосфо-CrkL/Crkll в кластерах интернализованных ephrin-B2/Fc (т.е. связанных Eph рецепторов) а также в периферических локальных адгезиях.
Суммирование наших результатов показывает, что передача сигналов Crk-p130(CAS) является ключевым путем, стоящим ниже EphB/ephrin-B2 молекул (Рис. 7В), однако это не исключает участия и др. молекулярных игроков.
Cell-Autonomus Function of Ephrin-B2
Одной из наиболее неожиданных находок явилась аномальная морфология и подвижность Δephrin-B2 клеток в отсутствие межклеточных взаимодействий. Возникает вопрос. как лиганд м. действовать клеточно-автономным способом. В процессе, базирующемся на передаче сигналов независимо от рецепторов или в результате взаимодействия с рецепторами в той же самой клетке? Наши наблюдения, что долговременная стимуляция клеток с EphB4/Fc или с ephrin-B2/Fc слитым белком ведет к истощению соотв. партнеров по связыванию (преимущественно благодаря интернализации и деградации сигнальных комплексов), указывая, что манипуляции с EphB RTKs v/ приводить к клеточным дефектам сходным с потерей/деплецией ephrin-B2. Следовательно, м.б. некоторый уровень Eph-ephrin сигнальных событий в отсутсвие контакта с др. клетками. Такие рецептор--лиганд взаимодействия в цис подтверждаются предыдущими сообщениями, показавшими ко-экспрессию EphA/ephrin-A молекул в одной и той же клетке, которая м. приводить маскировке связывающих сайтов, необходимых для взаимодействия в транс (Ншт уе al., 2004). Напротив. Marquart et al., (2005) недавно предположили. что EphAs и ephrin-As функционируют независимо в самостоятельных мембранных доменах. Пока нет доказательств компартментализации ephrin-B2 и EphB RTKs в плазматической мембране или маскирования с помощью взаимодействий в цис. Однако возможно, что молекулы м. взаимодействовать в транс внутри одной и той же клетки - напр., в мембранных ruffles, аппарате Гольджи или в эндоцитотических компартментах. Независимо от точного механизма аномалии, наблюдаемые в изолированных Δephrin-B2 клетках, по-видимому, совместимы с ролью в клеточно автономной передаче сигналов, которое маскирует EphB рецепторы. Однако, последние всё ещё м. участвовать в межклеточных контактах, таких как взаимодействия между перицитами и ephrin-B2-экспрессирующими ECs или между соседними муральными клетками (Рис. 7В).
Implication for Ephrin in Disease
Некоторые из наших результатов намекают на возможное участие ephrin-B2 в процессах болезни. (1)Неправильное покрытие муральными клетками и нарушения интегральности сосудов у Efnb2ΔPC/vSMC мышей воспроизводит некоторые аспекты потери перицитов в сетчатке диабетических пациентов, что ведет к раздуванию капилляров (микроаневризмы), высокой сосудистой проницаемости, эктопическому врастанию кровеносных сосудов и слепоте (Betsholtz et al., 2005). (2) Опухолевые кровеносные сосуды часто дизорганизованы, текучие и слабо функциональны. Эти дефекты м.б. обусловлены плохой ассоциацией перицитов (Morikawa et al., 2002)? сходной с дефектами у мутантов Efnb2ΔPC/vSMC. (3) Нарушенная экспрессия Eph рецепторов и ephrins также связана с инвазией и злокачественностью раковых клеток (Brantley-Sieders et al., 2004) и м. влиять на подвижность опухолевых клеток, инвазию и метастазирование.
Сайт создан в системе
uCoz 