AGM является областью эмбриона, которая представляет аорту, генитальный гребень и мезонефросы. Аорта происходит из спланхноплевры, тогда как два последних рудимента возникают из параксиальной мезодермы, между сомитами и полостью целома. Т.к. AGM мышей обычно рассматривается как территория, где возникают внутри-эмбриональные HSCs originate, поэтому мы подразделили AGM человека на три главных компартмента, которые в отдельности изучали в культуре. Бесспорно было показано, что внутри эмбриона человека, только аорта обладает гемангопоэтической способностью. Рудименты гонад и почек во всех случаях были лишены какого-либо обнаружимого кровь-формирующего потенциала (Tavian et al.,
2001). Затем мы исследовали локальное происхождение внутри вентральной части стенки туловищных артерий возникающие гематопоэтические стволовые клетки.
Мезодерма желточного мешка, по-видимому, дифференцируется одновременно в сосудистые и гематопоэтические структуры. Так, первые распознаваемые кровяные клетки - или морфологически или по молекулярным маркерам - в желточном мешке всегда организованы в кластеры (или кровяные островки), которые тесно прилипают к возникшим или вновь образующимся эндотелиальным клеткам (Murray, 1932, Sabin, 1920). Ещё более наглядны, чем в желточном мешке, внутри-эмбриональные кластеры HSCs, всегда появляющиеся в тесной физической ассоциации с дифференцированным вентральным эндотелием кровеносных сосудов туловища. Эти наблюдения послужили основой для гипотезы, что эндотелиальные клетки сами по себе являются источником эмбриональных кровяных клеток, что предполагалось уже довольно давно в отношении гематопоэза в желточном мешке (Sabin,
1920). Предполагалась ре-дифференцировка уже организованного слоя эндотелиальных клеток, событие, которое и в самом деле было недавно подтверждено в месте внутри-эмбрионального гематопоэза у эмбрионов мышей и птиц (Jaffredo et al., 1998; Nishikawa et al.,
1998; de Bruijn et al., 2002 and for review see Dzierzak, 2003).
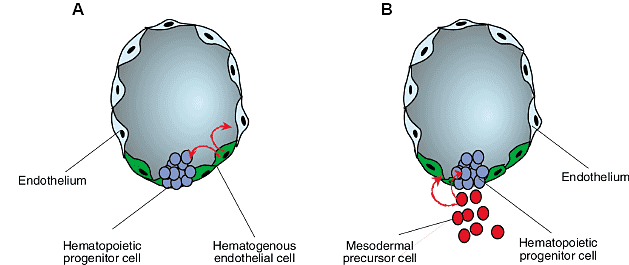 Fig. 5. Models of hematopoietic stem cell emergence within the human embryo. (A) Re-differentiation model. Beginning at 27 days of development,
pre-existing endothelial cells (green) in the ventral aspect of human intra-embryonic arteries differentiate locally into blood cell progenitors (blue). (B) Migration model. From 27 days of gestation, scattered mesodermal CD34-CD45- cell precursors (red) colonize the ventral vascular wall and give rise to (blood-forming?) endothelial cells (green) and hematopoietic cell clusters (blue).
Fig. 5. Models of hematopoietic stem cell emergence within the human embryo. (A) Re-differentiation model. Beginning at 27 days of development,
pre-existing endothelial cells (green) in the ventral aspect of human intra-embryonic arteries differentiate locally into blood cell progenitors (blue). (B) Migration model. From 27 days of gestation, scattered mesodermal CD34-CD45- cell precursors (red) colonize the ventral vascular wall and give rise to (blood-forming?) endothelial cells (green) and hematopoietic cell clusters (blue).
Чтобы проверить эту возможность. мы сначала сортировали с помощью жидкостной цитометрии сосудистые эндотелиальные клетки от эмбриональных и плодных кровь-формирующих тканей человека. За исключением CD45, большинство поверхностных маркеров, экспрессируемых гематопоэтическими клетками (CD31, CD34 и KDR/flk-1), присутствовало также и в эндотелиальных клетках на этих ранних стадиях. Надежной комбинацией маркеров при типировании эндотелиальных клеток оказалась экспрессия на поверхности CD34 или CD31 и отсутствие CD45, это указывало на предетерминацию в отношении гематопоэза. CD34+CD45- отсортированные клетки были лишены CD45+ загрязняющих гематопоэтических клеток и не давали колоний кровнях клеток при посеве в methyl-cellulose подходе. Затем, эндотелиальные клетки, происходящие из желчтоного мешка и области AGM (27-40 день) дифференцировались в гематопоэтические клетки, если культивировались в присутствие MS-5 стромальных клеток (Oberlin et al., 2002). Частота hematogenous эндотелиальных клеток в этих органах, на данной стадии онтогенеза, непосредственно коррелировала с гематопоэтической активностью ткани, из которой они были выделены. В желточном мешке, где гематопоэз начинается примерно на 16-й день развития, частота эндотелиальных кровь-формирующих клеток была наивысшей на 19-й день, самая ранняя стадия изученная в этом исследовании, затем снижалась быстро параллельно со снижением вителлинового гематопоэза. В целом туловище эмбриона частота способных к гематопоэзу эндотелиальных клеток составляла примерно 1/100 на 27-й день, затем HSCs возникали из дна аорты. Не выявлено гематопоэтической активности в культурах эндотелиальных клеток, отсортированных из области AGM после 40-го дня, когда HSCs больше не присутствуют в просвете аорты. Эти эксперименты указывают на то, что предсуществующие эндотелиальные клетки в желточном мешке и во внутри-эмбриональных артериях человека делятся и дифференцируются локально в предшественники кровяных клеток в месте возникновения примитивного и дефинитивного гематпоэза (Oberlin et al., 2002).
Conclusion: the ultimate human blood-forming cell
Главным выводом является то, что мультипотентные гематопоэтические стволовые клетки возникают в эмбриональных артериях человека автономно от первичного вителлиновго гематопоэза посредством промежуточных сосудистых эндотелиальных клеток. Способность к гематопоэзу, по-видимому, приобретается вторично энтодермальными клетками аорты. С 24 по 26 день развития, когда область AGM оказывается гемогенной in vitro, но до появления кластеров HSC в аорте, эксперименты по клеточной сортировке и культуре показали, что кровь-формирующий потенциал в AGM принадлежит CD34-негативной, т.e. фракции не-эндотелиальных клеток (MT et al., unpublished observations). Это указывает на то, что или эндотелиальные клетки вентральной части аорты внезапно переключаются на гематопоэз на 27-й день или что, более примитивные CD34- angio-hematopoietic предшественники мигрируют через пери-аортальную мезенхиму и колонизируют дно аорты на этой стадии. Некоторые наблюдения подтверждают, что последнее предполоежение верное. Так, экспрессия Flk-1 или VEGF-R2 в ранних эмбрионах человека, которая показывает, что популяция Flk-1+CD34- клеток мигрирует из спланхноплевры в субаортальную мезодерму в течение 4-й недели развития (Cortes et al., 1999). Более недавно поверхностный белок, названный BB9, экспрессируемый во взрослом костном мозге HSCs и субнабором стромальных клеток (Ramshaw et al., 2001), был обнаружен в родственной популяции клеток, колонизирующих аорту у 4-недельных эмбрионов человека. Важно, что экспрессия BB9 затем обнаруживалась на поверхности как эндотелиальных клеток, таки и ассоциированных с ними HSCs в вентральной части аорты (Jokubaitis et al., submitted). Следовательно, BB9 может представлять собой первый маркер ангиогематопоэтических клеток или гемангиобластов. Мы полагаем, что гемангиобласты или даже более примитивные мезодермальные стволовые клетки, мигрируя из пара-аортальной спланхноплевры, дают в дне эмбриональной аорты кровь-формирующие эндотелиальные клетки и те в свою очередь гематопоэтические стволовые клетки (Fig. 5B). Такие каскады дифференцировки, как полагают, ограничены эмбриональными и ранними плодными стадиями развития. Открываются интересные перспективы. В самом деле, мультипотентные стволовые клетки, функционирующие в том числе и для гематопоэза, как полагают, существуют во взрослых тканях, среди которых костный мозг. Получены предварительные указания, что небольшая фракция сосудистых эндотелиальных клеток , отсортированная из полости взрослого костного мозга, может давать гематопоэтические клетки в культуре (Souyri et al., unpublished results)
а гемангиобласты были объявлены как существующие у взрослых людей (Pelosi et al., 2002). Было бы интересно посмотреть, применим ли родоначальный механизм, с помощью которого гематопоэтически клетки продуцируются из стенки эмбриональных кровяных сосудов к появлению их во взрослой жизни.
Сайт создан в системе
uCoz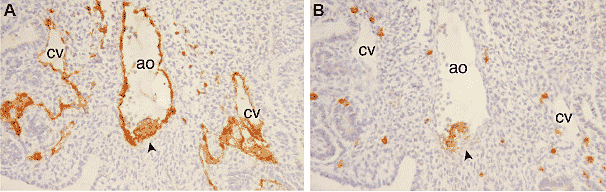
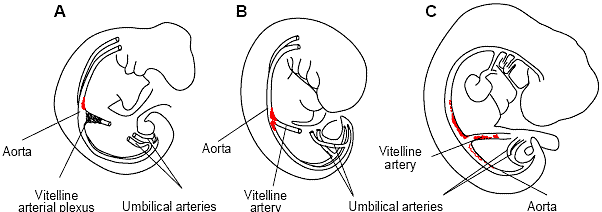
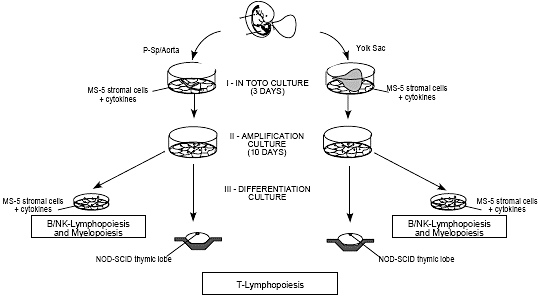 Fig. 3. Scheme of in vitro assays used to detect myeloid-, NK-, B- and T-cell potentialities in the early human embryo.
Fig. 3. Scheme of in vitro assays used to detect myeloid-, NK-, B- and T-cell potentialities in the early human embryo. 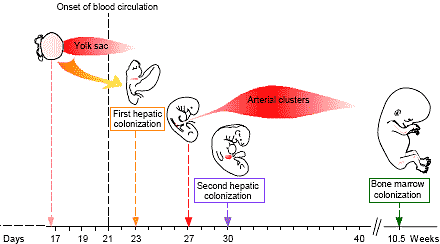 Fig. 4. Chronology of appearance of hematopoietic stem cells in the developing human embryo.
Fig. 4. Chronology of appearance of hematopoietic stem cells in the developing human embryo. 