Известно как возникают стволовые клетки крови и каковы их взаимотношения с эндотелиальной сетью в результате исследований гетероспецифических моделей перепел, курица (Le Douarin, 1969). Эта модель впервые была применена для изучения T lymphopoiesis. Во время онтогенеза происходят экстенсивные миграции клеток в гематопоэтической системе как было показано в пионерской работе Moore and Owen (rev. Metcalf and Moore, 1971). В 1965 эти авт. начали изучать формирование крови у эмбрионов, несколько лет спустя появилась современная гематология, разработанная для взрослых систем. Till and McCulloch (1961) показали, что гематопоэтическая система облученных мышей может быть восстановлена внутривенными инъекциями клеток костного мозга от здоровых мышей. Этот эксперимент открыл существование плюрипотентных, само-обновляющихся hematopoietic stem cells (HSC). Эти клетки, которые давали колонии, in vivo и in vitro, были способны мигрировать и заселять различные микроусловия, в которых они получали инструкции для вступления на специфические пути дифференцировки.
Чтобы исследовать, как кровеносная система формируется во время развития, Moore and Owen избрали куриные эмбрионы, уже служившие субъектами для многочисленных описательных исследований с конца XIXth
века, так как непосредственно видно после образования окошечка в скорлупе развитие, независимое от материнского кровоснабжения. Они разработали ряд экспериментальных подходов: облучение, восстановление, парабиоз, трансплантации рудиментов (thymus, spleen, bursa of Fabricius) на хорионаллантоисную мембрану (rev. Metcalf and Moore, 1971). Чтобы отслеживать происхождение клеток в этих разных подходах,
Moore and Owen использовали пару половых хромосом в качестве клеточных маркеров. Несмотря на некоторые недостатки наследования этой системы мечения (хромосомы могут наблюдаться только в 5-10% клеток, арестованных на стадии метафазы митозов после воздействия colcemid, которое вызывало высокую смертность эмбрионов; кроме того адекватные комбинации противоположных полов снижали шансы) эти исследователи открыли важное свойство, которое характеризует развитие кровеносной системы : Hematopoietic Stem Cells (HSC) колонизируют все рудименты за исключением желточного мешка. Они также трансплантировали рудименты эмбрионов мышей на хориоаллантоис и наблюдали, что в противоположность способности к клеточному тип-специфическому распознаванию, имеющейся у большинства др. эмбриональных типов клеток разных классов позвоночных, привлечение или распознавание не работает между мышиными стромальными рудиментами и куриными HSC. Выделенные на ранней стадии и трансплантированные на хориоаллантоис, мышиный рудимент тимуса оставался нелимфоидным (alymphoid),
что позволило Moore and Owen заключить в 1970, что онтогенетический гематопоэз у млекоптиающих такой же, HSC возникают в одном месте, а дифференцируются др. (rev. Metcalf and Moore, 1971). Система мечения quail/chicken, использованная для развития тимуса и сумки Fabricius, оказалась пригодной для разных схем трансплантаций, чтобы идентифицировать происхождение каждой одиночной клетки в ранних рудиментах (rev. Le Douarin et al., 1984). Эндомезодермальный рудимент тимуса, как было установлено, колонизируется путём циклических волн HSC в соответствии с точно выполняемым текущим временным расписанием. Мезодерма, особенно не-эндотелиальные клетки стенок кровеносных сосудов, как было установлено, происходят из нервного гребня (т.е. эктомезенхимы)
(rev. Etchevers et al., 2001), тогда как эндотелиальные клетки, в области головы и шеи продуцируются за счёт драматического умножения небольших количеств цефалической параксиальной мезодермы (Couly et al., 1995). Время, когда начинается колонизация тимуса мышей было установлено путем ассоциации культивируемого раннего рудимента с
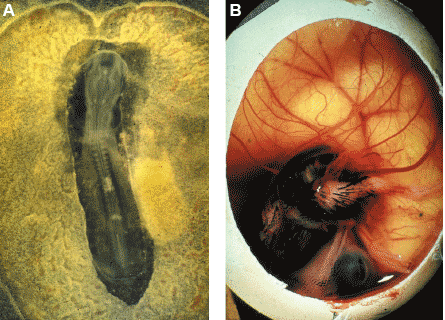 Fig. 1. The yolk sac chimera. (A) Surgical construction of the chimera at E2. The suture
line is visible between the quail embryonic body (neural tube and somites) and the chick
extra-embryonic area. (B) Quail embryo growing with a chick yolk sac 12 days after the
operation.
Fig. 1. The yolk sac chimera. (A) Surgical construction of the chimera at E2. The suture
line is visible between the quail embryonic body (neural tube and somites) and the chick
extra-embryonic area. (B) Quail embryo growing with a chick yolk sac 12 days after the
operation.
HSC органа донора (печенью плода) (rev. Dieterlen-Liиvre and Le
Douarin, 1984). Последовательные волны колонизации были открыты в тимусе мышей, но из-за перекрывания этих волн, циклы развития (cycling) выражены менее чётко (Jotereau et al., 1987). В конечном счёте модель перепел-курица предоставляла такие экспериментальные возможности, что были открыты различные Области, позволяющие в частности пересмотреть заново проблему возникновения HSC. Эта проблема была решена благодаря использованию моноклональных антител MB1/QH1 (Peault et al.,
1983; Pardanaud et al., 1989), которые распознают гематопоэтические и эндотелиальные клетки перепела, но не кур. Открытые закономерности позднее были распространены на млекопитающих. В данном томе Jaffredo et al., 2005; Pudlewski and Pardanaud, 2005 and Godin and Cumano, 2005 подробно рассматривают находки моей группы о детерминации HSC и об их онтогенетических взаимоотношениях с эндотелиальной сетью у эмбрионов птиц и мышей. Здесь я остановлюсь на истории этих исследований в перспективе, останавливаясь более подробно на вопросах, которые в этих статьях не были обсуждены и опишу новые данные о гематопоэтическом гематопоэзе у эмбрионов мышей. Эти данные базируются на гипотезе, вытекающей из наших недавних находок на эмбрионах птиц, согласно которым аллантоис является является до сих пор не распознанным местом продукции HSC и ангиобластов.
Origin of HSC: contributions of the quail/chicken model
Когда Moore and Owen (1967) предположили, что HSC д. становиться детерминированными в ранней мезодерме желточного мешка в раннем развитии однажды и на всю жизнь индивида, то эта идея была с энтузиазмом поддержана гематолагами и иммунологами. В 1975 я использовал для решения этой проблемы хирургическую технику, предложенную Claude Martin (1972), в которой эмбрионные тела перепела трансплантировали в желточные мешки кур до начала регулярных сердцебиений и циркуляции кровяных клеток. В таких химерах (рис. 1), клетки, относящиеся к кровяному ростку, в тимусе, селезенке, сумке и костном мозге все были куриными, тогда как стромальные клетки были от перепела (Dieterlen-Liиvre, 1975; Martin et al., 1978). Циркулирующие кровяные клетки были куриными (происходящими из предшественников в желточном мешке) вплоть до 5-го дня инкубации, затем становились смешанными, всё более богатые перепелиными эритроцитами с возрастом (Beaupain et al., 1979). Эти результаты были подтверждены на химерах, полученными между конгенными линиями кур, отличающихся или по аллотипам иммуноглобулина или по своим major histocompatibility antigens
(Lassila et al., 1978, 1982).
Обнаружение этих внутриэмбриональных HSC и их вклада в дефинитивный гематопоэз у птиц вскоре стало общепринятым. Экспериментальная схема была перенесена на эмбрионы амфибий, у которых некоторые виды обладают т. наз. 'dorsal' дорсальным компартментом гематопоэтических предшественников (rev. Turpen, 2001), который действительно эквивалентен аортальной области у птиц и млекопитающих. В мышиных моделях проблема никак не могла разрешиться вплоть до 1993, пока не был достигнут консенсус, что у млекопитающих онтогенез гематопоэза 'different'.
Затем два разных подхода дали результаты, подтверждающие и дополняющие др. др. Нами были выбраны стадии между 8 и 25 парами сомитов (E8.5-9.5 embryo), когда изучаемые структуры были крошечными и количество доступных клеток очень мало, что делало пригодной классическую in vitro клональную культуру (rev. Godin and Cumano, 2005 in this issue). тестировали область будущей каудальной части кишки, широко открытой и продолжающейся в желточный мешок; она включала энтодерму и мезодерму (splanchopleura) и два аортальных рудимента. Мы назвали эту область 'Para-aortic Splanchnopleura' (P-Sp) (Рис. 2). Ткань рассекалась на отдельные клетки и рассеивалась на питательный слой клеток, продуцирующих фактор роста в полу-твердой среде, обогащенной соотв. факторами роста, клетки давали миэлоидные и лимфоидные колонии между стадиями 15 и 25 пар сомитов. Желточный мешок также давал эти колонии, тогда как остальная часть эмбриона их не продуцировала. Кровообращение устанавливалось около стадии 6-7 пар сомитов у эмбрионов мышей, эти эксперименты не позволили сделать заключение относительно первичного происхождения предшественников, присутствующих в каждом из этих мест. Тогда экспериментальная схема была перенесена на эмбрионов до 7 пар сомитов. Предшественники были выявлены как во внутриэмбриональном, так и внеэмбриональном компартменте, демонстрируя, что одно из условий выполнено; анатомически ассоциированные зародышевые слои культивировали in toto 2 дня перед диссоциацией и клональными культурами. В этих условиях были исключены обмены сосудистыми клетками до возникновения ткани, клеточные типы или клеточные слои могли взаимодействовать, позволяя осуществлению событий предопределения. P-Sp давала миелоидные и лимфоидные колонии, тогда как желточный мешок давал только миелоидные колонии, указывая тем самым, что как и у птиц эмбрионы сами продуцируют HSC с более широким потенциалом, чем HSC желточного мешка.
Технологии
in vitro очень хорошо подходили для выявления присутствующих предшественников на ранних стадиях эмбриогенеза, но имели ряд ограничений, т.к. они идентифицировали плюрипотентные колонии, а не Long Term Reconstituting Hematopoietic Stem Cells (LTR-HSC) (see Godin and Cumano, 2005 in this issue for particulars). Чтобы установить, продуцируются ли такие LTR-HSC собственно эмбрионом, Elaine Dzierzak
и его группа использовали reconstitution технологию: облученным взрослым мышам инъецировали клетки от эмбрионов. Эти исследователи использовали довольно поздние стадии (30 - 42 пар сомитов, т.e., E10-11.5); к этому времени два аортальных рудимента сливались, кишечник закрывался, начинали дифференцироваться новые рудименты - гонады и почки - в этой области (обозначаемой теперь 'Aorta-Gonad-Mesonephros' или AGM) (рис. 2) и кровоснабжение было полностью развитым (rev. Ling and Dzierzak, 2001). Их выводы расширили наши: AGM даёт LTR-HSC, тогда как желточный мешок нет.
Dorsal (somitic) versus ventral mesoderm: different
capacities regarding hematopoietic and endothelial differentiation
Согласно разнообразным доказательствам энтодермальный контакт является критическим для мезодермы, чтобы давать кровь и кровеносные сосуды. Прекрасный пример был найден, когда желточный мешок (mesoderm + endoderm), мощный ангиобластный и гемогенный придаток (Wilt, 1965;
Kessel and Fabian, l987; Flamme, 1989; Flamme and Risau, 1992) сравнивался с амнионом. Этот последний придаток (mesoderm + ectoderm) никогда не даёт ни сосудистой системы, ни кровяных клеток.
Возникает два вопроса: i) как и где возникают ангиобласты, предшественники endothelial cells (EC), детерминируются ли они внутри собственно эмбриона? ii) каковы онтогенетические взаимоотношения между ангиобластами и HSCS? В то время мы сконцентрировались на этой проблеме, сомиты были только идентифицированы как источник ангиобластов в эмбриональном теле (Noden, 1991; Wilting et al., 1995). Используя MB1/QH1,
мы сравнивали развитие сосудистой сети в почках конечностей и рудиментах висцеральных органов (Pardanaud et al., 1989). Почка конечности и костный мозг внутри почки конечности, по-видимому, колонизируется ангиобластами и HSC, оба из внешнего источника, как отмечали ещё Jotereau and Le Douarin
(1978). Т.о., соматоплевральная мезодерма не обладает потенциалом для васкулогенеза (т.e., в этой мезодерме нет клеток, предопределенных для ангиобластного пути). Напротив висцеральные рудименты, т.к они также были колонизированы за счёт HSC, формировали внутреннюю сосудистую сеть, происходящую из их мезодермального компонента. Оригинальное исследование
Pudlewski and Pardanaud, 2005 (this issue) подтвердило, что эти разные модели васкуляризации работают в мышиных рудиментах, а именно, что ангиобласты, колонизирующие зачатки конечностей мышей, трансплантированные эмбрионам перепела, происходят от хозяина, тогда как висцеральные рудименты развивают мышиную, т.е. внутренне присущую эндотелиальную сеть.
Чтобы засечь место происхождения этих ангиобластов и определить территории, ими колонизируемые, осуществляли orthotopic трансплантации сомитов или splanchnopleural мезодермы от перепела хозяевам курам (Pardanaud et al., 1996; Pardanaud and Dieterlen-Lievre, l999). Происходящие из сомитов ангиобласты колонизировали стенку тела и зачатки конечностей, но никогда не проникали в висцеральные производные; более того, они давали верхнюю и латеральную часть эндотелия аорты. Интересно, что эти ангиобласты не проникали в нижнюю часть аорты. Напротив, производные спланхноплевры ангиобласты помимо того, что они также колонизировали стенку тела, они проникали в висцеральные зачатки и вносили вклад в весь аортальный эндотелий, составляющий нижнюю часть аорты. Производные splanchnopleura клетки, которые интегрировались в дно аорты, участвовали в создании 'intra-aortic clusters'. Эти группы клеток, описанные у всех видов, которые были изучены (Jordan, 1914;
Emmel, 1916; Dieterlen-Lievre and Martin, 1981; Garcia-Porrero
et al., 1995; Wood et al., 1997; Tavian et al., 1996) тесно ассоциировали с вентральным эндотелием аорты и рассматриваются как источник внутриэмбриональных HSC. Их природа предшественников крови подтверждена экспрессией CD41, HSC-специфическго антигена, который ограничен этими калстерами клеток у кур и мышей (rev. Corbel et al., 2005 in this issue).
Т.о., i) сомиты дают ангиобласты, чей потенциал ограничен васкулогенезом и которые ответственны за васкуляризацию стенки тела; ii) splanchnopleural-производные 'hemangioblasts' (см. Eichmann et al., 2005 in this issue) обладают более широким потенциалом и способны васкуляризовать весь эмбрион. Спланхноплевральные клетки, которые локализуются в донной части аорты обладают двойным потенциалом, т.е. дают и эндотелиальные и гематопоэтические клетки. Проникновение в дно аорты является необходимым для экспрессии их гематопоэтического потенциала. Возможно манипулировать с потенциалами этих двух типов предшественников: сомиты предварительно подвергнутые контакту с энтодермой или культивируемые в среде, содержащей VEGF, BFGF или TGFβ приобретают
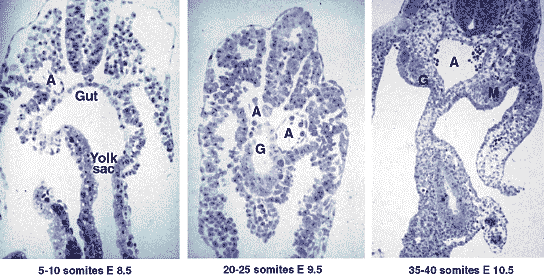 Fig. 2. Developmental relationship between Para-aortic Splanchnopleura (P-Sp) and Aorta-Gonad-
Mesonephros (AGM). Semi-thin transverse sections in the post-umbilical region, toluidine blue. At the 5-10 pairs of somites stage, the gut is wide open onto and continuous with the yolk sac, the mesoderm lining the
endoderm contains the two aortic rudiments (A) but no organ rudiments; at 20-25 pairs of somites, the gut (G) has closed; at 35-40 pairs of somites, the dorsal aorta has formed by fusion of the two initial rudiments, the
gonads and mesonephros rudiments have appeared.
Fig. 2. Developmental relationship between Para-aortic Splanchnopleura (P-Sp) and Aorta-Gonad-
Mesonephros (AGM). Semi-thin transverse sections in the post-umbilical region, toluidine blue. At the 5-10 pairs of somites stage, the gut is wide open onto and continuous with the yolk sac, the mesoderm lining the
endoderm contains the two aortic rudiments (A) but no organ rudiments; at 20-25 pairs of somites, the gut (G) has closed; at 35-40 pairs of somites, the dorsal aorta has formed by fusion of the two initial rudiments, the
gonads and mesonephros rudiments have appeared.
более широкий потенциал, тогда как спланхноплевральная мезодерма, обработанная эктодермальным контактом или культивируемая с TGF или EGF теряет его (Pardanaud et al., 1999).
Используя эндотелий-специфический эндоцитоз липопротеинов низкой плотности мы проследили
in situ эволюцию аортального эндотелия и установили, что эндотелиальные клетки с характерным фенотипом присутствуют в донной части аорты на ст. E2, они дают спустя 24 ч гематопоэтические кластеры (Jaffredo et al., 1998). Сходный подход использован для культивируемых мышиных эмбрионов и установлено то же самое происхождение (Sugyiama et al., 2003). Tavian, Peault и др. (Tavian and Pеault, 2005 in
this issue), проследили антигенную спецификацию разных типов клеток у эмбрионов человека, пришли к сходному заключению. Эти находки таким образом подтвердили мнение, сформулированное цитологами в первой половине XXth века, о 'hemogenic endothelium'.
The avian allantois as a source of hematopoietic
progenitors and angioblasts
В 1998 мы показали, что зачаток алантоиса, взятые от перепела на преваскулярной стадии и трансплантированные в целом кур, давали предшественников, которые колонизировали костный мозг хозяина и давали в нём гематопоэтические и эндотелиальные клетки (Caprioli
et al., 1998, 2001; see Jaffredo et al., 2005 in this issue). Такая провоцирующая двойная колонизация может указывать на то, что или самостоятельные предшественники из двух клонов путешествуют в кровообращении или что общий предшественник, гемангиобласт, является той клеткой, которая циркулирует и дифференцируется в микроусловиях костного мозга по двум путям. Экспериментальные аргументы существования гемангиобластов накапливаются (Jaffredo et al., 2005
and Eichmann et al., 2005, both in this issue), подтверждая вторую интерпретацию. Эта находка у модельных птиц согласуется с тем фактом, что эндотелиальные предшественники, несущие HSC-специфический антиген CD34, как известно, циркулируют в крови взрослых мышей во время репаративных процессов (Asahara et al., 1997; Raffii, 2000).
В любом случае открываются две интересные перспективы на будущее: i) васкуляризуется ли костный мозг эмбрионов и плодов кровь рождающими предшественниками параллельно с процессом засеивания HSC? ii) открытие нового места продукции стволовых клеток ставит вопрос о том, как долго во время развития этот процесс может происходить.
The mouse placenta as a hematopoietic organ
Печень плода, чей рудимент засевается HSC (Johnson and Jones, 1973; Houssaint, 1981) рассматривается как главный гематопоэтический орган у плодов млекопитающих. Плацента серьёзно не рассматривалась для выполнения подобной функции, до сих пор мы предпринимали исследования возможной роли этого придатка во время гематопоэтического развития (Alvarez-Silva et al., 2003). Идея была подтверждена нашей находкой, что аллантоис птиц может давать HSCs in situ и что образование плаценты у млекопитающих влечет за собой слияние аллантоиса с эктоплацентным конусом. Downs et al. (1998) ещё раньше указывали на возможность эритропоэтической функции аллантоиса мышей перед слиянием. Их эксперименты имели дело с аллантоисами на ст. головной складки, которые эксплантировли в органную культуру вплоть до стадии 15 сомитов. Они наблюдали, что васкуляризация развивается in situ, но не нашли каких-либо признаков образования эритроцитов, неудивительно, т.к. время и условия были не адекватными.
Мы впервые выявили колонии-формирующие предшественники в плаценте между E10 и E17 (Alvarez-Silva et al., 2003), используя диссоциацию с помощью collagenase на отдельные клетки и последующего культивирования в полу-твердой среде, содержащей смесь цитокинов. Чтобы определить могут ли колонии возникать из плодного или материнского компонентов плаценты, получали гетерозиготных плодов, несущих один аллель повсеместно экспрессирующегося GFP трансгена, полученных в результате скрещиваний GFP+ самцов с wt самками. Большинство колоний оказалось GFP позитивными, они были в 2-4 раза более многочисленны, чем полученные из печени на всех стадиях, а пропорция колоний, происходящих из очень ранних колоний (CFUGEMM) была очень высокой. Более того, получено огромное количество колоний, которые были субклонированы в течение, по крайней мере, 60 дней. Эти данные указывают на то, что в самом деле плацента является активным местом гематопоэза. При сравнении с печенью плодов на всех изученных стадиях гематопоэтическая популяция в плаценте более богата очень ранними предшественниками, в частности High Proliferation Potential-HSC. Однако, как упоминалось выше, LTR-HSC рассматриваются как характерный признак настоящих HSC (Gekas et al., 2005; Ottersbach and Dzierzak, 2005). Интересно, что концентрация этих LTR-HSC достигает пика очень рано, примерно в то же самое время, когда они присутствуют в области AGM
(E11 или около 42 сомитов), но они сохраняются дольше в плаценте, а именно вплоть до E13. Их исчезновение, однако предвосхищается несколькими днями исчезновения in vitro колонии-формирующих предшественников.
Остается вопрос, связанный с происхождением этих стволовых клеток и предшественников в плаценте. Детерминируются ли они в этой области или они просто проникают в плаценту, напр., после возникновения в AGM? Мы исследовали этот аспект, используя подход, который оказался эффективным в случае P-Sp: перфузия аллантоисов, полученных от GFP/+ эмбрионов между стадиями 1 и 7 пар сомитов, культивируемых
in toto в течение 4-5 дней и только после этого диссоциированных на одиночные клетки и посеянных в полу-твердую среду. Чётко колонии-формирующие предшественники продуцировались аллантоисом (Salaun, Corbel, Dieterlen-Lievre, submitted).
Conclusion and perspectives
Why is it important to understand when and where and how
stem cells that are at the origin of a tissue become committed?
This endeavour has been going on, in the case of HSC, for nearly
40 years and is evidently not a closed case. While the molecular
events are actively investigated using mouse embryonic stem
cells differentiating in vitro, it remains important to establish what
happens in the growing embryo, which clearly does not obey the
same mechanisms. We have found that the emergence of HSC
moves around from one site to another and is an event spread out
on a long period of development. This is not such a surprise,
considering the enormous amplification of the blood cell population
that embryonic growth requires. How long in life the commitment
of HSC may occur is still a black box. Seeing the vivid interest
presently devoted to adult stem cells, because of their apparently
extended plasticity and the therapeutic potential this plasticity
may provide, it is crucial to understand precisely how these cells
become specified during development.
YS cells should not be considered as HSC, but rather as
progenitors. Indeed they do not display long term renewal potential
and their differentiation capacities appear restricted to the myeloid
lineage. This restriction may be due to environmental pressures
but also to distinct molecular features of this first generation. For
instance P-Sp progenitors were shown to lack LTR-HSC potential,
because they do not display full MHC class I expression, which
makes them prone to elimination by NK cells (see Godin and
Cumano, 2005 in this issue).
The pendulum now swings back to an extraembryonic
appendage, the allantois in birds and the placenta in mammals.
Notably the sites, in which HSC become committed, are as a rule
‘ventral’ sites, in which the mesoderm is associated to endoderm.
This is indeed the case in the allantois. The endoderm is known
to produce ventralizing molecules such as BMPs and VEGF.
The developmental relationship between HSC and angioblasts
appears complex with a population of purely angioblastic
progenitors of dorsal origin and a population of hemangioblasts of
ventral origin. The possible plasticity between the two populations
even in the grown organism is evidently a crucial issue for
therapeutic delivery of drugs and repair of tissues.
 Fig. 1. The yolk sac chimera. (A) Surgical construction of the chimera at E2. The suture
line is visible between the quail embryonic body (neural tube and somites) and the chick
extra-embryonic area. (B) Quail embryo growing with a chick yolk sac 12 days after the
operation.
Fig. 1. The yolk sac chimera. (A) Surgical construction of the chimera at E2. The suture
line is visible between the quail embryonic body (neural tube and somites) and the chick
extra-embryonic area. (B) Quail embryo growing with a chick yolk sac 12 days after the
operation.  Fig. 2. Developmental relationship between Para-aortic Splanchnopleura (P-Sp) and Aorta-Gonad-
Mesonephros (AGM). Semi-thin transverse sections in the post-umbilical region, toluidine blue. At the 5-10 pairs of somites stage, the gut is wide open onto and continuous with the yolk sac, the mesoderm lining the
endoderm contains the two aortic rudiments (A) but no organ rudiments; at 20-25 pairs of somites, the gut (G) has closed; at 35-40 pairs of somites, the dorsal aorta has formed by fusion of the two initial rudiments, the
gonads and mesonephros rudiments have appeared.
Fig. 2. Developmental relationship between Para-aortic Splanchnopleura (P-Sp) and Aorta-Gonad-
Mesonephros (AGM). Semi-thin transverse sections in the post-umbilical region, toluidine blue. At the 5-10 pairs of somites stage, the gut is wide open onto and continuous with the yolk sac, the mesoderm lining the
endoderm contains the two aortic rudiments (A) but no organ rudiments; at 20-25 pairs of somites, the gut (G) has closed; at 35-40 pairs of somites, the dorsal aorta has formed by fusion of the two initial rudiments, the
gonads and mesonephros rudiments have appeared.